Презентація на тему:
реакції
Завантажити презентацію
реакції
Завантажити презентаціюПрезентація по слайдам:
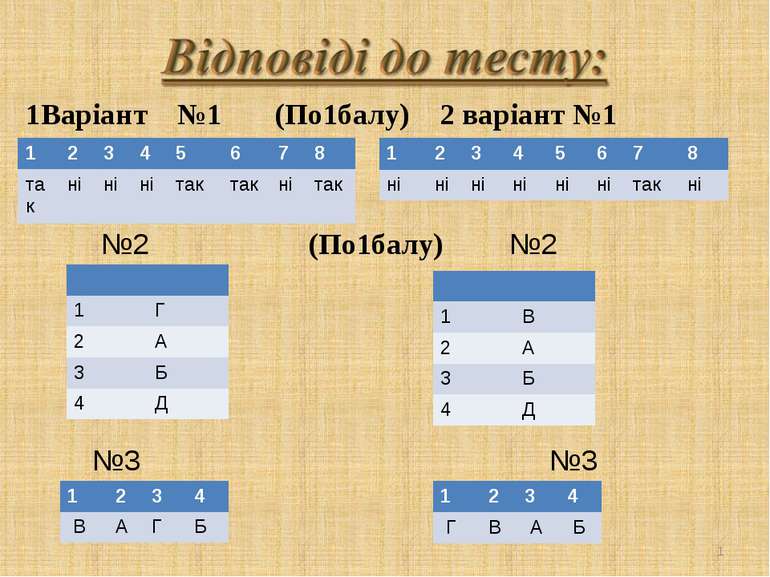
* 1Варіант №1 (По1балу) 2 варіант №1 №2 (По1балу) №2 №3 №3 1 2 3 4 5 6 7 8 так ні ні ні так так ні так 1 2 3 4 5 6 7 8 ні ні ні ні ні ні так ні 1 Г 2 А 3 Б 4 Д 1 В 2 А 3 Б 4 Д 1 2 3 4 В А Г Б 1 2 3 4 Г В А Б
Мета уроку : Повторити теоретичний матеріал про окисно- відновні реакції. Удосконалювати навики складання електронних балансів окисно- відновних реакцій. Розкрити значення окисно- відновних реакцій.
Добре, що ця реакція відбувається тільки при температурі грозових розрядів N2 +O2→ 2NO 2NO+O2→2NO2
Виверження вулкану супроводжується низкою окисно-відновних реакцій: S + O2 → SO2 H2S + O2 → SO2 + H2O Н2S + SO2 → H2SO4 + S Складіть ці рівняння методом електронного балансу.
Корозія (руйнування) металів – негативне значення окисно- відновних реакцій. 2Fe + O2 +2H2O → 2Fe(OH)2 4Fe(OH)2 + O2 +2H2O → 4Fe(OH)3
Пірометалургія 2FeO + 2C → 2Fe + CO2 Металотермія Cr2O3 +2Al → Al2O3 +2Cr Воднетермія V2O5 + 5H2 → 2V +5H2О Електроліз 2Na Cl → 2Na +Cl2 Більшість металів зустрічаються в природі у вигляді сполук. Добування металів з руд – завдання металургії. Це одна з найдавніших галузей хімічної промисловості.
Горіння сірника : (одна з реакцій) KClO3 + S → KCl + SO2 Горіння метану: СH4 +2О 2 → CO2 + 2H2О Горіння вугілля: С +О 2 → CO2
Синтез аміаку N2 + 3H 2 → 2NH3 Виробництво Н 2SO4 1стадія: S + O 2 → SO 2 2стадія: 2SO 2 + O 2 → 2SO3
Схожі презентації
Категорії