Презентація на тему:
Поняття пРО РОЗЧИНИ. KОЛІГАТИВНІ ВЛАСТИВОСТІ РОЗЧИНІВ
Завантажити презентацію
Поняття пРО РОЗЧИНИ. KОЛІГАТИВНІ ВЛАСТИВОСТІ РОЗЧИНІВ
Завантажити презентаціюПрезентація по слайдам:
Розчин – дво- або багатокомпонентна гомогенна система, склад якої може безперервно змінюватися у межах, визначених розчинністю Вода – самий поширений на планеті розчинник вода добре розчиняє іонні й більшість полярних сполук. Така властивість води пов’язана значною мірою з її високою діелектричною проникністю. властивості води: високий поверхневий натяг, низька в’язкість, високі температури плавлення; високі температури кипіння; більш висока густина у рідкому стані, аніж у твердому.
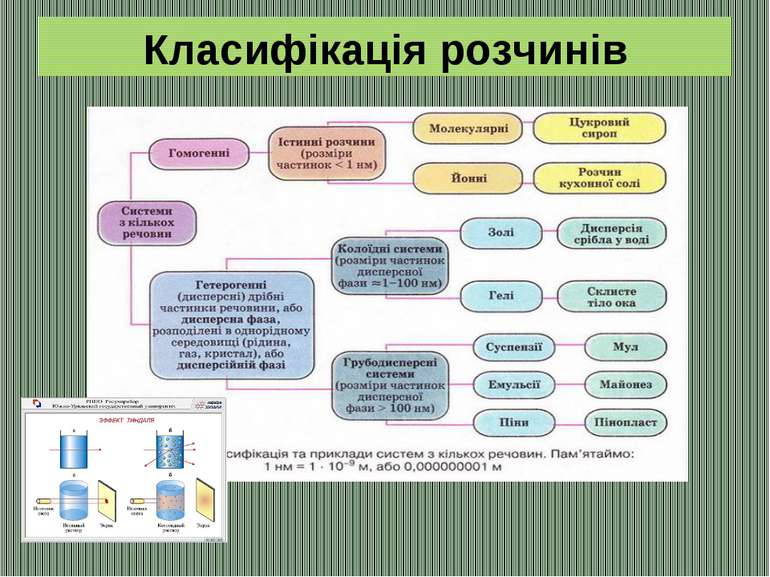
Класифікація розчинів Розчини речовин з молярною масою менше 5000 г/моль називають розчинами низькомолекулярних сполук (НМС), а розчини речовин з молярною масою понад 5000 г/моль – розчинами високомолекулярних сполук (ВМС). Речовини, які за таких самих умов не розпадаються на іони і електричний струм не проводять – неелектроліти (до них належать більшість органічних сполук). Речовини, що розпадаються на іони в розчинах або розплавах, проводять електричний струм – електроліти (до них належать кислоти, основи і майже усі солі).
Насиченим називається розчин, який перебуває у динамічній рівновазі з надлишком розчиненої речовини. У ненасиченому розчині міститься менше речовини, а в пересиченому – більше, ніж у насиченому. Пересичені розчини досить нестійкі. Легке струшування посудини або добавляння в розчин кристала солі викликає випадання в осад надлишку розчиненої речовини.
Способи вираження концентрації розчинів Масова частка – це відношення маси розчиненої речовини до маси розчину. Виражається в частці від 1 або в %: W = m(розч.реч-ни) / m(р-ну) 100% Молярність (молярна концентрація) – це число молів розчиненої речовини в 1 л розчину. Виражається в моль/л: (М)СМ = n(реч, моль) / Vроз – ну (моль/л) нормальність (молярна концентрація еквівалента) - це число еквівалентів розчиненої речовини в 1 л розчину. Нормальність позначають N і вимірюють в молях на літр: N = n(еквів) / Vр-ну, моль/л Мольна частка – це відношення числа молів розчиненої речовини до загального числа молів розчину (розчинника і розчиненої речовини). Х1 = n1/n1+n2 Моляльна концентрація (моляльність) – це кількість молів розчиненої речовини в 1 кг розчинника. Позначається : m = n(реч)/Vр-ну, (г/мл, г/л) Титр розчину – це число грамів розчиненої речовини в 1 мл розчину Т = m(реч)/Vр-ну, (г/мл, г/л).
Теорії утворення розчинів Хімічна теорія розчинів (Д.І.Менделєєв) припускає хімічну взаємодію компонентів розчину і утворення неміцних і частково дисоційованих сполук між розчиненою речовиною і розчинником. Такі сполуки називаються сольватами (гідратами), а процес їх утворення внаслідок взаємодії компонентів розчину – сольватацією (гідратацією). Терміни “гідрати” і “гідратація” застосовують, коли розчинником є вода. Про утворення сольватів або гідратів можна дізнатися за зовнішніми змінами, що відбуваються з розчинами, наприклад, за : 1. Зміною об’єму при розчиненні; 2. За зміною забарвлення розчину при розчиненні. Сучасна теорія розчинів об'єднує фізичну і хімічну теорії Фізична теорія розчинів (Я. Вант - Гофф і С. Арреніус) розглядає процес розчинення, як диспергування однієї речовини у всьому об’ємі іншої, а отже, властивості розчинів мають залежати лише від концентрації розчиненої речовини. За цією теорією розчинник – це індиферентне середовище, в якому хаотично розподілені часточки розчиненої речовини.
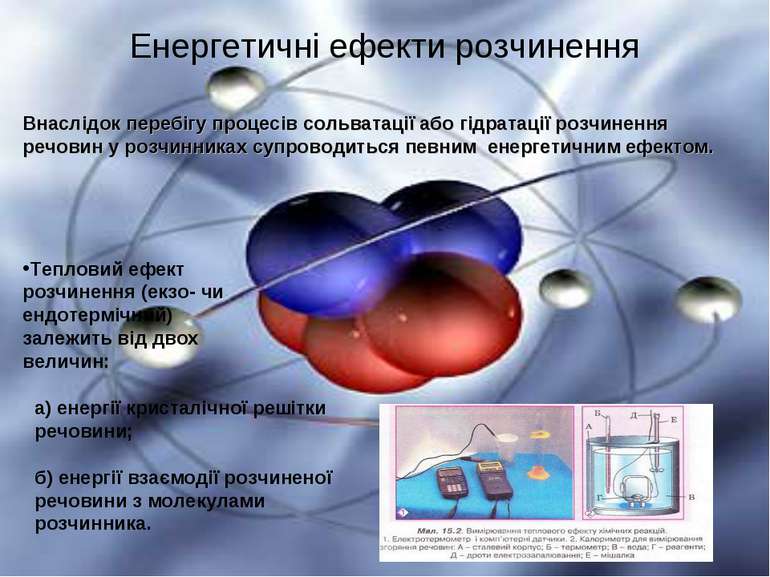
Енергетичні ефекти розчинення Внаслідок перебігу процесів сольватації або гідратації розчинення речовин у розчинниках супроводиться певним енергетичним ефектом. а) енергії кристалічної решітки речовини; б) енергії взаємодії розчиненої речовини з молекулами розчинника. Тепловий ефект розчинення (екзо- чи ендотермічний) залежить від двох величин:
Поняття про розчинність. Розчинність – це максимальна маса речовини, яка може за даних умов (температури, тиску) розчинитись у певному розчиннику масою 100 г. Добре розчинні речовини - розчинність перевищує 10 г на 100 г розчинника (сульфатна, нітратна, оцтова кислоти, ацетон, гліцерин). Розчинні речовини - якщо розчинність речовин від 1 до 10 г на 100 г розчинника (бром) Малорозчинні речовини - розчинність від 0,001 до 1 г на 100 г розчинника (азот, кальцій карбонат).
Вплив екзогенних чинників на розчинність речовин Якщо процес розчинення відбувається ендотермічно, то з підвищенням температури розчинність зростає, а якщо екзотермічно, то – зменшується. При розчиненні твердих речовин у воді, об’єм системи звичайно змінюється незначно. Тому розчинність речовин, які знаходяться в твердому стані, практично не залежить від тиску. На розчинність твердих речовин суттєво впливає температура. Рідини можуть розчинятися в рідинах. З підвищенням температури взаємна розчинність рідин збільшується доти, поки не буде досягнута температура, при якій обидві рідини змішуються в будь-яких пропорціях. взаємне розчинення рідин не супроводжується значною зміною об’єму. Взаємна розчинність рідин мало залежить від тиску і помітно зростає лише при дуже високих тисках (порядку тисяч атмосфер).
Розчинність газів – процес екзотермічний, тому з підвищенням температури розчинність газів зменшується. Розчинність газів залежить не лише від температури, а й від тиску. При розчиненні газу в рідині встановлюється рівновага: Газ + рідина насичений розчин газу в рідині. При цьому об’єм системи істотно зменшується. Відповідно, підвищення тиску повинно приводити до зміщення рівноваги вправо, тобто до збільшення розчинності газу. Закон Генрі: розчинність газу при сталій температурі в рідині прямо пропорційна його парціальному тиску. При Т = соnst: m = k p, де m – маса газу, який розчиняється в 1 л розчинника; р - тиск газу (або парціальний тиск, коли маємо суміші газів); k – коефіцієнт, який характеризує природу компонентів розчину. Важливий наслідок із закону Генрі: об’єм газу, який розчиняється при постійній температурі в даному об’ємі рідини, не залежить від його парціального тиску.
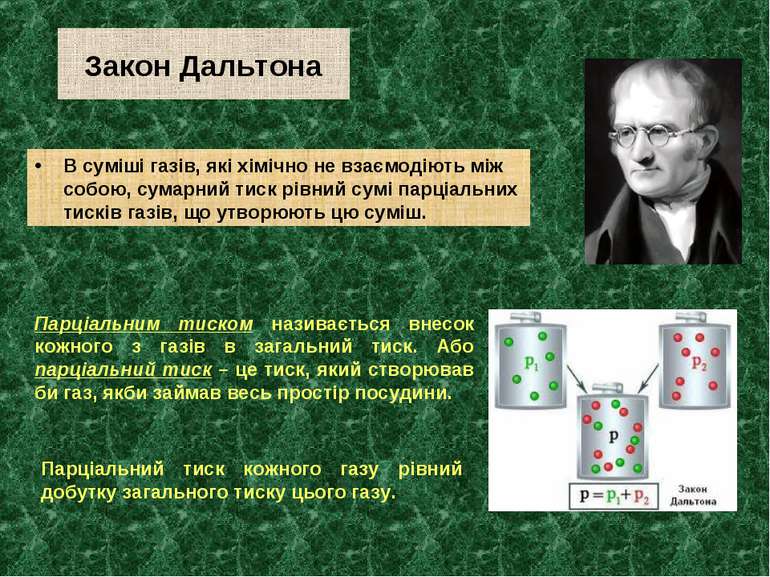
Закон Дальтона В суміші газів, які хімічно не взаємодіють між собою, сумарний тиск рівний сумі парціальних тисків газів, що утворюють цю суміш. Парціальним тиском називається внесок кожного з газів в загальний тиск. Або парціальний тиск – це тиск, який створював би газ, якби займав весь простір посудини. Парціальний тиск кожного газу рівний добутку загального тиску цього газу.
Знання законів Генрі та Дальтона дозволяє правильно аналізувати газообмін в організмі, який проходить в легенях. Поступлення газів з повітря в кров, і навпаки, підчиняється закону Генрі. Між парціальними тисками газів в крові та повітрі існують відмінності, які забезпечують обмін газів. Сеченов досліджував процеси розчинення газів у фізіологічних рідинах та сольових розчинах. Він встановив, що розчинність газів в розчинах електролітів менша, ніж в чистому розчиннику. Кров містить велику кількість різних компонентів, в тому числі і іонів елктролітів, тому розчинність їх в оксигені, нітрогені та вуглекислому газі нижча, ніж у воді. Дослідженнями розчинності газів в крові займався російський фізіолог Сеченов. Ним був сконструйований прилад – абсорціометр, з допомогою якого визначався якісний склад газів, розчинених в крові
Гірська хвороба виникає внаслідок кисневої недостатності, так як на великих висотах парціальний тиск кисню значно зменшується, а разом з тим зменшується і його тиск в крові. Велике значення для боротьби з гірською хворобою мають тренування в барокамерах, в результаті яких організм виробляє реакції різних органів на зменшення вмісту кисню в крові: пришвидшується дихання, збільшується кількість еритроцитів, підвищується стійкість тканин до нестачі кисню. На великих глибинах, де зовнішній тиск збільшується, збільшується розчинність газів в крові. При швидкому підйомі з глибини розчинність газів різко зменшується, вони виділяються у вигляді міхурців і закупорюють судини. Особлива тяжкі наслідки спостерігаються при закупорці судин мозку. Основним заходом попередження кесонної хвороби є повільний підйом з тривалими зупинками для приведення організму в рівновагу із зовнішнім середовищем.
Колігативні властивості розчинів Властивості розчинів, які залежать лише від їхньої концентрації і не залежать від природи розчиненої речовини, називаються колігативними. До них належить дифузія, осмотичний тиск, зниження щільності пари розчинника над розчином, підвищення температури кипіння і зниження температури замерзання розчинів. Дифузія – процес самовільного вирівнювання концентрації розчину речовини. Кожна речовина переноситься туди, де її концентрація менша. Такий процес називається дифузією.
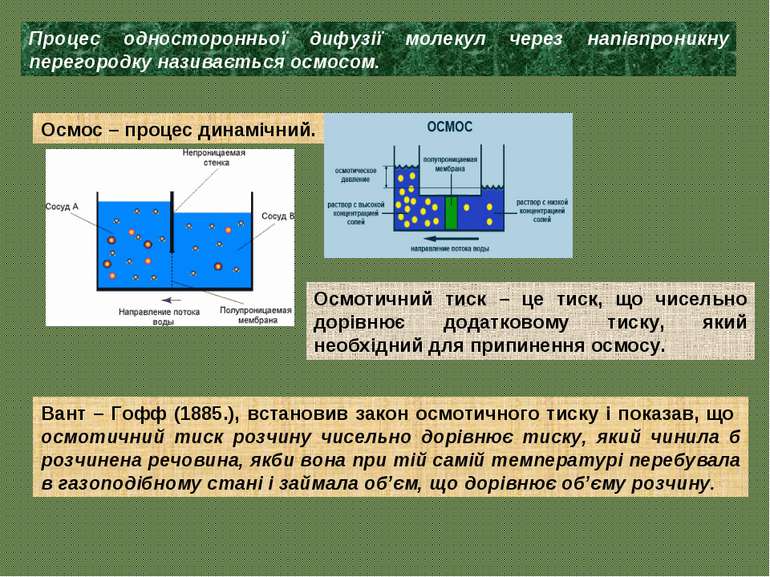
Процес односторонньої дифузії молекул через напівпроникну перегородку називається осмосом. Осмос – процес динамічний. Осмотичний тиск – це тиск, що чисельно дорівнює додатковому тиску, який необхідний для припинення осмосу. Вант – Гофф (1885.), встановив закон осмотичного тиску і показав, що осмотичний тиск розчину чисельно дорівнює тиску, який чинила б розчинена речовина, якби вона при тій самій температурі перебувала в газоподібному стані і займала об’єм, що дорівнює об’єму розчину.
Вимірявши осмотичний тиск різних розчинів, встановили, що величина осмотичного тиску залежить від концентрації розчину і його температури, але не залежить від природи розчиненої речовини і розчинника. У 1886 році Вант – Гофф показав, що осмотичний тиск розбавлених розчинів підлягає законом ідеальних газів Бойля – Маріотта і Гей – Люссака і що залежність осмотичного тиску від концентрації і температури розчину виражається рівнянням: Pосм = CRT, де Р – осмотичний тиск розчину; С – молярна концентрація розчину; R – універсальна газова стала; Т – абсолютна температура розчину.
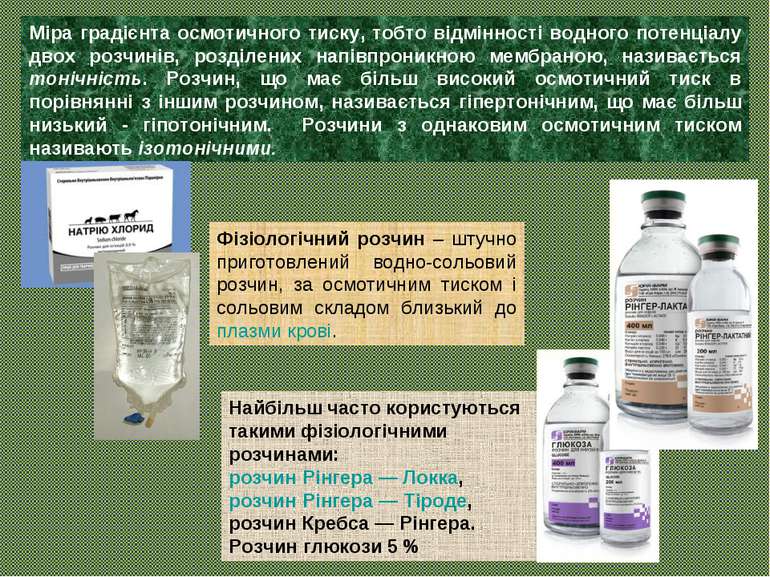
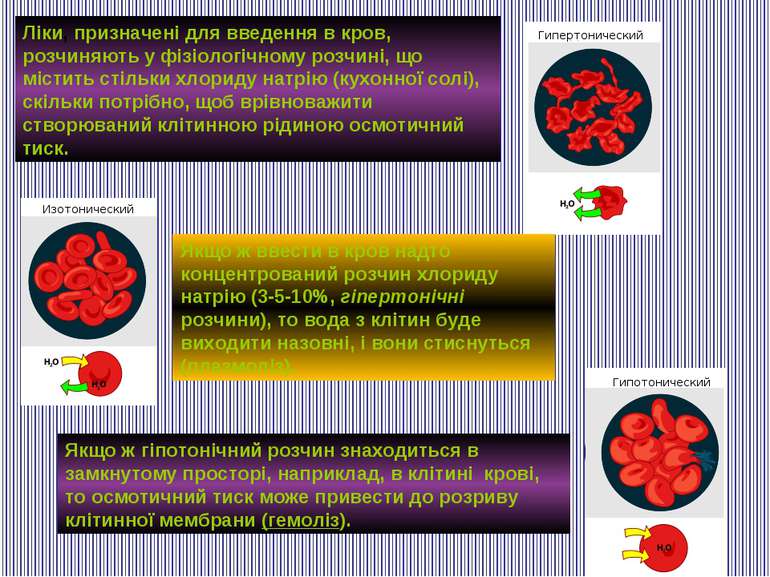
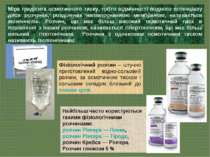
Міра градієнта осмотичного тиску, тобто відмінності водного потенціалу двох розчинів, розділених напівпроникною мембраною, називається тонічність. Розчин, що має більш високий осмотичний тиск в порівнянні з іншим розчином, називається гіпертонічним, що має більш низький - гіпотонічним. Розчини з однаковим осмотичним тиском називають ізотонічними. Фізіологічний розчин – штучно приготовлений водно-сольовий розчин, за осмотичним тиском і сольовим складом близький до плазми крові. Найбільш часто користуються такими фізіологічними розчинами: розчин Рінгера — Локка, розчин Рінгера — Тіроде, розчин Кребса — Рінгера. Розчин глюкози 5 %
Якщо ж гіпотонічний розчин знаходиться в замкнутому просторі, наприклад, в клітині крові, то осмотичний тиск може привести до розриву клітинної мембрани (гемоліз). Ліки, призначені для введення в кров, розчиняють у фізіологічному розчині, що містить стільки хлориду натрію (кухонної солі), скільки потрібно, щоб врівноважити створюваний клітинною рідиною осмотичний тиск. Якщо ж ввести в кров надто концентрований розчин хлориду натрію (3-5-10%, гіпертонічні розчини), то вода з клітин буде виходити назовні, і вони стиснуться (плазмоліз).
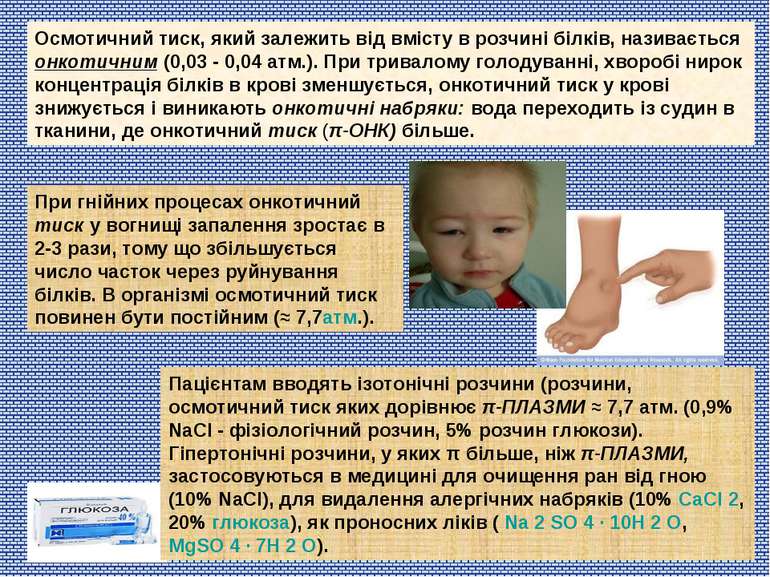
Осмотичний тиск, який залежить від вмісту в розчині білків, називається онкотичним (0,03 - 0,04 атм.). При тривалому голодуванні, хворобі нирок концентрація білків в крові зменшується, онкотичний тиск у крові знижується і виникають онкотичні набряки: вода переходить із судин в тканини, де онкотичний тиск (π-ОНК) більше. Пацієнтам вводять ізотонічні розчини (розчини, осмотичний тиск яких дорівнює π-ПЛАЗМИ ≈ 7,7 атм. (0,9% NaCl - фізіологічний розчин, 5% розчин глюкози). Гіпертонічні розчини, у яких π більше, ніж π-ПЛАЗМИ, застосовуються в медицині для очищення ран від гною (10% NaCl), для видалення алергічних набряків (10% CaCl 2, 20% глюкоза), як проносних ліків ( Na 2 SO 4 ∙ 10H 2 O, MgSO 4 ∙ 7H 2 O). При гнійних процесах онкотичний тиск у вогнищі запалення зростає в 2-3 рази, тому що збільшується число часток через руйнування білків. В організмі осмотичний тиск повинен бути постійним (≈ 7,7атм.).
Різниця між температурами кипіння розчину і чистого розчинника називається підвищенням температури кипіння розчину ( t кип). Різниця між температурами замерзання чистого розчинника і розчину називається зниженням температури замерзання розчину ( t зам). Рауль встановив, що для розбавлених розчинів неелектролітів підвищення температури кипіння і зниження температури замерзання пропорційні концентрації розчину (другий закон Рауля): tкип = Е Сm, tзам = K Сm. де Сm– моляльна концентрація розчину; Е – ебуліоскопічна стала; К – кріоскопічна стала. Значення Е і К сталих не залежить від концентрації і природи розчиненої речовини, а залежить лише від природи розчинника.Величини Е і К вимірюються в градусах. Індивідуальні речовини характеризуються певними температурами переходів з одного агрегатного стану в інший. Всяка рідина починає кипіти при t , при якій тиск її насиченої пари досягає величини зовнішнього тиску. Інакше стоїть справа з розчинниками. Наявність розчиненої речовини зменшує тиск пари розчинів, чим підвищує температуру кипіння і знижує температуру замерзання розчинника, і тим сильніше, чим більшу концентрацію має розчин.
Визначення молекулярних мас речовини за зниженням температури замерзання або підвищенням температури кипіння розчинів називається відповідно кріоскопією (кріоскопічний метод) або eбуліоскопією (ебуліоскопічний метод). Ці методи використовуються для встановлення складу сполук, визначення ступеня дисоціації електролітів, вивчення процесів полімеризації й асоціації речовин у розчинах.
Схожі презентації
Категорії