Презентація на тему:
Поняття про будову атома
Завантажити презентацію
Поняття про будову атома
Завантажити презентаціюПрезентація по слайдам:
Стан електрона в атомі Кожен електрон рухається навколо ядра так швидко, що його не тільки не можна розглянути за допомогою найпотужнішого мікроскопа, але неможливо навіть представити у вигляді крапки, що рухається по певній траєкторії. Електрон має подвійну природу (дуалізм)- частинки і хвилі. Електрони немов "розмазані" в просторі і утворюють електронні хмари – атомні орбіталі. Навколо ядра електрони можуть утворювати орбіталі (хмари) різної форми:
s-орбіталь сферичну s-орбіталь – кулеподібну електронну хмару (немов нещільно намотаного клубка пухнастої шерсті або ватяної кульки). Вона найстійкіша і міститься найближче до ядра.
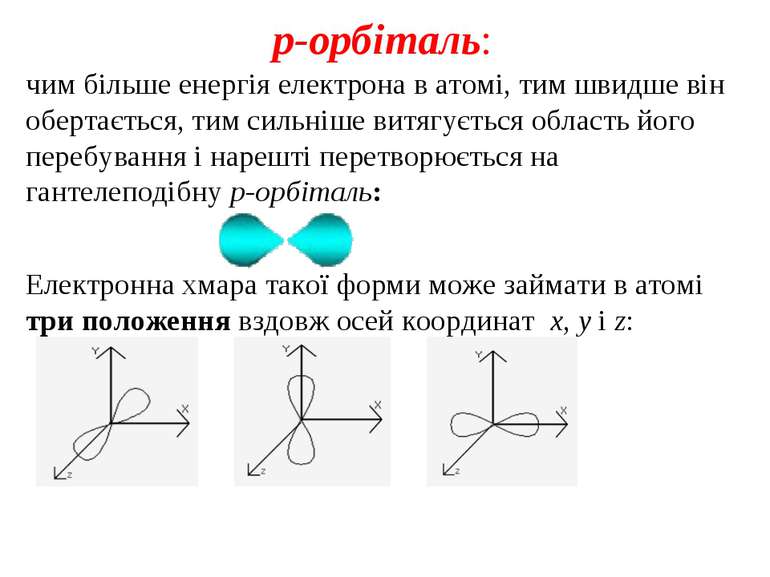
p-орбіталь: чим більше енергія електрона в атомі, тим швидше він обертається, тим сильніше витягується область його перебування і нарешті перетворюється на гантелеподібну p-орбіталь: Електронна хмара такої форми може займати в атомі три положення вздовж осей координат x, у і z:
Всі разом три електронні хмари, які називають px-, py- або pz-орбіталями, вони утворюють симетричну геометричну фігуру, в центрі якої знаходиться атомне ядро. Вона схожа на потрійний бант Отже, видів p-орбіталей може бути три, їхня енергія однакова, але положення в просторі різне.
Окрім s- і p-орбіталей, існують електронні орбіталі ще складнішої форми; їх позначають буквами d і f. Електрони, що потрапляють сюди, набувають ще більшого запасу енергії, складніших рухів, і у результаті утворюються складні і красиві об'ємні геометричні фігури. Всі d-орбіталі (а їх може бути вже п'ять) однакові за енергією, але по-різному розташовані в просторі. Та і формою, що нагадує перев'язану стрічками подушечку, однакові тільки чотири. А п'ята - на зразок гантелі, протягнутої в бублик.
Запам’ятай! Кількість орбіталей певного виду чітко визначена такими числами: s-орбіталь – 1, p-орбіталей – 3, d-орбіталей – 5, f-орбіталей – 7.
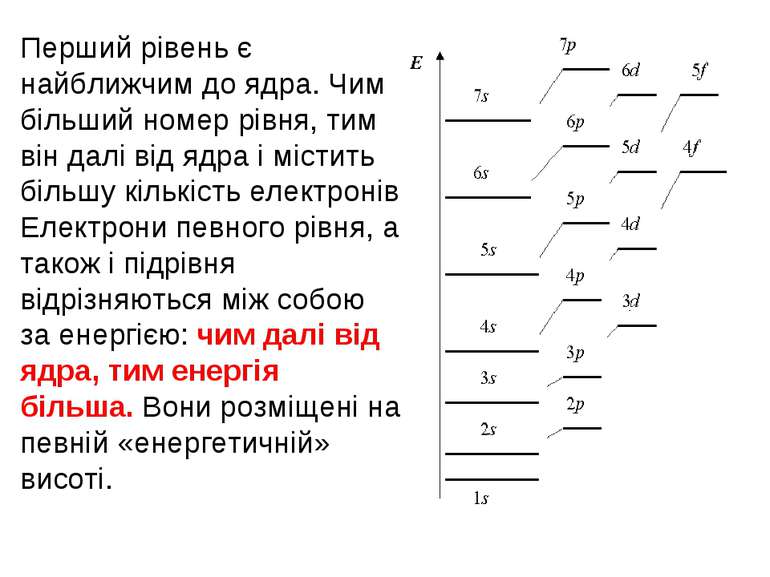
Електронна оболонка – це сукупність електронів, що рухаються в атомі навколо ядра. Дослідження фізиків показали, електрони в атомі розташовуються не безладно, а шарами – енергетичними рівнями. Ці рівні, подібно до поверхів у будинку – перший, другий, третій і так далі. Окрім того, кожен рівень поділяється на підрівні - s, p, d, f, на яких розташовуються атомні орбіталі – s, p, d, f. Чим більше номер "поверху" - рівня, тим "вище" (далі від ядра) знаходяться електрони цього рівня. На першому рівні може бути один-єдиний s-підрівень, на другому підрівнів вже два: s і р. На третьому "поверсі" три підрівні (s, p і d), на четвертому - чотири (s, p, d, f).
Запам’ятай! Кількість підрівнів дорівнює номеру рівня. Перший рівень містить один підрівень – s, тому перший рівень можна записати як 1s. Другий рівень містить два підрівні – s, p, позначаємо 2s2p. Третій рівень містить три підрівні – s, p, d – запис матиме вигляд 3s3p3d. Четвертий рівень містить чотири підрівні – s, p, d, f, звідки 4s4p4d4f. 1s 2s2p 3s3p3d 4s4p4d4f
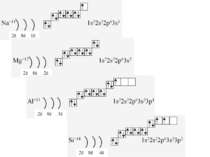
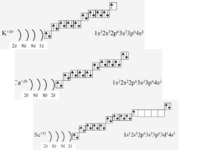
На одному шарі містяться електрони, що мають майже однакову енергію, вони утворюють «свій» енергетичний рівень, який позначається буквою n. Чим далі від ядра знаходиться електрон, тим більшу енергію він має. Максимальну кількість електронів (Nē) на певному енергетичному рівні можна визначити за формулою Nē=2n2, тому: перший рівень (n=1) максимально може містити 2 електрона (1·22); другий рівень (n=2) максимально може містити 8 електронів (2·22); третій рівень (n=2) максимально може містити 18 електронів (3·22); четвертий рівень (n=2) максимально може містити 32 електрона (4·22);
Перший рівень є найближчим до ядра. Чим більший номер рівня, тим він далі від ядра і містить більшу кількість електронів Електрони певного рівня, а також і підрівня відрізняються між собою за енергією: чим далі від ядра, тим енергія більша. Вони розміщені на певній «енергетичній» висоті.
Вчені домовились позначати кожну орбіталь коміркою – квадратиком. На s-підрівні може знаходитися одна атомна орбіталь, а на p-підрівні їх може бути вже три (відповідно до трьох осей координат): Орбіталей d- і f-підрівня в атомі може бути вже п'ять і сім відповідно: s – одна орбіталь p – три орбіталі d – п’ять орбіталей f – сім орбіталей
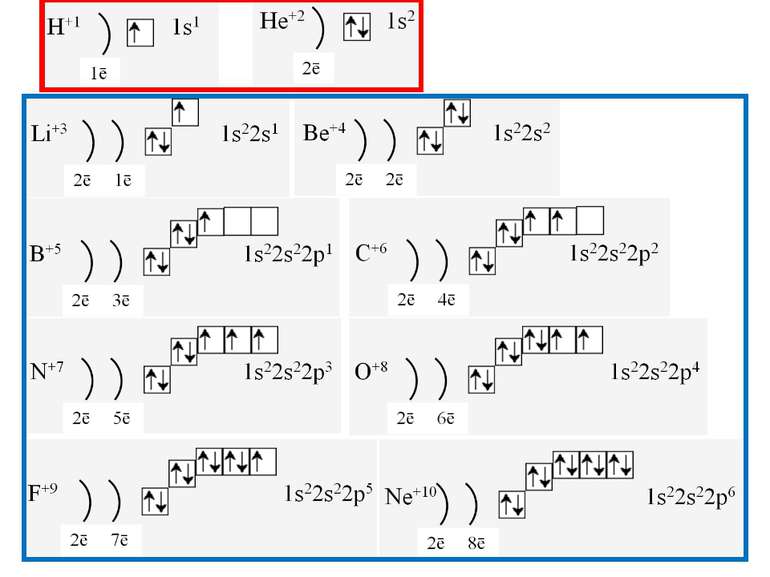
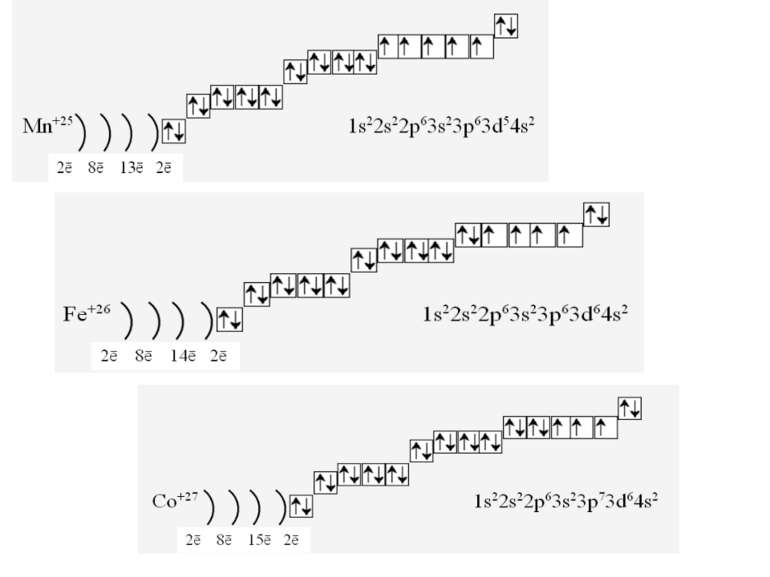
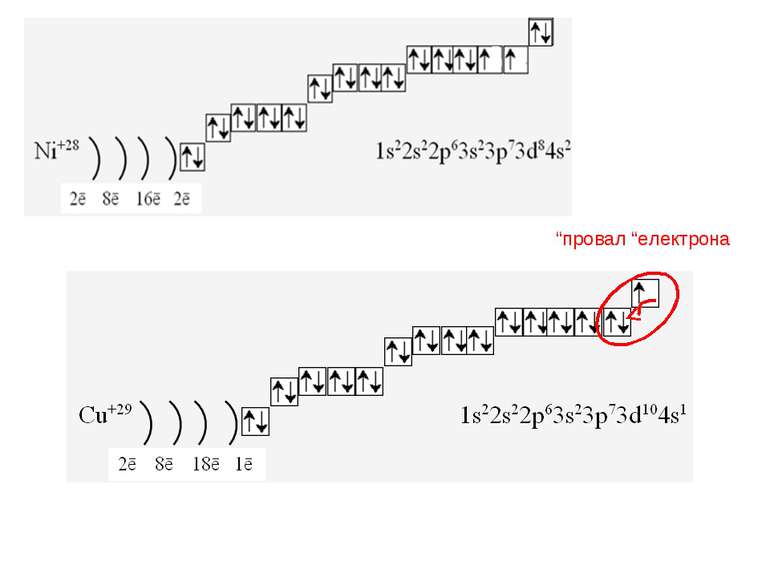
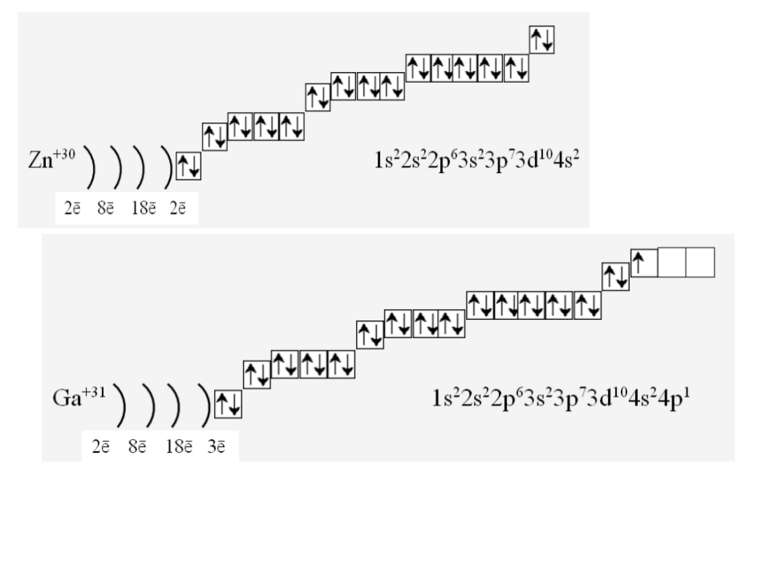
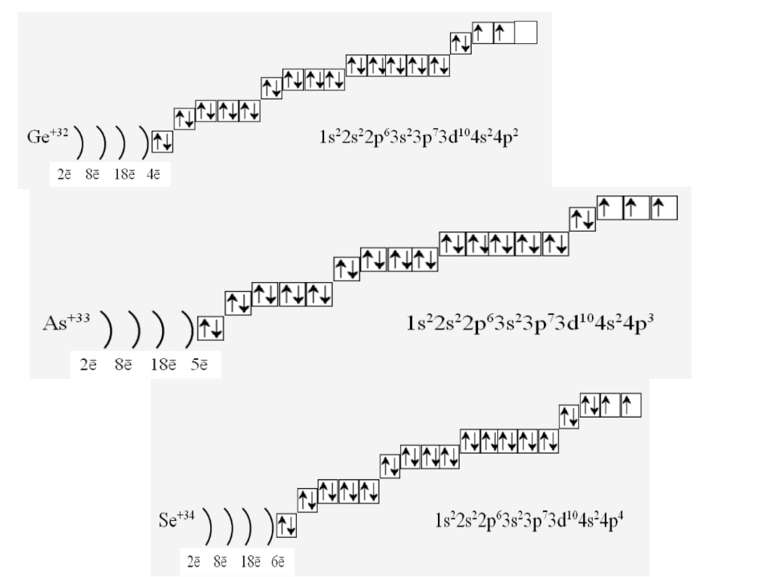
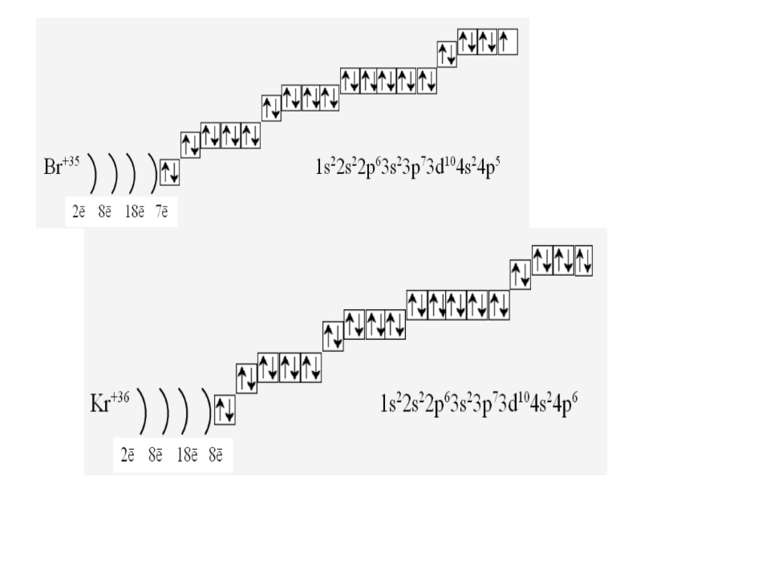
Фізиками встановлено, що на кожній орбіталі може знаходитись максимально два електрони (правило, принцип Паулі), один з яких обертається навколо своєї осі за годинниковою стрілкою, а другий – проти. Це схематично зображують так Звідси, на s-підрівні міститься два електрона, на р-підрівні – шість, на d-підрівні – десять, на f–підрівні – чотирнадцять Запис 1s2 означає, що на одній s-орбіталі s-підрівня першого рівня міститься два електрона. Такий запис називається електронною конфігурацією і читається «один-ес-два».
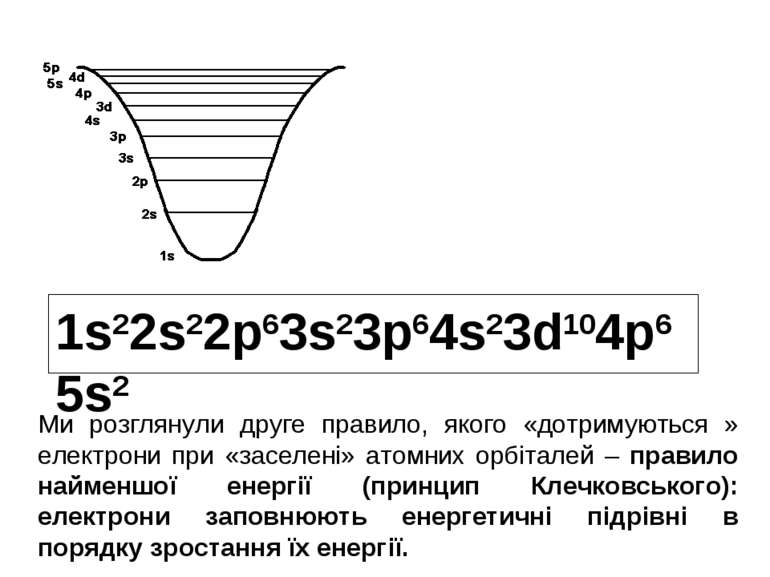
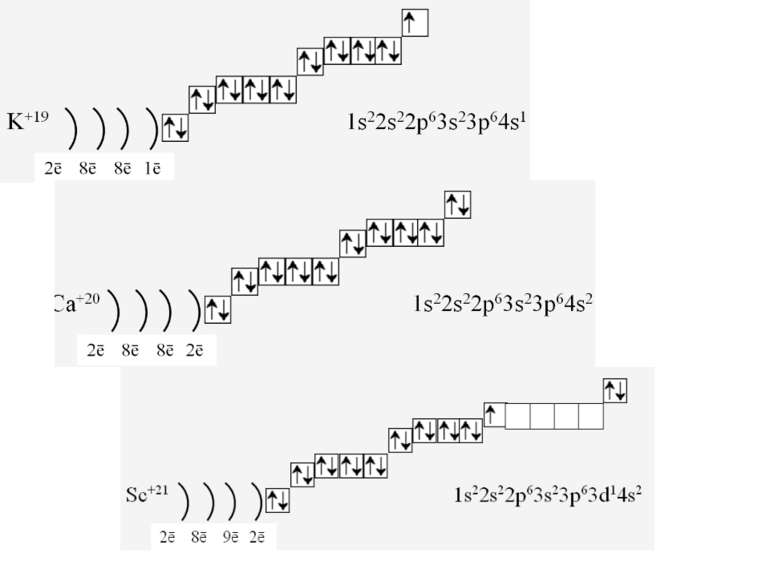
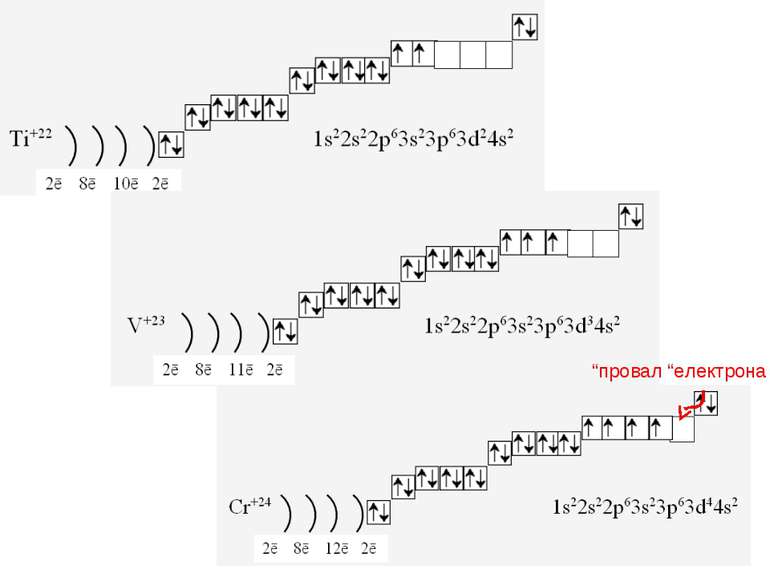
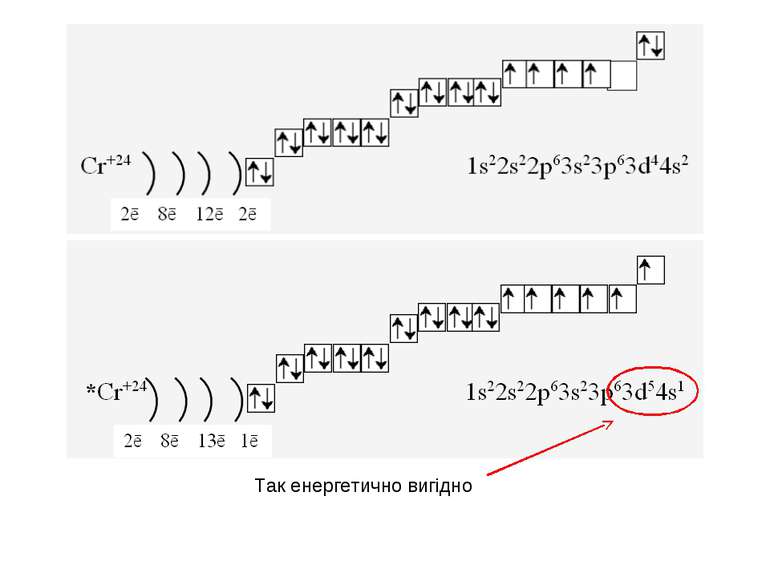
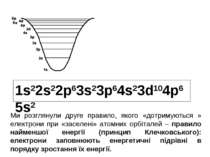
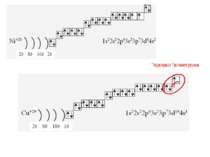
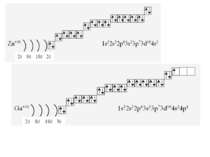
1s22s22p63s23p64s23d104p65s2 Ми розглянули друге правило, якого «дотримуються » електрони при «заселені» атомних орбіталей – правило найменшої енергії (принцип Клечковського): електрони заповнюють енергетичні підрівні в порядку зростання їх енергії.
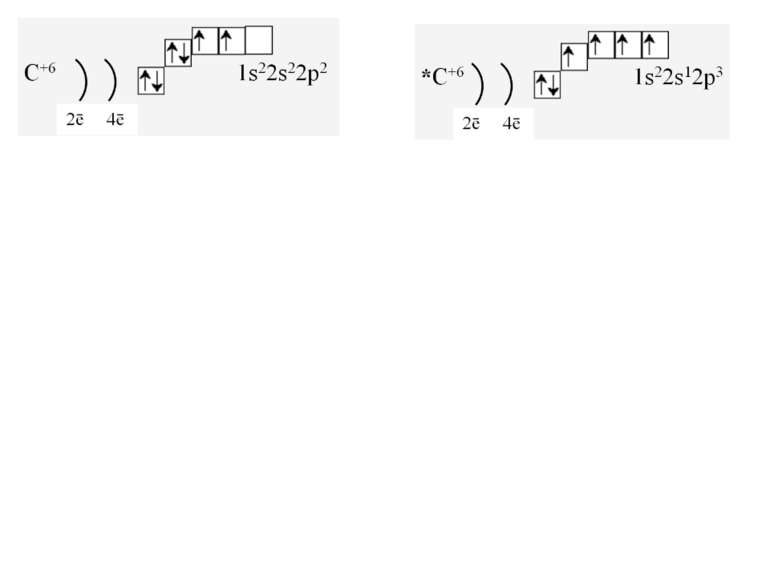
За третім правилом (правилом Хунда): всі орбіталі одного підрівня (!) спочатку заповнюються одним, а потім другим електроном. Наприклад для р-орбіталей: Зверніть увагу, правилом користуються при заповнені підрівнів, але ні в якому разі рівнів! запис позначає один неспарений електрон (наполовину заповнену орбіталь) позначення двох спарених електронів (електрони знаходяться в парі)
Валентність елемента визначається кількістю неспарених електронів. При наданні атому додаткової енергії електрони останнього рівня “збуджуються” і переходять на рівень з більшою енергією, говорять, що атом з основного стану перейшов у *збуджений.
Схожі презентації
Категорії