Презентація на тему:
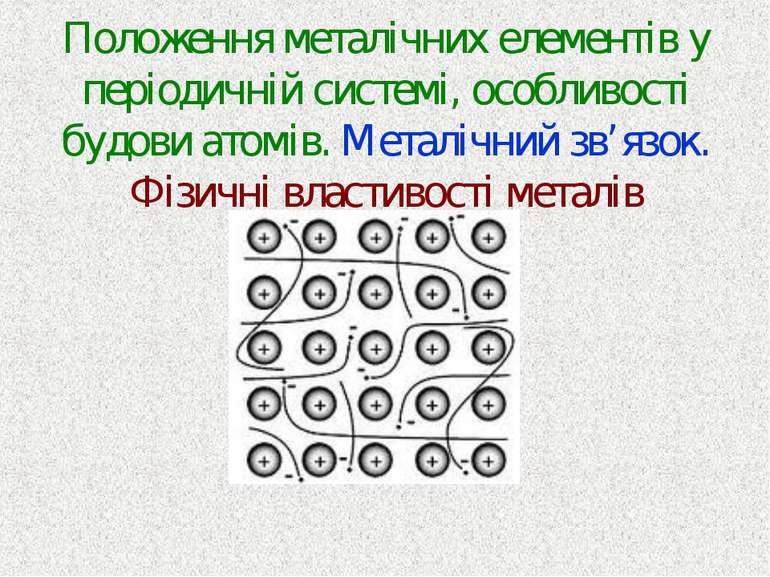
Положення металічних елементів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів
Завантажити презентацію
Положення металічних елементів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів
Завантажити презентаціюПрезентація по слайдам:
Положення металічних елементів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів
Яких елементів у природі більше: металічних чи неметалічних? Де в періодичній системі знаходяться металічні елементи? Назвіть особливості будови металічних елементів.
Об'єкт вивчення – металічні елементи: особливості будови атомів; будова простих речовин — металів; фізичні властивості металів.
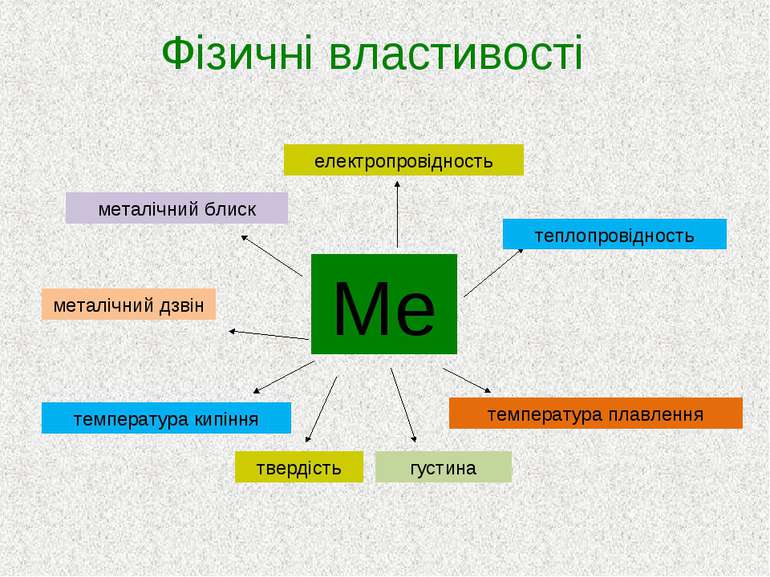
Агрегатний стан (тверді, за винятком Hg, Ga). Колір: усі відтінки від сірого до чорного (винятки: Cu, Au). Тепло- й електропровідність (за рахунок вільних електронів) збільшуються в ряді Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag.
Густина: легкі — ρ < 5 г/см3 (ρ(Li) = 0,53 г/см3 ); важкі — ρ > 5 г/см3 (ρ(Оs) = = 22,48 г/см3 ). Твердість: м’які (лужні метали); тверді (хром). Температура плавлення: легкоплавкі — tпл(Hg) = –38,87 °С; тугоплавкі — tпл(W) = 3 370 °С. Температура кипіння в металів висока Хром
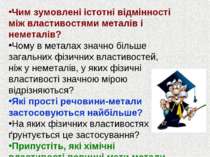
Чим зумовлені істотні відмінності між властивостями металів і неметалів? Чому в металах значно більше загальних фізичних властивостей, ніж у неметалів, у яких фізичні властивості значною мірою відрізняються? Які прості речовини-метали застосовуються найбільше? На яких фізичних властивостях ґрунтується це застосування? Припустіть, які хімічні властивості повинні мати метали.
Опрацювати матеріал параграфа, відповісти на запитання. Творче завдання: підготувати повідомлення про поширення металів у природі. Домашнє завдання
Схожі презентації
Категорії