Презентація на тему:
Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок, будова речовини
Завантажити презентацію
Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок, будова речовини
Завантажити презентаціюПрезентація по слайдам:
Періодичний закон, періодична система хімічних елементів Д. І. Менделєєва. Хімічний зв’язок, будова речовини
Виконайте завдання Наведіть формулювання періодичного закону Д. І. Менделєєва. Наведіть сучасне формулювання періодичного закону. Зобразіть будову атома та йона: а) Хлору; б) Натрію.
Зобразіть електронну схему утворення молекули між цими атомами, укажіть тип хімічного зв’язку. Укажіть положення в періодичній системі найсильнішого металу. Обґрунтуйте свою думку. Укажіть положення в періодичній системі найсильнішого неметалу. Обґрунтуйте свою думку. Яке місце в періодичній системі займають інертні елементи?
Будова атома. Квантові числа. Принцип заповнення електронних орбіталей Електрон має подвійну (корпускулярно-хвильову) природу. Електрони в атомі можуть мати лише чітко визначені значення енергії, які залежать від відстані до ядра. Електрони, що мають близькі значення енергії, утворюють енергетичний рівень. Він містить певну кількість електронів — максимально 2n2. Енергетичні рівні поділяються на s-, p-, d- і f-підрівні; їх число дорівнює номеру рівня.
Квантові числа електронів Стан кожного електрона в атомі зазвичай описують з допомогою чотирьох квантових чисел: головного (n), орбітального (l), магнітного (m) і спінового (s). Перші три характеризують рух електрона в просторі, а четверте — навколо своєї осі.
Головне квантове число (n). Визначає енергетичний рівень електрона, віддаленість рівня від ядра, розмір електронної хмарини. Має цілі значення (n = 1, 2, 3...) і відповідає номеру періоду. З періодичної системи для будь-якого елемента за номером періоду можна визначити число енергетичних рівнів атома й зовнішній енергетичний рівень.
Завдання 1 Назвіть число енергетичних рівнів у атомі елемента: Ферум, Натрій, Сульфур, Силіцій, Бром, Радій. Що таке електронна орбіталь? Яких форм можуть набувати електронні орбіталі?
Орбітальне квантове число (l) Характеризує геометричну форму орбіталі. Має значення цілих чисел від 0 до (n −1). Незалежно від номера енергетичного рівня кожному значенню орбітального квантового числа відповідає орбіталь особливої форми. Набір орбіталей з однаковими значеннями n називається енергетичним рівнем, з однаковими n і l — підрівнем.
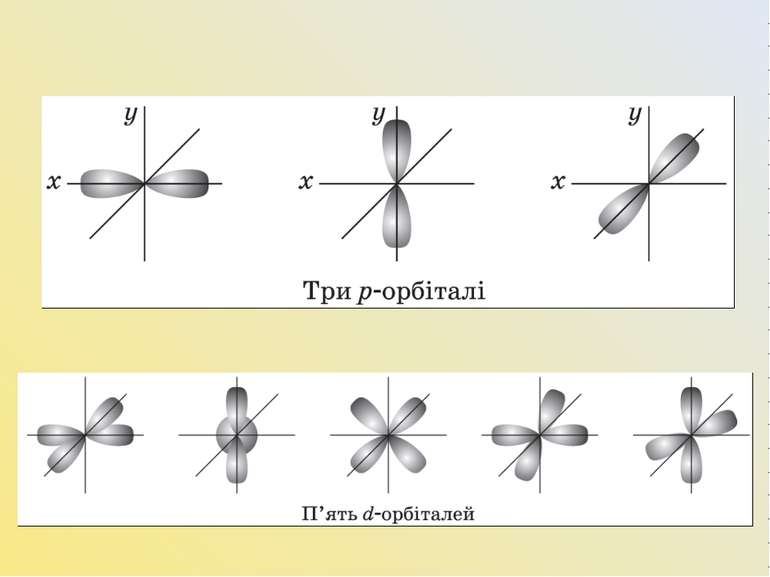
Для l = 0 s-підрівень, s-орбіталь — орбіталь сфера; l =1 p-підрівень, p-орбіталь — орбіталь гантель; l = 2 d-підрівень, d-орбіталь — орбіталь складної форми; l = 3 f-підрівень, f-орбіталь — орбіталь ще більш складної форми.
Згадайте, які електрони можуть розташовуватися на першому рівні; на другому рівні; на третьому рівні
Магнітне квантове число (m) характеризує положення електронної орбіталі в просторі. Для s-орбіталі (l = 0) таке положення одне й відповідає m = 0. Сфера не може мати різні орієнтації в просторі. Для p-орбіталі (l = 1) — три рівноцінні орієнтації в просторі. Для d-орбіталі (l = 2) — п’ять рівноцінних орієнтацій у просторі. Отже, на s-підрівні — одна, на p-підрівні — три, на d-підрівні — п’ять, на f-підрівні — сім орбіталей.
Спінове квантове число (s) Характеризує магнітний момент, що виникає під час обертання електрона навколо своєї осі. Може мати лише два значення: +1/2 та -1/2, що відповідають протилежним напрямкам обертання.
Принципи заповнення орбіталей Принцип Паулі. В атомі не може бути двох електронів, у яких значення всіх квантових чисел (n, l, m, s) були б однаковими, тобто на кожній орбіталі може знаходитися не більш ніж два електрони (з протилежними спінами).
Енергія орбіталей зростає в ряді: 1s > 2s > 2p > 3s > 3p > 4s > 3d > 4p > 5s > 4d >5p > 6s > 5d′′ > 4f > 6p >7s. Правило Хунда. Атом в основному стані повинен мати максимально можливе число неспарених електронів у межах певного підрівня.
Завдання 2 Порівняйте схему будови атома, електронну і графічну формули будови атома: а) Оксигену й Магнію; б) Калію та Хлору; в) Калію та Скандію.
Фізичний зміст хімічної періодичності Періоди — це горизонтальні ряди елементів з однаковим максимальним значенням головного квантового числа валентних електронів. Групи — вертикальні стовпці елементів з однаковим числом валентних електронів, що дорівнює номеру групи. Розрізняють головні й побічні підгрупи.
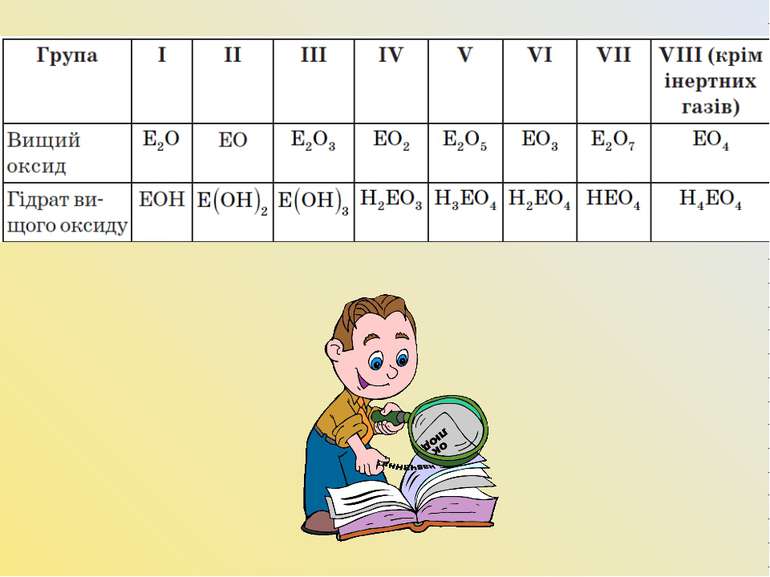
На підставі періодичної таблиці охарактеризуйте хімічний елемент із порядковим номером: 11, 9, 7, 17, 13, 10 за планом: Положення в періодичній таблиці (порядковий номер; період, ряд; група, підгрупа; атомна маса) Будова атома (заряд ядра; склад ядра — кількість протонів p11, нейтронів n01 та електронів e−; кількість енергетичних рівнів і підрівнів; формула електронної конфігурації; квантові комірки; за числом і характером валентних електронів визначити тип елемента) Формули й хімічний характер сполук (вищого оксиду й гідроксиду; сполук із Гідрогеном) Порівняти із сусідами (у періоді, у групі)
Схожі презентації
Категорії