Презентація на тему:
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І.МЕНДЕЛЄЄВА. БУДОВА АТОМА ( узагальнення знань з курсу)
Завантажити презентацію
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І.МЕНДЕЛЄЄВА. БУДОВА АТОМА ( узагальнення знань з курсу)
Завантажити презентаціюПрезентація по слайдам:
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І.МЕНДЕЛЄЄВА. БУДОВА АТОМА ( узагальнення знань) 8 клас Учитель Кукса Н.М.
Мета уроку Навчальна: повторити і узагальнити основні поняття з теми, закріпити вміння за електронною формулою атома визначати хімічний символ елементу, положення його в ПСХЕ, закріпити навички розв’язування вправ, підготувати до тематиного оцінювання. Розвиваюча: вдосконалювати вміння аналізувати, порівнювати, встановлювати причинно-наслідкові зв'язки, застосовувати теоретичні знання для прогнозування; стимулювати пізнавальну активність учнів, інтерес до предмету; Виховна: формувати здоров’язберігаючу компетентність (раціональне планування часу, розвиток наполегливості та працелюбності, здатності обирати оптимальні рішення)
Цілі- узагальнити знання за планом: 1. Періодичний закон та періодична система елементів Д.І. Менделєєва 2. Будова атому 3. Електронна конфігурація атому 4. Утворення хімічного зв'язку та його типи 5.Характеристика елементів за будовою атомів та положенням у ПСХЕ
Заповіт Дмитрія Менделеева « Главный секрет жизни вот какой: один человек – нуль, вместе только люди. Поэтому живите для других, начиная с мамы, друг с друга, брата и сестры… Сами трудясь, вы сделаете всё и для близких, и для себя, а если при труде успеха не будет, будет неудача, не беда, пробуйте ещё, сохраните спокойствие, то внутреннее обладание, которое делает людей с волей, ясных и нужных другим. Иного завета, лучшего дать не могу. С ним живите, его завещайте…»
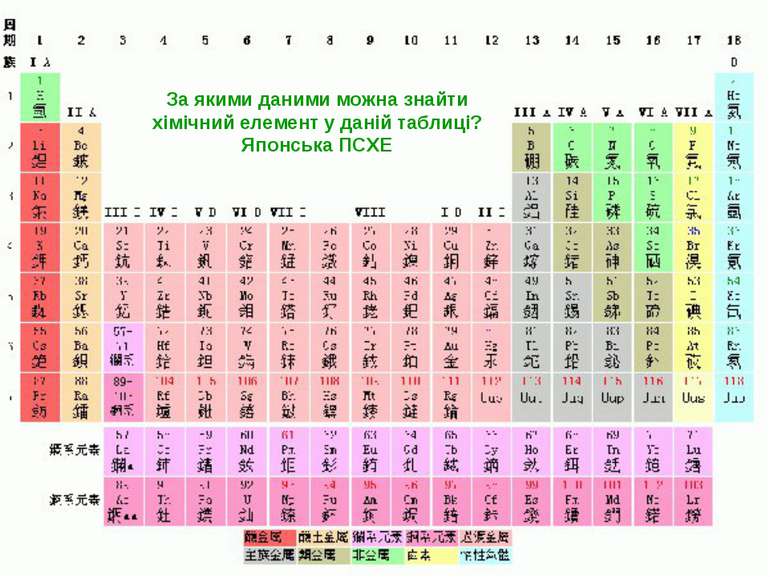
Періодичний закон. Періодична система хімічних елементів «Истина одна, а путей отыскания много» Д.Менделєєв Формулювання Періодичного закону, яке було вперше введене Д. І. Менделєєвим: Фізичні й хімічні властивості елементів, що виявляються у властивостях простих і складних тіл, перебувають у періодичній залежності від їх атомної маси. Графічним зображенням Періодичного закону Д. І. Менделєєва є Періодична система хімічних елементів.
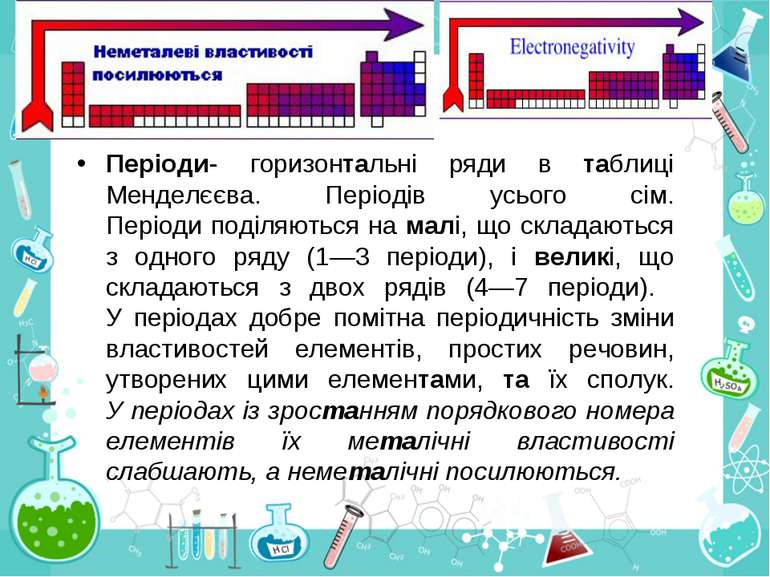
Група - вертикальний стовпчик у таблиці Менделєєва, у якому розміщені подібні за властивостями хімічні елементи. У короткоперіодному варіанті Періодичної системи кожна група поділяється на підгрупи — головну (або А) і побічну (Б). До складу головної підгрупи входять елементи великих і малих періодів, а до складу побічних підгруп — тільки великих періодів і лише метали. У групах у головних підгрупах виявляється подібність елементів (наприклад однакова вища валентність) та їхніх сполук (наприклад загальні формули вищих оксидів і водневих сполук). У групах із зростанням порядкового номера металічні властивості елементів посилюються, а неметалічні послаблюються.
Періоди- горизонтальні ряди в таблиці Менделєєва. Періодів усього сім. Періоди поділяються на малі, що складаються з одного ряду (1—3 періоди), і великі, що складаються з двох рядів (4—7 періоди). У періодах добре помітна періодичність зміни властивостей елементів, простих речовин, утворених цими елементами, та їх сполук. У періодах із зростанням порядкового номера елементів їх металічні властивості слабшають, а неметалічні посилюються.
Інформацію про будову атома дає: Порядковий номер елементу Номер групи Номер періоду Можна визначити, користуючись таблицею Менделєєва: Число протонів в атомі Число нейтронів Число електронів Заряд ядра атома Кількість енергетичних рівнів Кількість електронів на зовнішньому рівні
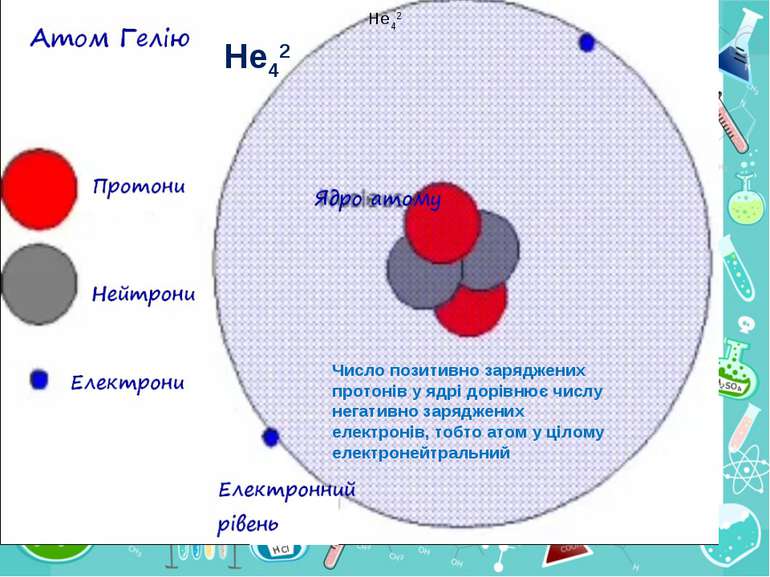
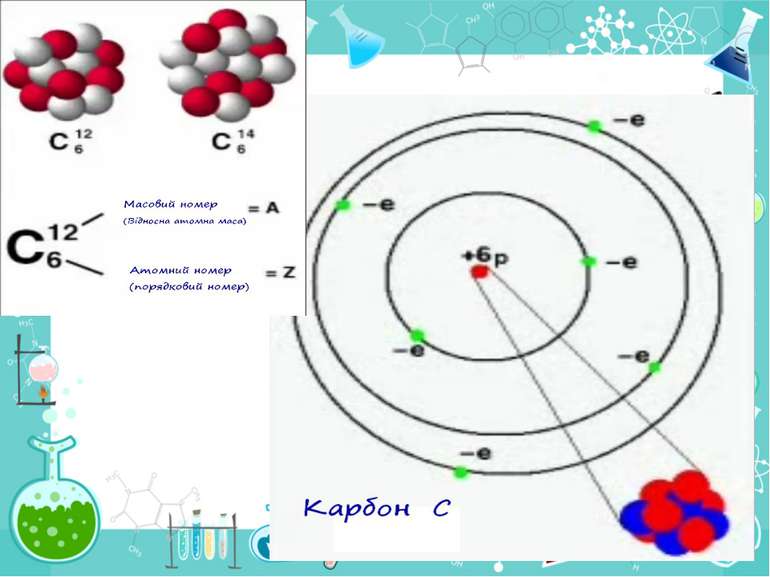
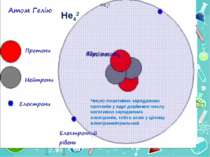
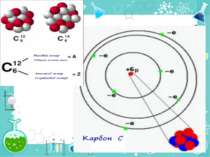
Теорія будови атома Атом — це електронейтральна частинка, що складається з позитивно зарядженого ядра, нейтральних часток нейтронів і негативно заряджених електронів. Ядра атомів складаються з елементарних частинок двох видів: протонів (p) і нейтронів (n). Сума протонів і нейтронів у ядрі одного атома називається нуклонним числом де А — нуклонне число, N — число нейтронів, Z — число протонів.
Маси протона та нейтрона приблизно однакові, їх приймають рівними 1 Атоми з однаковим зарядом ядра складають хімічний елемент. Ізотопи — атоми одного й того ж елемента, які мають різне нуклонне число внаслідок різної кількості нейтронів у ядрі.
He42 He42 Число позитивно заряджених протонів у ядрі дорівнює числу негативно заряджених електронів, тобто атом у цілому електронейтральний
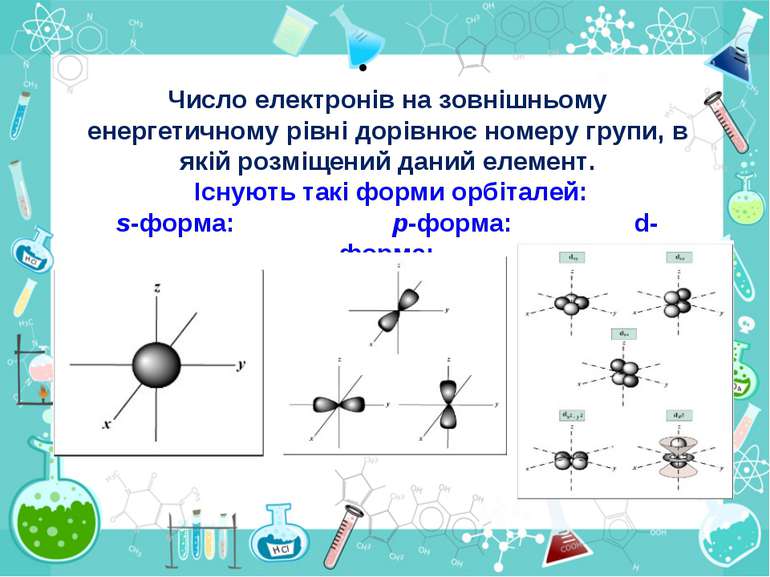
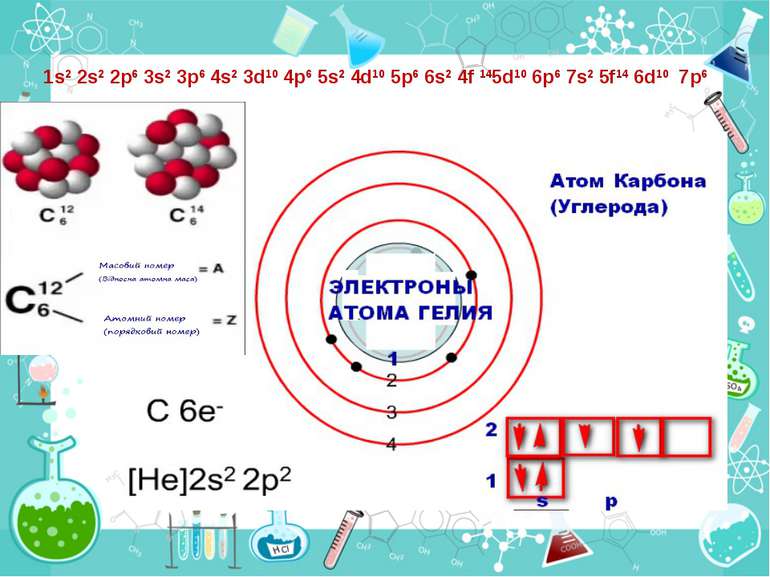
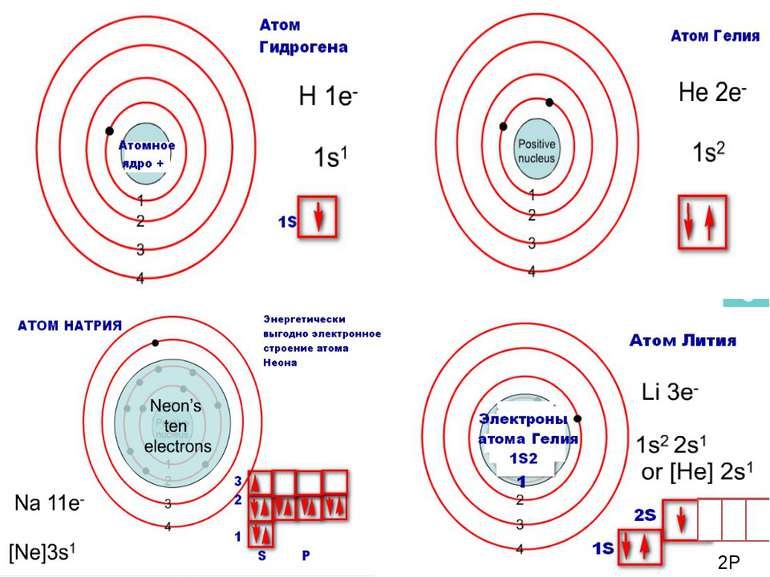
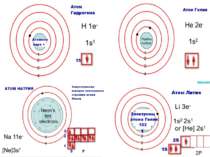
Порядковий номер елементу – загальне число електронів у атомі, які утворюють електронну оболонку атома. Порядковий номер елемента – кількість протонів у ядрі та заряд ядра Z Електрони по різному притягуються до атома і утворюють електронні шари або рівні. Номер періоду – кількість електронних шарів - n Кожний електронний шар складається з електронних орбіталей певної форми. Кількість орбіталей визначається n2 А орбіталь позначується клітинкою Не може бути більш ніж 2 електрони на одній орбіталі. Кількість електронів на енергетичному рівні 2 n2
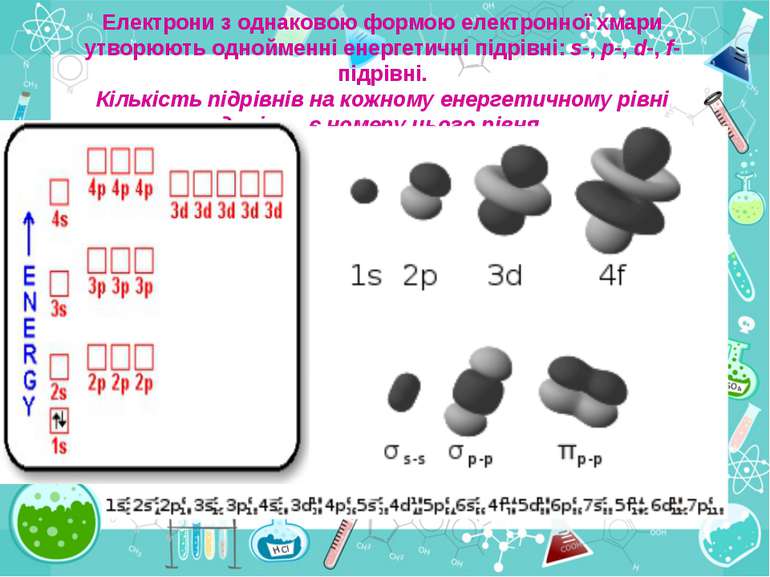
Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, в якій розміщений даний елемент. Існують такі форми орбіталей: s-форма: p-форма: d-форма:
Простір навколо ядра, у якому найімовірніше перебування електрона, називається орбіталлю. Електрон у атомі не рухається за певними траєкторіями, а може перебувати в будь-якій частині навколо ядерного простору, проте ймовірність його перебування в різних частинах цього простору неоднакова і має назву електронна хмара. Принцип найменшої енергії: в атомі кожний електрон розташовується так, щоб його енергія була мінімальною (що відповідає його найбільшому зв’язку з ядром).
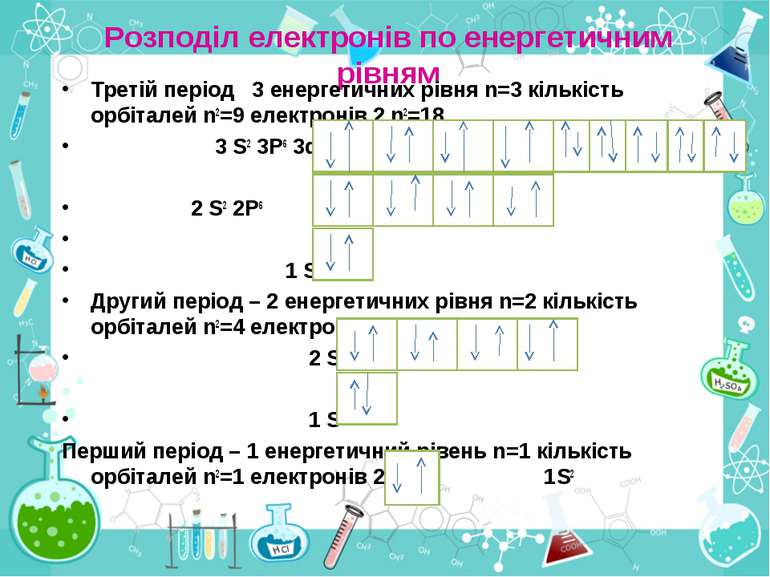
Розподіл електронів по енергетичним рівням Третій період 3 енергетичних рівня n=3 кількість орбіталей n2=9 електронів 2 n2=18 3 S2 3P6 3d10 2 S2 2P6 1 S2 Другий період – 2 енергетичних рівня n=2 кількість орбіталей n2=4 електронів 2 n2=8 2 S22P6 1 S2 Перший період – 1 енергетичний рівень n=1 кількість орбіталей n2=1 електронів 2 n2=2 1S2
Електрони з однаковою формою електронної хмари утворюють однойменні енергетичні підрівні: s-, p-, d-, f- підрівні. Кількість підрівнів на кожному енергетичному рівні дорівнює номеру цього рівня.
Фізичний зміст Періодичного закону В атомах елементів із зростанням порядкового номера відбувається збільшення кількості протонів у ядрі й електронів, що обертаються навколо ядра. При цьому періодично повторюється будова зовнішнього енергетичного рівня. Оскільки властивості елементів багато в чому залежать від числа електронів на зовнішньому енергетичному рівні, то й вони періодично повторюються. Сучасне формулювання Періодичного закону: Властивості хімічних елементів, а також форми й властивості сполук елементів перебувають у періодичній залежності від заряду ядер їхніх атомів.
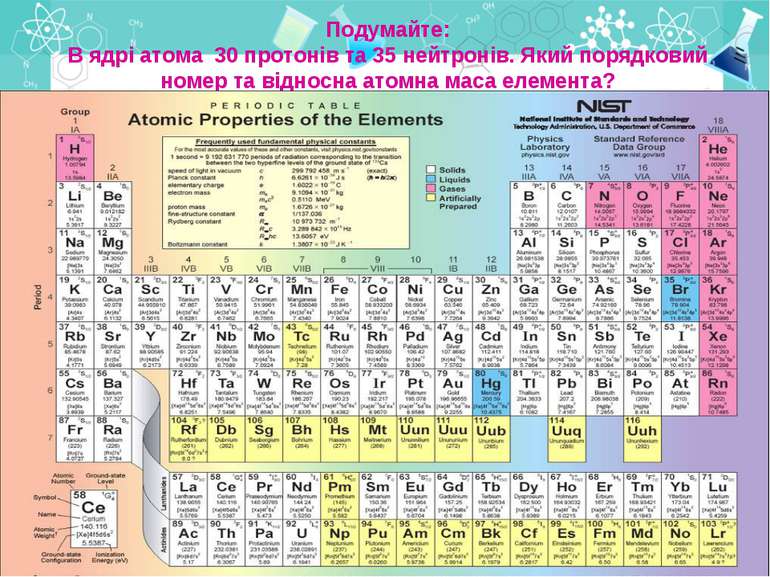
Подумайте: В ядрі атома 30 протонів та 35 нейтронів. Який порядковий номер та відносна атомна маса елемента?
Знайти елементи за будовою їх електронних шарів: a)1S22S2 b)1S22S22P3 c)1S22S22P63S1 d)1S22S22P63S2 а) одного періоду б) однієї групи в) назвати наведені елементи
Знайти елементи за будовою їх електронних шарів: а) одного періоду другого 1S22S2 1S22S22P3 третього 1S22S22P63S1 1S22S22P63S2 б)однієї групи Першої 1S22S1 1S22S22P63S1 Другої 1S22S2 1S22S22P63S2
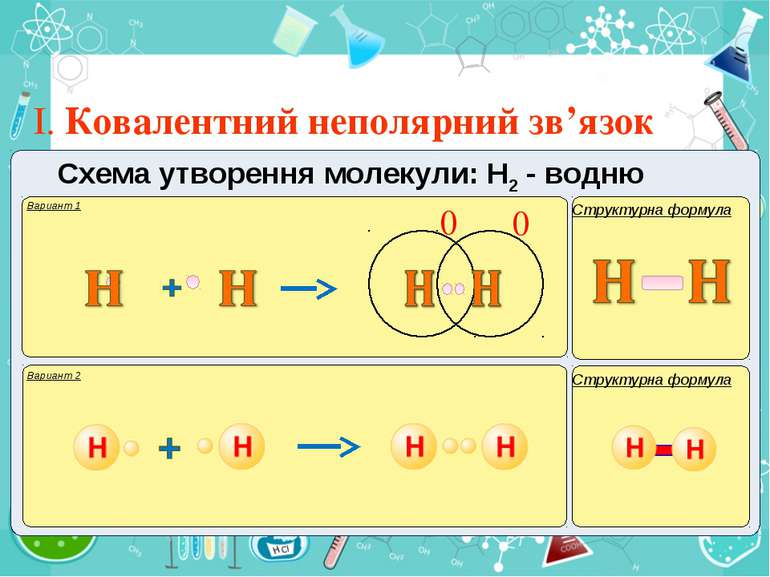
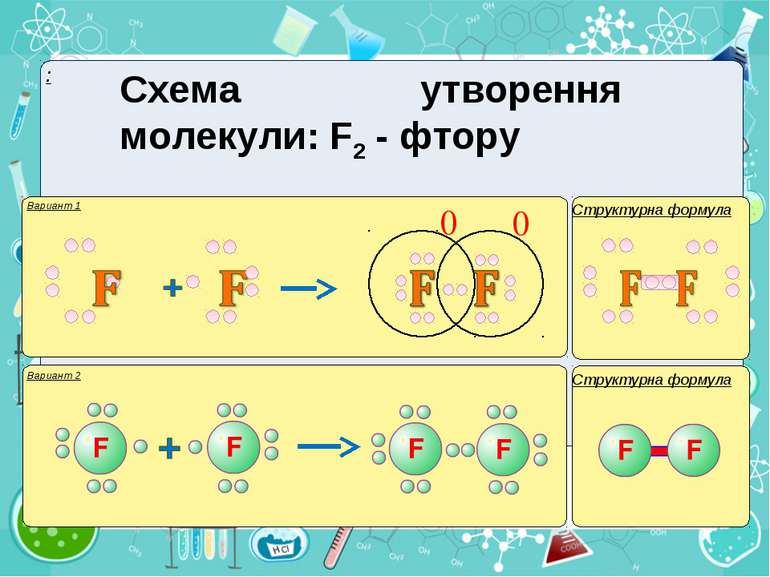
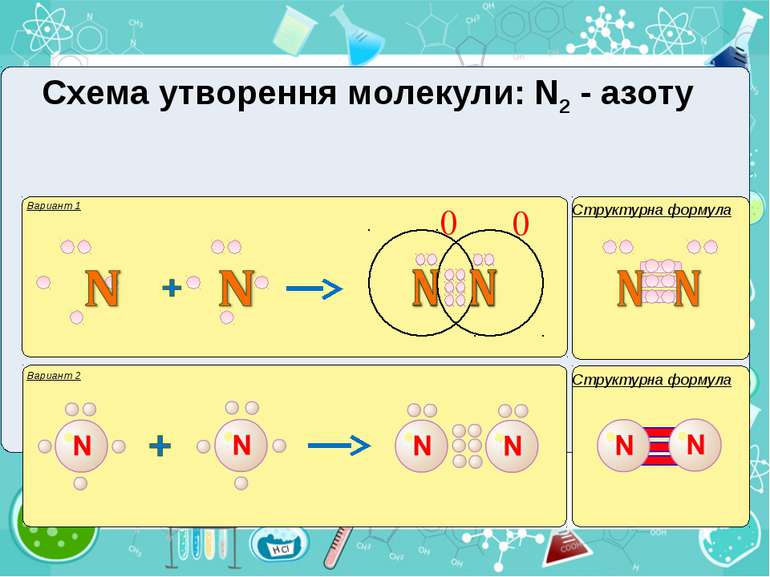
Тема:“Типи хімічного зв’язку» Мета: сформувати уявлення про природу хімічного зв’язку; механізм утворення ковалентного та йонного зв’язку; сформувати навички складання структурних формул та визначати види зв’язку.
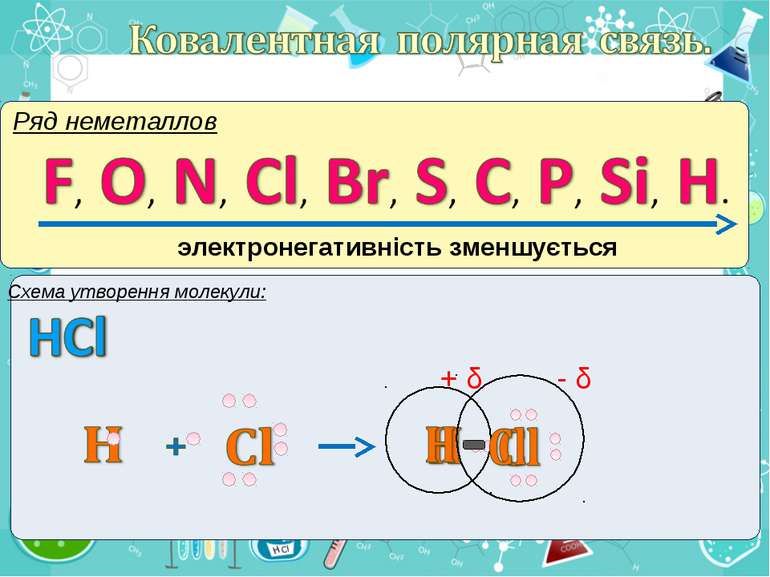
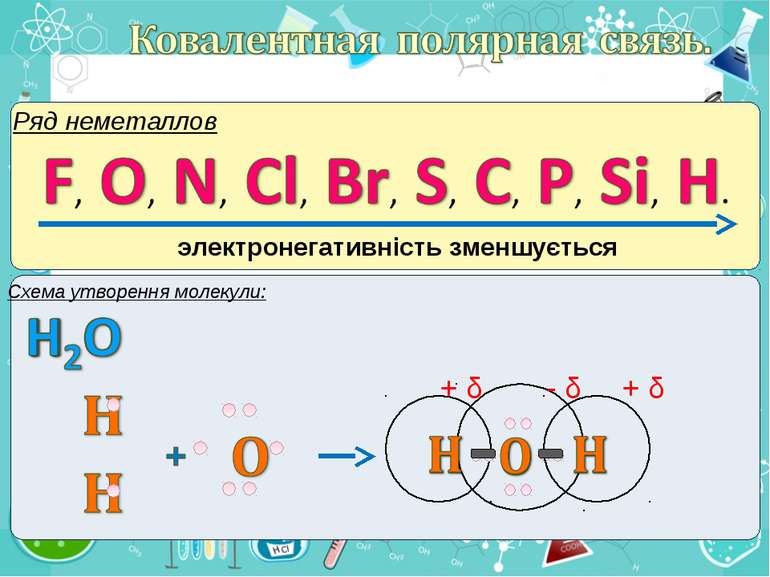
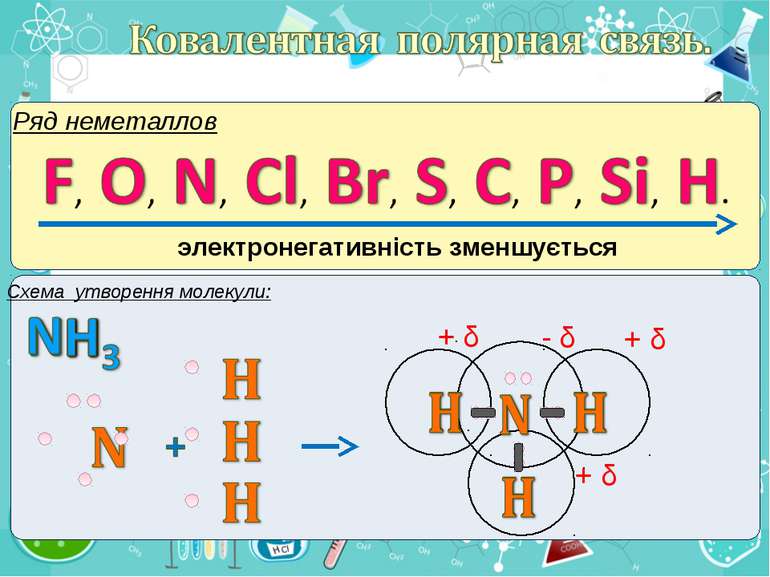
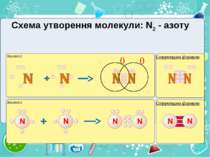
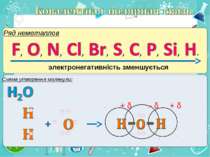
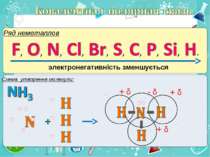
Електронегативність Електронегативність — здатність атома притягати до себе електрони інших атомів Відносна електронегативність відповідає Періодичному закону: у періодах із збільшенням номера елемента вона зростає, у групах — зменшується. Чим більша відносна електронегативність, тим сильніше елемент виявляє неметалічні властивості. Неметали характеризуються великою відносною електронегативністю, а метали — невеликою.
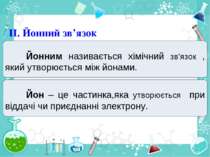
Частинка, яка віддає електрони, претворюється на позитивний йон. Частинка, яка приєднує електрони, претворюється на негативний йон.
Схожі презентації
Категорії