Презентація на тему:
Кристалічний і аморфний стани твердих речовин
Завантажити презентацію
Кристалічний і аморфний стани твердих речовин
Завантажити презентаціюПрезентація по слайдам:
Кристалічний і аморфний стани твердих речовин. Залежність фізичних властивостей речовин від їхньої будови.
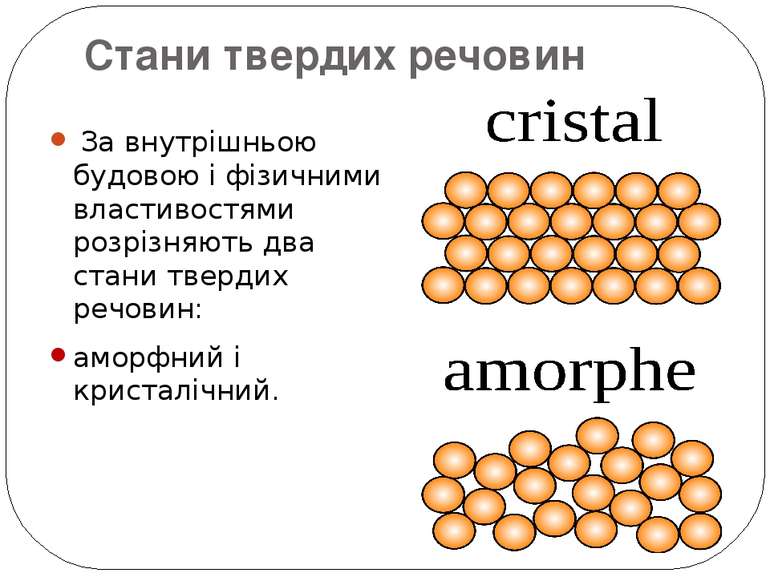
Стани твердих речовин За внутрішньою будовою і фізичними властивостями розрізняють два стани твердих речовин: аморфний і кристалічний.
Кристалічні речовини: • структурні одиниці розташовані в чіткому порядку — утворюють кристалічні ґратки; • мають певну температуру плавлення; • утворюють кристали певної форми; • у разі руйнування кристалічної речовини кристали розпадаються на окремі шматочки, кожен із яких зберігає хоча б частково форму початкового кристала; • приклади речовин: природні мінерали, кухонна сіль, цукор.
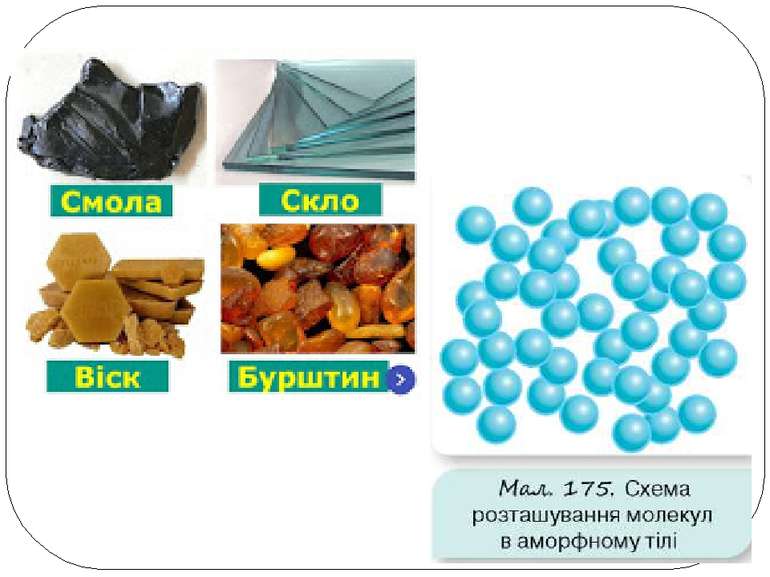
Аморфні речовини: • не мають чіткої просторової структури — структурні одиниці розташовані невпорядковано; • плавляться в певному діапазоні температур; • за нагрівання спочатку розм’якшуються; • у разі руйнування утворюються уламки неправильної форми, зазвичай із нерівною поверхнею країв сколу; • приклади речовин: скло, смоли, бурштин, застиглі лаки, клеї, каучук.
Взаємоперетворення: За певних умов речовина може з кристалічної перетворюватися на аморфну, і навпаки. Звичайне скло — аморфна речовина, але з часом силіцій(IV) оксид у його складі набуває кристалічної форми. Через це старі склянки під час наливання в них окропу лопаються набагато частіше, ніж нові. Цукор — кристалічна речовина. Але якщо його розплавити та швидко охолодити, то він застигає в аморфному стані. З такого цукру можна виготовляти льодяники, карамельки тощо.
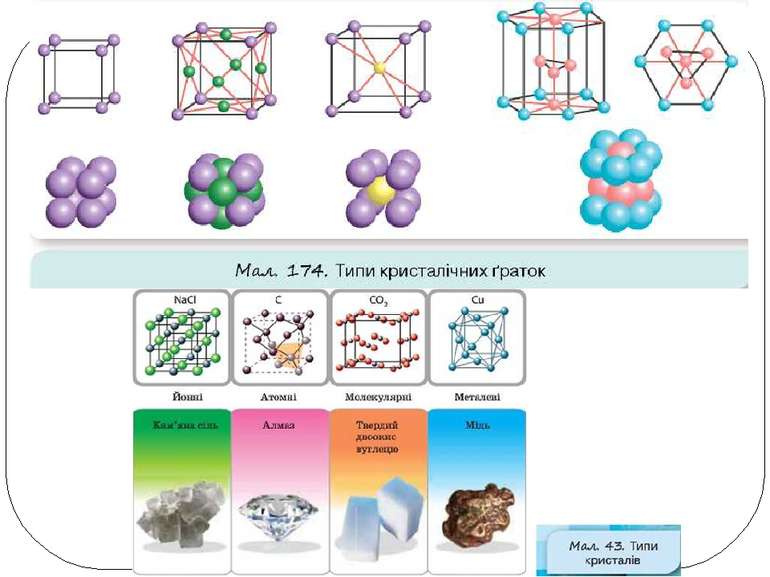
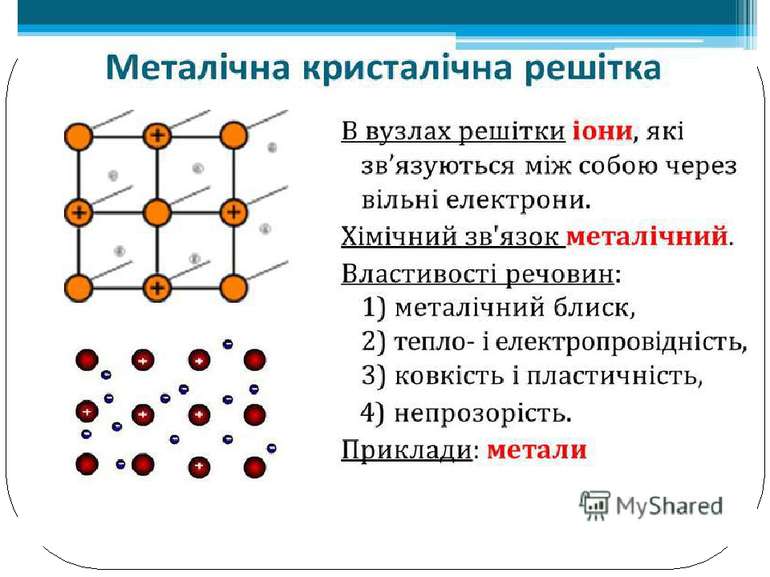
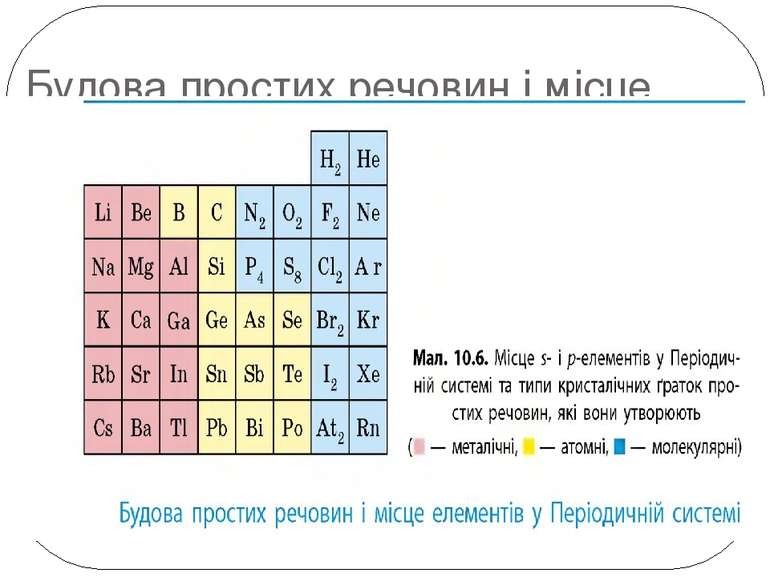
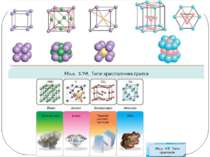
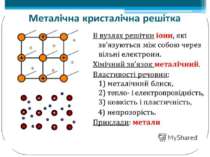
Залежність фізичних властивостей речовин від їхньої будови. Металічні речовини: • у вузлах ґраток — катіони; • тип зв’язку — металічний; • пластичні (ковкі); • добре проводять електричний струм та теплоту.
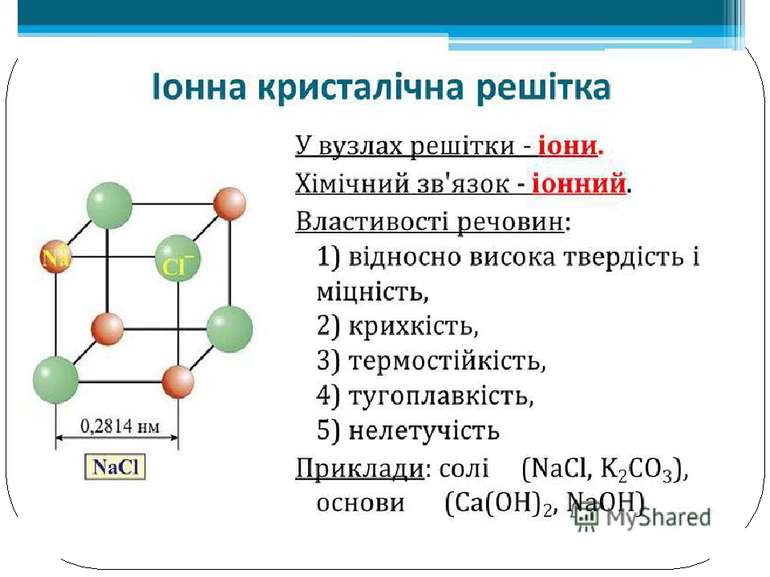
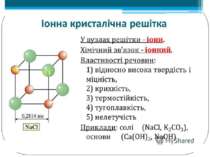
Залежність фізичних властивостей речовин від їхньої будови. Йонні речовини: • у вузлах ґраток — йони (катіони й аніони); • тип зв’язку — йонний; • тверді, крихкі, нелеткі; • тугоплавкі; • деякі розчиняються у воді.
Залежність фізичних властивостей речовин від їхньої будови. Молекулярні речовини: • у вузлах ґраток — молекули; • слабка міжмолекулярна взаємодія; • крихкі, леткі; • легкоплавкі; • розчиняються у воді та в інших розчинниках.
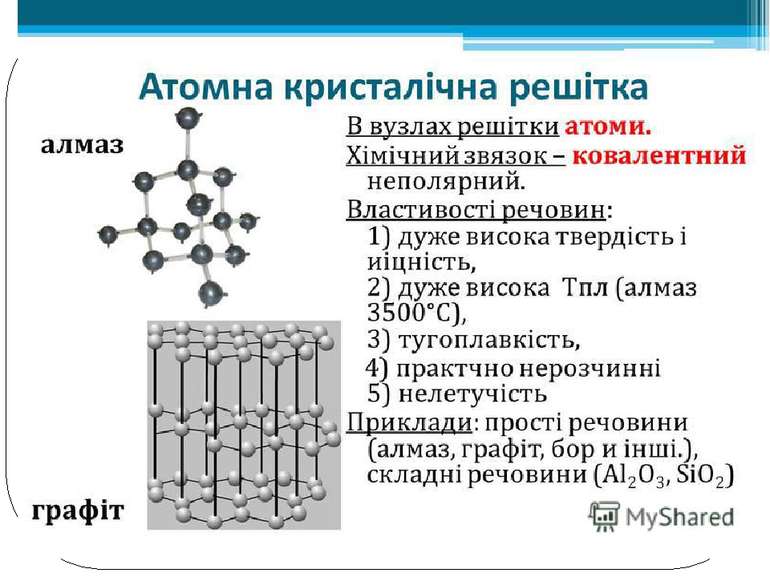
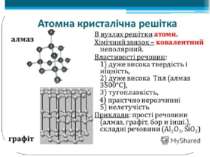
Залежність фізичних властивостей речовин від їхньої будови. Речовини атомної будови: • у вузлах ґраток — окремі атоми; • тип зв’язку — ковалентний; • надзвичайно тверді, нелеткі; • тугоплавкі; • не розчиняються в жодному розчиннику.
Схожі презентації
Категорії