Презентація на тему:
Колігативні властивості біологічних рідин. основи титрометричного аналізу
Завантажити презентацію
Колігативні властивості біологічних рідин. основи титрометричного аналізу
Завантажити презентаціюПрезентація по слайдам:
План 1. Розчини. Розчинність. Теорії утворення розчинів 2. Колігативні властивості. 3.Закон Рауля. 4. Пониження температури замерзання, підвищення температури кипіння . 5.Дифузія. Осмос. Осмотичний тиск. 6. Біологічне значення осмосу
Розчини - гомогенні термодинамічно стійкі системи, що складаються з двох і більше компонентів. Типи розчинів: газоподібні, рідкі і тверді. Газоподібні розчини – це суміші газів. Рідкі розчини – це суміші рідин, або розчини твердих речовин і газів у рідинах. Тверді розчини – це тверді фази, що утворилися при охолодженні рідких розплавів.
Концентрації розчинів mi ( i) =------------ Масова частка (mi +mp) n i = --------- Моларна частка nB +np Vi V i= -------- Об’ємна частка Vi + Vp Молярна концентрація, молярність nB mB CB = ------ = ---------- Vp Vp · MB Моляльна концентрація, моляльність n mрр B= ------ = ---------- m mр · M
Теорії розчинів 1)Фізичної теорії С.Арреніуса, В. Оствальда, Я. Вант-Гоффа) 2) Хімічна теорія (Д. І. Метделєєв, І. А. Каблуков, М. С. Курнаков) 3) Сучасна теорія розчинів – фізико-хімічна теорія
Закон Генрі Розчинність газів при постійній температурі прямо пропорційна тиску газу над розчином (парціальному тиску, виражається в молях на 1000 грам розчинника) C = K' p Де C - молярна концентрація газу в рідині; p - парциальний тиск газу; K' - коефіцієнт розчинності
КОЛІГАТИВНИ ВЛАСТИВОСТІ РОЗЧИНІВ - це властивості розчинів, які не залежать від природи розчиненої речовини, а визначаються кількістю частинок в розчині. -зниження тиску насиченої пари розчинника над розчином, підвищення температури кипіння розчинів, зниження температури замерзання розчинів, осмотичний тиск.
ЗНИЖЕННЯ ТИСКУ НАСИЧЕНОЇ ПАРИ РОЗЧИННИКА НАД РОЗЧИНАМИ p = KNA p - тиск пари розчинника над розчином; K= pA0 - константа пропорційності, тиск пари чистого розчинника; NA - молярна частка розчинника. p = pA0NA; NA = 1 – NB; p = pA0 (1 - NB) pA0 – p/pA0= NB NB = nB/(nB +nA) - молярна частка розчиненої речовини; pA0 - p - пониження тиску пари розчинника над розчином; pA0 – p/ pA0 - відносне зниження тиску насиченої пари розчинника над розчином
Підвищення температури кипіння, зниження температури замерзання розчину TK =E ·BB TЗ =K ·BB TK – підвищення температури кипіння розчину; TЗ - зниження температури замерзання розчину; BB - моляльна концентрація розчину; K –кіоскопічна стала; E – ебуліскопічна стала
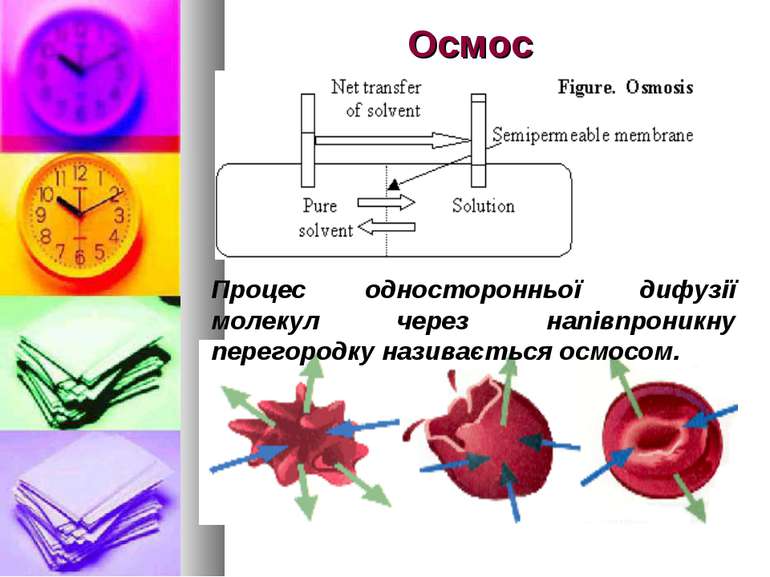
Осмос Процес односторонньої дифузії молекул через напівпроникну перегородку називається осмосом.
Осмотичний тиск – це тиск, який чисельно дорівнює додатковому тиску, який необхідний для припинення осмосу. Закон Вант-Гоффа: осмотичний тиск розчину дорівнює тому тиску, який чинила б розчинена речовина, якби вона при тій же температурі перебувала в газоподібному стані і займала б об’єм, рівний об’єму розчину: pосмотичне = RTnB/V = CBRT; pосмотичне – осмотичний тиск; V - об’єм розчину; R = 8,314 Дж /моль К – універсальна газова стала; nB – кількість молів розчиненої речовини; T – абсолютна температура, К CB – молярна концентрація.
Схожі презентації
Категорії