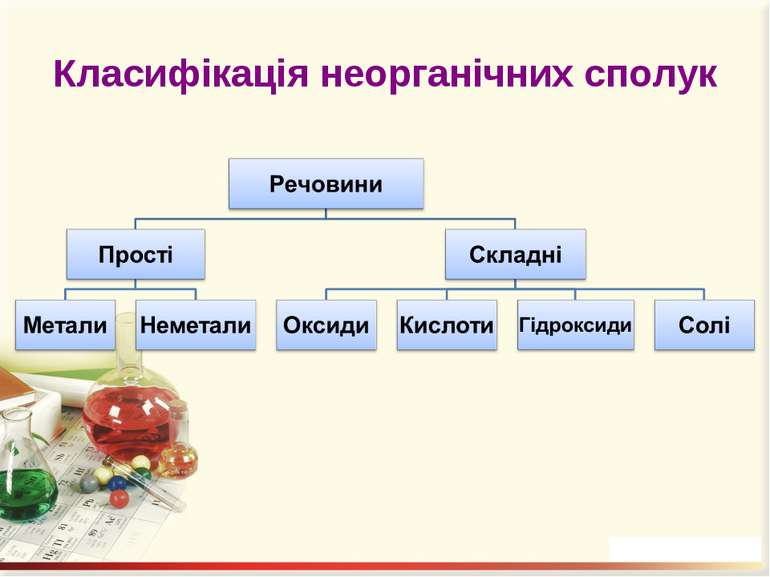
Презентація на тему:
хіміячні формули речовин
Завантажити презентацію
хіміячні формули речовин
Завантажити презентаціюПрезентація по слайдам:
Запісочна Людмила Володимирівна, учитель Лебедівської загальноосвітньої школи І-ІІІ ступенів Кам’янської районної ради
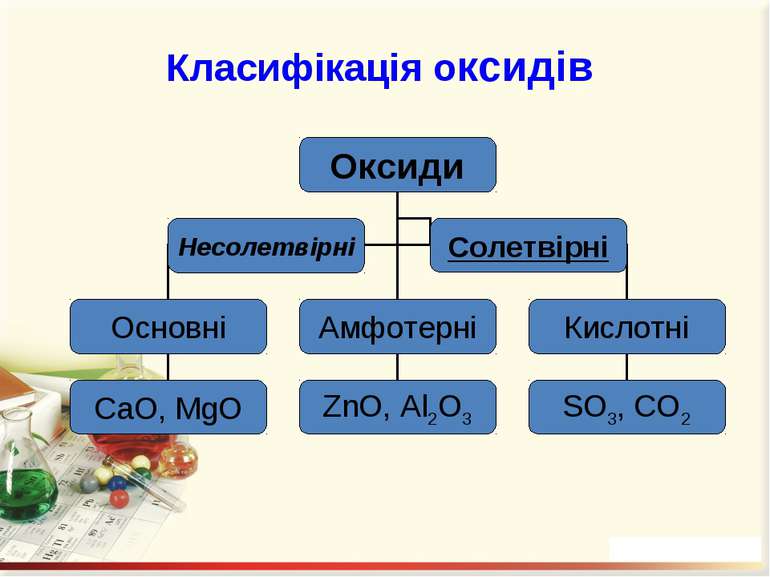
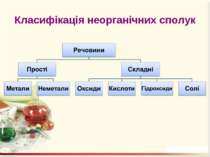
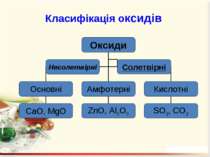
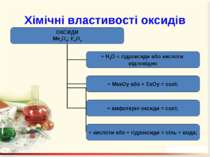
Оксиди – це бінарні сполуки будь-якого хімічного елемeнта з Оксигеном. В оксидах Оксиген завжди двохвалентний Несолетвірні оксиди – це реакційно здатні сполуки, що вступають у хімічні реакції, в результаті яких солі не утворюються. Солетвірні – це такі оксиди, що вступають у реакції, в результаті яких утворюються солі.
ExOy Основними називаються оксиди, сполуки яких з водою є основами. Кислотними називають оксиди, сполуки яких з водою є кислотами. Амфотерними називають оксиди, яким відповідають амфотерні гідроксиди.
Назви оксидів В назвах оксидів спочатку називають елемент, після якого вказують римськими цифрами (без відступу) у дужках його валентність і додають слово оксид. Якщо елемент у сполуках має постійну валентність, то її не вказують. Cr2O3 – хром(ІІІ) оксид; N2O5 – нітроген(V) оксид; CO – карбон(ІІ) оксид; Na2O – натрій оксид; B2O3 – бор оксид.
Перевірте свої знання! допишіть рівняння реакцій: SO3 + H2O = CaO + H2O = SO3 + CaO = ZnO + H2SO4 = ZnO + NaOH =
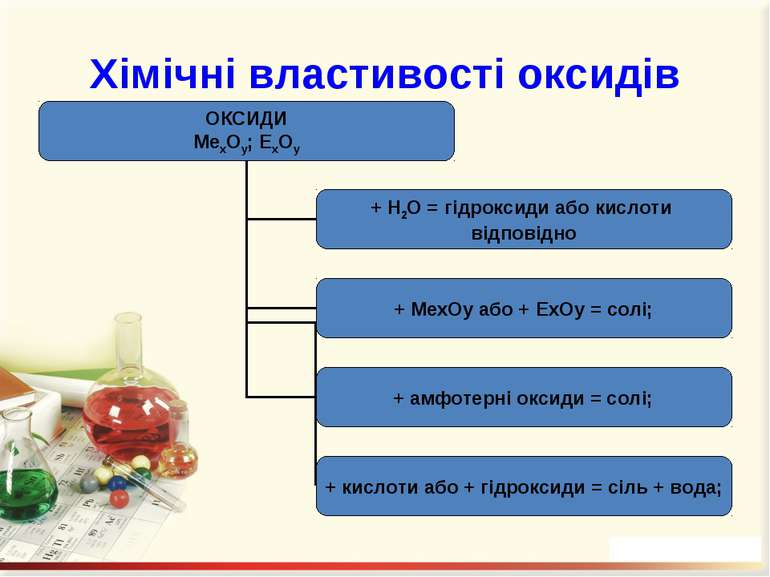
Добування оксидів: 1. Безпосереднє сполучення простої речовини з киснем (за різних умов): С + О2 = СО2; 4K + O2 = 2K2O. 2. Горіння складних речовин: CH4 + 2O2 = CO2 + 2H2O. 3. Розкладання при нагріванні оксигеновмісних сполук: CaCO3 = CaО + СО2↑; 2Сu(NO3)2 = 2CuO + 4NO2 ↑ + O2 ↑; 2Fe(OH)3 = Fe2O3 + 3H2O.
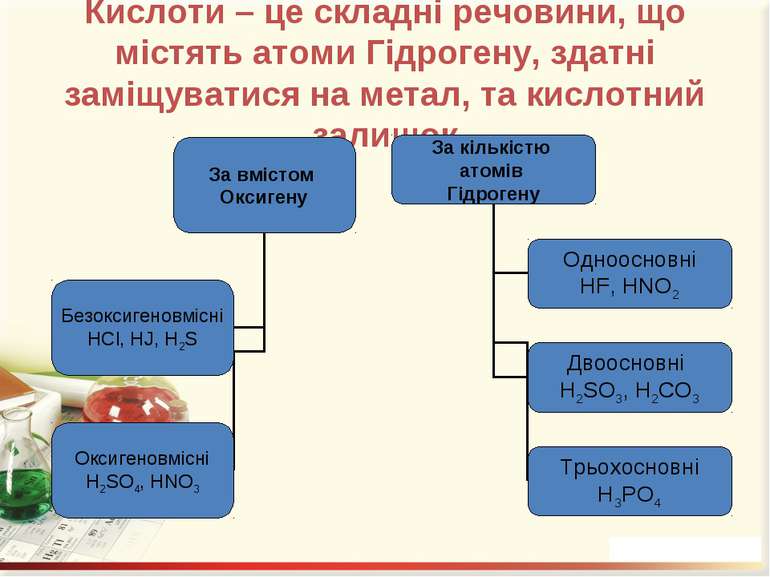
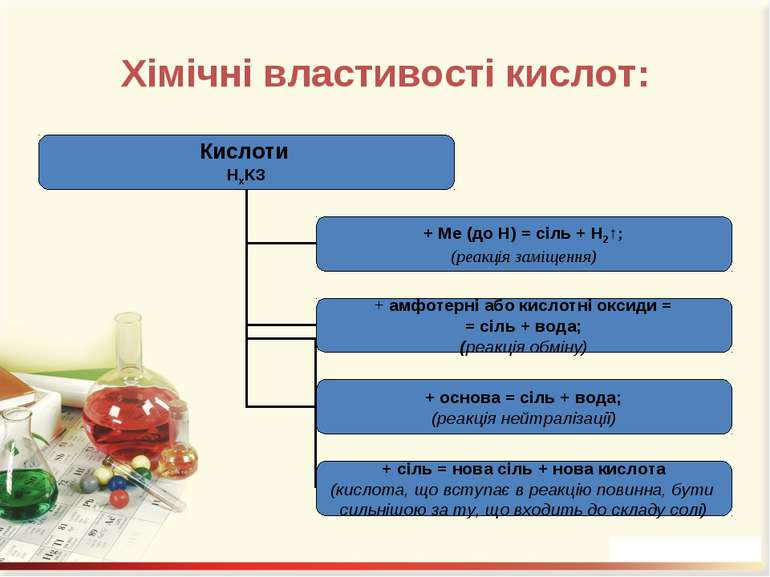
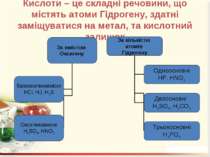
Кислоти – це складні речовини, що містять атоми Гідрогену, здатні заміщуватися на метал, та кислотний залишок
Перевірте свої знання! Допишіть рівняння реакцій: H2SO4 + Zn = H2SO4 + ZnO = HCl + NiO = HNO3 + NaOH = HCl + Na2SiO3 =
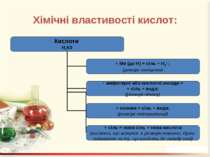
Добування кислот: 1. При взаємодії кислотних оксидів з водою: SO3 + H2O = H2SO4; N2O5 + H2O = 2HNO3. 2. Якщо оксиди не розчиняються у воді, то відповідні їм кислоти добувають непрямим способом, а саме дією іншої кислоти (найчастіше сульфатної) на відповідну сіль: Na2SiO3 + H2SO4 = H2SiO3↓. 3. Безкисневмісні кислоти добувають синтезом з водню і неметалу з наступним розчиненням водневої сполуки у воді. Це HCl, HBr, HJ, H2S: H2 + Cl2 = 2HCl
Правила безпеки життєдіяльності при роботі з кислотами Працювати в захисних рукавичках; При попаданні кислоти на шкіру промити уражену ділянку проточною водою; Обробити 5%-им розчином питної соди; При розведені концентрованої сульфатної кислоти спочатку наливати воду, потім – кислоту у воду.
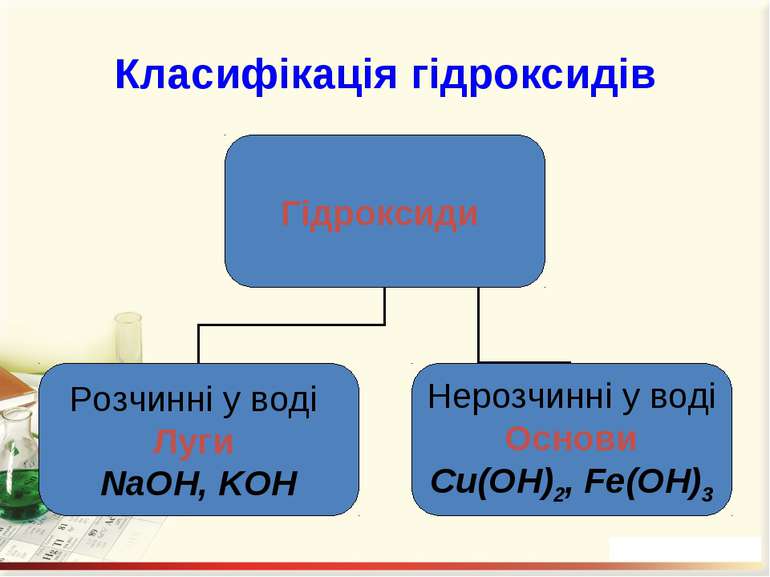
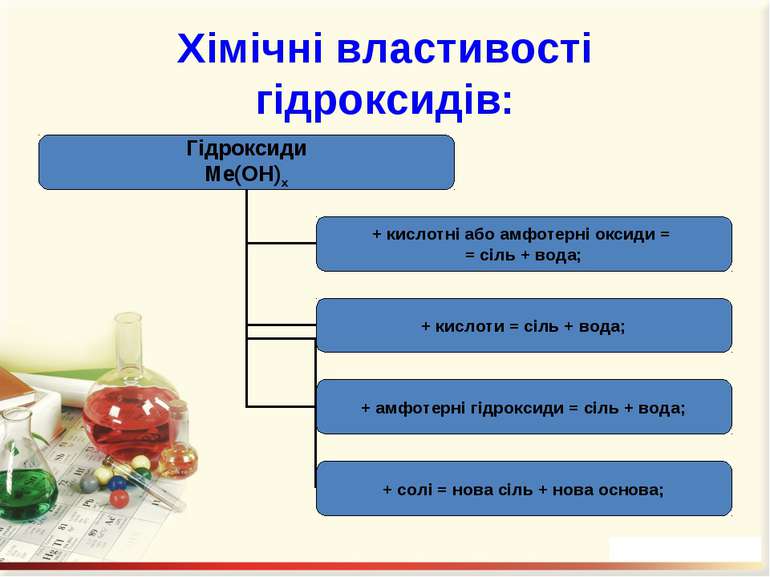
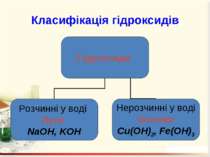
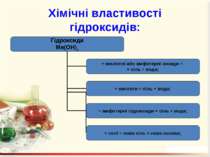
Гідроксиди – це складні речовини, утворені металічними елементами та гідроксильними групами Число гідроксильних груп у молекулі гідроксиду відповідає валентності металу і визначає кислотність основи: NaOH – однокислотна основа; Ca(OH)2 – двокислотна основа. Валентність гідроксогрупи дорівнює І.
Назви гідроксидів Назви гідроксидів складаються з назви металу, після якого вказують римськими цифрами (без відступу) у дужках його валентність та слово гідроксид. Fe(OH)2 – ферум(ІІ) гідроксид; Ni(OH)2 – нікель(ІІ) гідроксид; NaOH – натрій гідроксид.
Перевірте свої знання! Допишіть рівняння реакцій: Mg(OH)2 + SO2 = Ca(OH)2 + Al2O3 = Mg(OH)2 + H2SO4 = Ca(OH)2 + Zn(OH)2 = NaOH + ZnCl2 =
Добування гідроксидів: При взаємодії металів або їх оксидів з водою: 2Na + 2H2O = 2NaOH + H2↑; Na2O + H2O = 2NaOH. 2. Нерозчинні у воді основи добувають непрямим способом, а саме: дією лугів на водні розчини відповідних солей: FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4; AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl.
Правила безпеки життєдіяльності при роботі з лугами - Працювати в захисних рукавичках, захисному одязі та захисних окулярах; - При попаданні кислоти на шкіру промити уражену ділянку великою кількістю проточної води; - При попаданні лугу в очі негайно промити їх розчином борної кислоти аптечного виготовлення; Розлитий луг нейтралізувати оцтом.
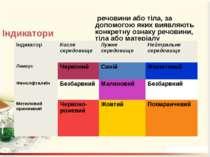
Індикатори речовини або тіла, за допомогою яких виявляють конкретну ознаку речовини, тіла або матеріалу Індикатор Кисле середовище Лужне середовище Нейтральне середовище Лакмус Червоний Синій Фіолетовий Фенолфталеїн Безбарвний Малиновий Безбарвний Метиловий оранжевий Червоно-рожевий Жовтий Помаранчевий
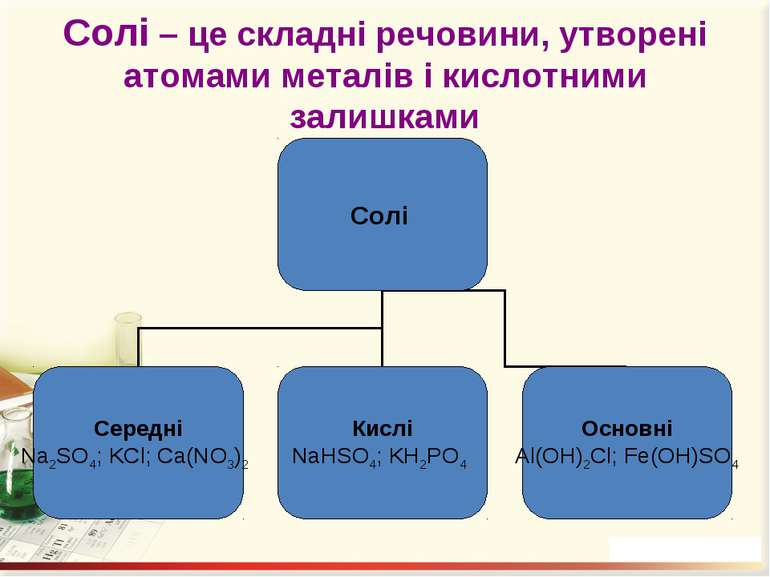
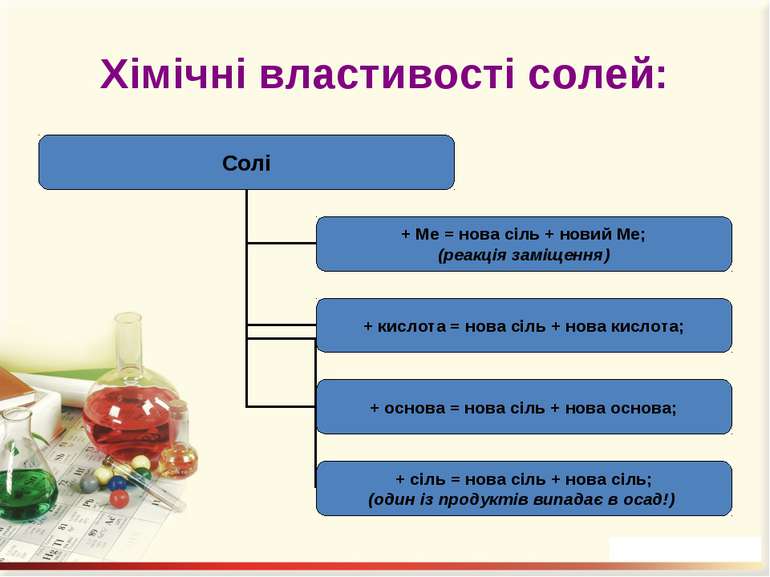
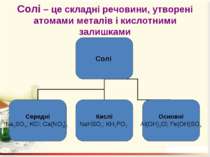
Солі Середні – це продукти повного заміщення всіх атомів Гідрогену кислоти на атоми метелічного елемента (чи металоподібну групу). Кислі – це продукти заміщення лише частини атомів Гідрогену в молекулі кислоти на атоми металічного елемента. Основні – продукти заміщення лише частини гідроксогруп основ (амфотерних гідроксидів) на кислотні залишки.
Номенклатура солей Назви солей найважливіших кислот Кислота Формула Назва відповідної середньої солі Нітратна (азотна) HNO3 Нітрат Карбонатна (вугільна) H2CO3 Карбонат Йодидна (йодоводнева) HI Йодид Силікатна (кремнієва) H2SiO3 Силікат Метафосфатна (мета фосфорна) HPO3 Метафосфат Ортофосфатна (ортофосфорна) H3PO4 Ортофосфат Сульфатна (сірчана) H2SO4 Сульфат Сульфітна (сірчиста) H2SO3 Сульфіт Флуоридна (фтористоводнева, плавикова) HF Фторид Хлоридна (хлороводневі, соляна) HCl Хлорид
Назви солей Fe(NO3)3 – ферум(ІІІ) нітрат; Na2SO4 – натрій сульфат; KHCO3 – калій гідрогенкарбонат; NaH2PO4 – натрій дигідрогенортофосфат; Mg(OH)NO3 – магній гідроксонітрат; Al(OH)2Cl – алюміній дигідроксохлорид.
Перевірте свої знання! Допишіть рівняння реакцій: CuSO4 + Fe = Ca3(PO4)2 + H2SO4 = CrCl3 + NaOH = BaCl2 + Na2SO4 =
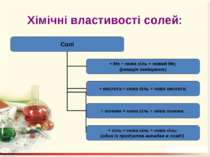
Добування солей 1. Взаємодією кислот з основами (реакція нейтралізації) або амфотерними гідроксидами: Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O; Zn(OH)2 + 2HCl = ZnCl2 + 2H2O. 2. Взаємодією кислот з основними або амфотерними оксидами: MgO + H2SO4 = MgSO4 + H2O; ZnO + 2HNO3 = Zn(NO3)2 + H2O. 3. Взаємодія кислот з металами: Zn + H2SO4 = ZnSO4 + H2↑. 4. Взаємодією кислот з іншими солями: H2SO4 + BaCl2 = BaSO4 + 2HCl.
Добування солей 5. Взаємодія кислотних оксидів з основними або амфотерними: N2O5 + CuO = Cu(NO3)2; SO3 + ZnO = ZnSO4. 6. Взаємодія кислотних оксидів з основними або амфотерними гідроксидами: P2O5 + 6NaOH = 2Na3PO4 + 3H2O; N2O5 + Zn(OH)2 = Zn(NO3)2 + H2O. 7. Взаємодія кислотних оксидів із солями: CaCO3 + SiO2 = CaSiO3 + CO2↑.
Добування солей 8. Взаємодія сильних основ з амфотерними гідроксидами: Ba(OH)2 + Pb(OH)4 = Ba[Pb(OH)6]. 9. Взаємодія основ із солями: FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4. 10. Взаємодія солей із солями: K3PO4 + 3CaCl2 = Ca3(PO4)2↓ + 6KCl. 11. Взаємодія солей з металами, що мають вищу активність, ніж метали, які входять до складу солей: CuSO4 + Fe = Cu↓ + FeSO4.
Добування солей 12. Взаємодія металів з неметалами: Zn + Cl2 = ZnCl2. 13. Термічний розклад солей: 2KNO3 = 2KNO2 + O2↑; 2KClO3 = 2KCl + 3O2↑.
молодець молодець помилка молодець помилка помилка помилка молодець молодець помилка помилка молодець молодець помилка помилка молодець помилка помилка молодець помилка помилка помилка молодець Прокласифікуйте речовини оксиди гідроксиди солі кислоти BaO NaOH CO2 Ba(OH)2 Na3PO4 P2O5 K2SO4 SO3 HCl KOH H2SO4 KCl H3PO4 K2O HNO3 H2S Ca(OH)2 молодець Al2O3 Mg(OH)2 BaCl2 Na2S CaCO3 H2O H2CO3
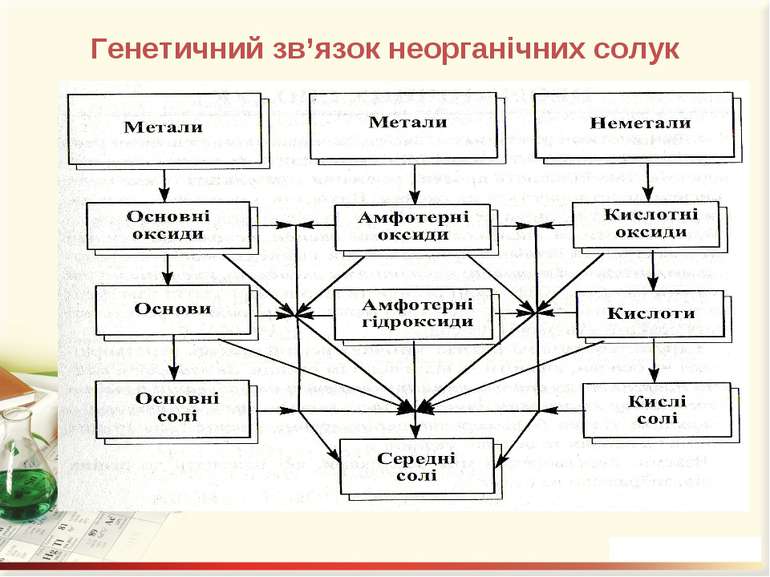
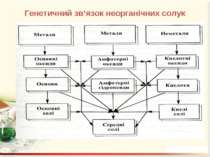
Генетичний зв’язок це зв’язок між речовинами різних класів, що ґрунтується на взаємоперетворенні речовин і показує походження одних речовин від інших. У перекладі з гр. генетичний означає – такий, що стосується походження, вивчає розвиток чого-небудь.
Використані джерела Ярошенко О.Г. Хімія: підручник для 8 класу загальноосвітнього навчального закладу. – К.: Освіта, 2008. – 208 c. Пономарьова В.В. Основні класи неорганічних сполук: навчальний посібник. – Тернопіль: Мандрівець, 2013. – 96 с. http://pedsovet.su/load/171.
Схожі презентації
Категорії