Презентація на тему:
Хімічні властивості середніх солей
Завантажити презентацію
Хімічні властивості середніх солей
Завантажити презентаціюПрезентація по слайдам:
Хімічні властивості середніх солей Вчитель хімії вищої категорії, старший вчитель Костянтинівського ліцею «Ерудит» Донець Ірина Миколаївна
Мета уроку: розширити знання учнів про хімічні влас-тивості класів неорганічних сполук на прик-ладі властивостей середніх солей; дослідити хімічні властивості солей; розвивати навички й уміння складати рівняння хімічних реакцій, формувати вміння виконувати хімічний екс-перимент; спостерігати, робити висновки і узагальнення, поглибити знання учнів про використання солей в промисловості, побуті та народному господарстві, виховувати піз-навальний інтерес до предмета хімії.
Девіз уроку : Дерево науки всім своїм корінням пов'язане з практикою. О. Несмеянов. Просто знати - ще не все, знання треба використовувати. Й.Гете.
Анонс уроку Програма передач, яка вас сьогодні чекає: «Сніданок з 1+1» «Кунсткамера» «Світ подорожей» «Ми - дослідники»
Хімічний тренажер а б в г д е є ж з і ї и К Na Ва Са Mg А1 ІІ Fе IІІ Fе Zn І Сu ІІ Сu Lі 1 С1- 2 Вr- 3 I- 4 S= 5 SO3= 6 SO4= 7 РO4≡ 8 СОз= 9 SiOз= 10 NO3- 11 NO2- 12 F-
Інтелектуальна гра «Найсильніша ланка». І-ІІ групи Називати по черзі як можна більше солей, які використовує людина в своїй діяльності
Картки самоконтролю-відповіді Варіант 1 Варіант 2 Варіант 3 Варіант 4 Сl- SO4= РО4≡ K KCl K2SO4 K3РО4 Са СаСl2 СаSO4 Са3(РО4)2 Аl АlСl3 Аl2(SO4)3 АlРО4 I- CO3= РО4≡ Li LiI Li2CO3 Li3PO4 Ba BaI2 BaCO3 Ba3(PO4)2 Fe (III) FeI3 Fe2(CO3)3 FePO4 NO3- SO3= РО4≡ Na NaNO3 Na2SO3 Na3PO4 Mg Mg(NO3)2 MgSO3 Mg3(PO4)2 Sc (III) Sc(NO3)3 Sc2(SO3)3 ScPO4 Br- SiO3= РО4≡ Ba BaBr2 BaSiO3 Ba3(PO4)2 Pb(ІІ) PbBr2 PbSiO3 Pb3(PO4)2 Cr (III) CrBr3 Cr2(SiO3)3 CrPO4
Кунсткамера “У світі багато див” Бляшанку конторського силікатного клею розвів водою (1:5). Добутий розчин вилив у велику скляну посудину і кинув у неї крупні кристали таких солей: СоС12∙6Н2O; NiС12∙6Н2O (або NiSO4∙7Н2O); СuSO4∙5Н2O; СrС13∙6Н2O; Cr2(SO4)3∙6Н2O; (або КСr(SO4)2∙12Н2O); FеSO4∙7Н2O (або (NН4)2Fе(SO4)2∙6Н2O); MnС12∙4Н2O; FеС13∙6Н2O (або NН4Fе(SO4)2 ∙12Н2O); А12(SO4)3 ∙18Н2O (або КА1(SO4)2 ∙12Н2O); MgС12∙6Н2O. Незабаром з кристалів з'явилися химерні утвори, що формою нагадують морські водорості найрізноманітніших кольорів і відтінків
Планування результатів (що учень повинен знати і повинен уміти): знає склад, назви, фізичні та хімічні властивості середніх солей ; вміє складати відповідні рівняння хімічних реакцій; прогнозує перебіг хімічних реакцій солей та кислот із металами, використовуючи ряд активності металів; проводить хімічний експеримент з дотриманням правил техніки безпеки; спостерігає; узагальнює; формулює висновки.
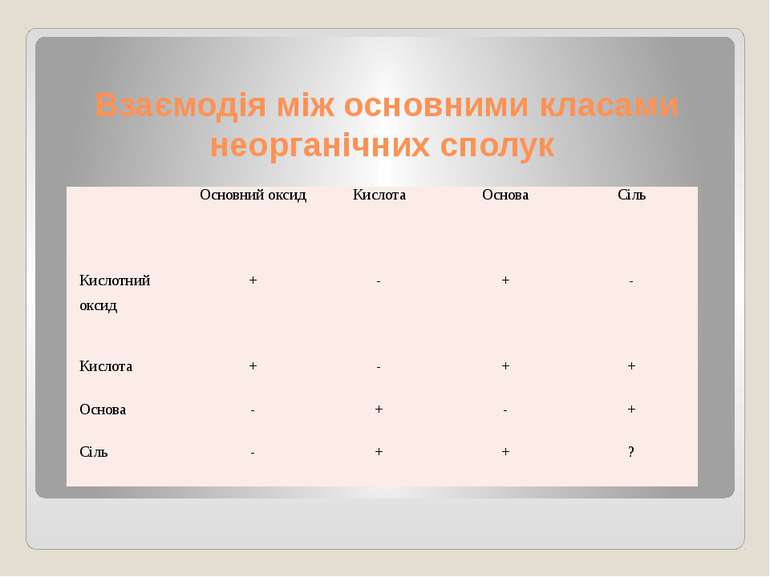
Взаємодія між основними класами неорганічних сполук Основний оксид Кислота Основа Сіль Кислотний оксид + - + - Кислота + - + + Основа - + - + Сіль - + + ?
Проблемні питання - А чи завжди можливі ці реакції? - А чи взаємодіють солі з солями? - Які стосунки у країни «Солі» з країною «Метали»? - Що відбувається з солями при нагріванні?
Взаємодія з металами а) На заняттях хімічного гуртка ми брали алюмінієвий дріт, робили з нього дерево і опускали в розчин Рb(NOз)2 і спостерігали, як гілочки дерева вкривалися голочками. «Сатурнове» дерево. 2А1 + 3Рb(NO3)2 = 2А1(NO3)3+ 3Рb↓ б) Із цинкової пластинки вирізали їжачка і опускали в розчин Рb(NОз)2, він покривався голочками. Zn + Рb(NO3)2= Zn(NO3)2 + Рb↓ в) Опускали алюмінієвий дріт в розчин СuSО4 і на ньому виділялась мідь 2А1 + 3СuSО4 = А12(SO4)3 + 3Сu↓ г) А при опусканні мідної пластинки в розчин FеСl2 реакції не відбулося. FеС12+Сu =
Висновок: Не всі метали реагують із солями, а лише ті, які у витискувальному ряду розташовані лівіше від того металу, який входить до складу солі. У водному розчині відбувається реакція заміщення: активніший метал витісняє менш активний з розчину його солі, внаслідок утворюється нова сіль і новий метал. Пам'ятайте! Для таких реакцій не можна брати дуже активні метали: Lі,Na,К, Са, Ва, які реагують за звичайних умов з водою.
Взаємодія з лугами а) АlСІ3 + 3NaОН = А1(ОН)3↓+ 3NаСl б) К2SO4 + Ва(ОН)2 = 2КОН + ВаSO4↓ До якого типу належать ці реакції? Які реакції називаються реакціями обміну? Які речовини утворюються під час взаємодії солі з лугами? Висновок: Пам'ятайте! Реактиви необхідно підбирати так, щоб в результаті реакції випав осад, тоді реакції проходять до кінця.
Взаємодія з кислотами Які речовини називаються кислотами? За яких умов кислоти взаємодіють з солями? а) СаСО3 + 2НС1 = СаС12 + СO2 + Н2O б) ВаС12 + Н2SO4 = ВаSO4↓+2НС1 в) Са3(РO4)2 + 3Н2SO4 =3 СаSO4↓+ 2Н3РO4 Висновок: Пам'ятайте! Реакції між солями і кислотами відбуватимуться лише тоді, коли: а) сіль утворена леткою кислотою, а реагуюча кислота нелетка; б) утворюється осад, нерозчинний у кислотах;
Взаємодія з солями Чи можлива взаємодія солей з солями? ВаС12 + Nа2SO4 = ВаSO4↓+2NaCl До якого типу належить ця реакція? Що утворюється в результаті даної реакції? Чи завжди можливі реакції між солями? Висновок: Реакції між солями відбуваються лише в тому випадку, коли в результаті реакції утворюється осад.
Термічний розклад солей 2KMnO4= K 2MnO4 +MnO2+ O2 CaCO3=CaO+CO2 (NH4)2Cr2O7 = N2+4 H2O+Cr2O3 ( «Хімічний вулкан»)
Ми-дослідники Лабораторний дослід №7 . Тема. Взаємодія солей з металами. СuSO4 + Fе = FeSO4 + Сu↓ СuSO4 + Zn = ZnSO4 + Сu↓ Висновок: Взаємодія між солями і металами відбувається при умові, якщо метал активніший ніж той, що у складі солі.
Лабораторний дослід №8. Тема. Взаємодія солей з лугами. FеСl3 + 3NаОН = Fе(ОН)3 ↓+ 3NaС1 Na2SO4+ Ва(ОН)2 =ВаSO4 ↓+ 2NаОН Висновок: Розчини солей реагують з лугами з утворенням нової солі і нової основи. Реакції пройшли до кінця, бо випав осад. Ми-дослідники
Лабораторний дослід №9. Тема. Реакція обміну між двома солями. I пробірка Nа2СO3 + Ва(NO3)2 = ВаСОз↓+2NaNO3 II пробірка Na2СO3 + ZnС12 = ZnСO3↓+ 2NaС1 Висновок: солі реагують між собою, реакція йде до кінця, коли випадає осад. Ми-дослідники
Цікаві досліди На уроках трудового навчання дівчата виготовили квіти із паперу. Для зміни забарвлення кольору квіток можна використати реакції обміну між солями. Рb(NO3)2 + 2КІ = РbI2+ 2КNO3 (жовті квітки) Fе2(SO4)3 + 6КСNS = 3К2SO4 + 2Fе(СNS)3 (червоні квітки)
Самостійна робота Середній рівень. Скласти прогноз можливих реакцій серед речовин Zn, А1,СuО,Fе2О3,Сu, Аg, Н2SO4 Достатній рівень. «Хімічні доріжки». Здійснити перетворення: Na →NaOH → Na2SO4 →BaSO4 Na2ZnO2 Високий рівень. Задача. До розчину, що містить натрій гідроксид масою 16г, долили розчину ферум (III) хлориду в надлишку. Обчисліть маси та кількості речовин продуктів реакції.
Рольова гра «Хімічна лабораторія» Розподіл обов’язків між членами групи: Науковий керівник очолює і оцінює роботу групи Інженер-технолог визначає спосіб добування солі,слідкує за технологічним обладнанням Інженер-економіст веде контроль за економією реактивів і веде розрахунки задачі
Рольова гра «Хімічна лабораторія» Завдання: 1) Отримати СaCl2 із тих реактивів, які є в наявності, профільтрувати розчин і виділити сіль в сухому вигляді. Роботу оформити у вигляді таблиці 2) Обчислити, скільки хлориду кальцію можна отримати із 28г оксиду кальцію, якщо на нього подіяти соляною кислотою. Реактиви Що робили Рівняння реакцій Висновок
Домашнє завдання Гра “Хімічні шашки” Ca(OH)2 K2O HNO3 CuO MgO Al2O3 BaCl2 HCl Ca Н3РО4 N2 P2O5
Домашнє завдання § -19. Хімічні шашки Середній рівень. Написати 4,5,6 рівнянь хімічних реакцій з утворенням любих класів неорганічних сполук. Достатній і високий рівень. Написати від 7 до 12 рівнянь хімічних реакцій. Обов'язкова умова: в результаті реакції утворюється сіль КОН, Н2O, СO2, O2, К, Nа2O, Мg, ZпО, СаО, S, Н2, Н2S04, ВаС12, НС1, Са, Н3РO4, N2, Р2O5,Са(OН)2, К2O, HNO3,СиO,МgO,А12O3
Хімія-дивовижна наука «…якомога уважніше вивчайте хімію, хімію! Це дивна наука, знайте!...ЇЇ пронизливий сміливий погляд проникає й у пітьму земної кори ,і в невідомі частинки вашого серця, і в таємниці будови каменю, і в безмовне життя дерев. Вона дивиться всюди і, скрізь відкриваючи гармонію, завзято шукає початок життя» М.Горький
Схожі презентації
Категорії