Презентація на тему:
Електронні оболонки атомів
Завантажити презентацію
Електронні оболонки атомів
Завантажити презентаціюПрезентація по слайдам:
Цілі уроку Розширити уявлення про будову атомів; Навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів І-ІІІ періодів; Формувати вміння визначати електронну будову атома за його положенням у періодичній системі. *
Хімічний бліц-турнір Як визначити кількість елекронів у атомі? Чому атоми електронейтральні? Що таке орбіталь? Які форми може мати електронна хмарина? Яка максимальна кількість електронів може перебувати на s-орбіталі, p-орбіталі, d-орбіталі, f-орбіталі? Яка кількість енергетичних рівнів може бути в атомі? Як визначити кількість енергетичних рівнів у атомі? Як визначити кількість електронів на зовнішньому енергетичному рівні? Як розподіляються електрони по енергетичним рівням? *
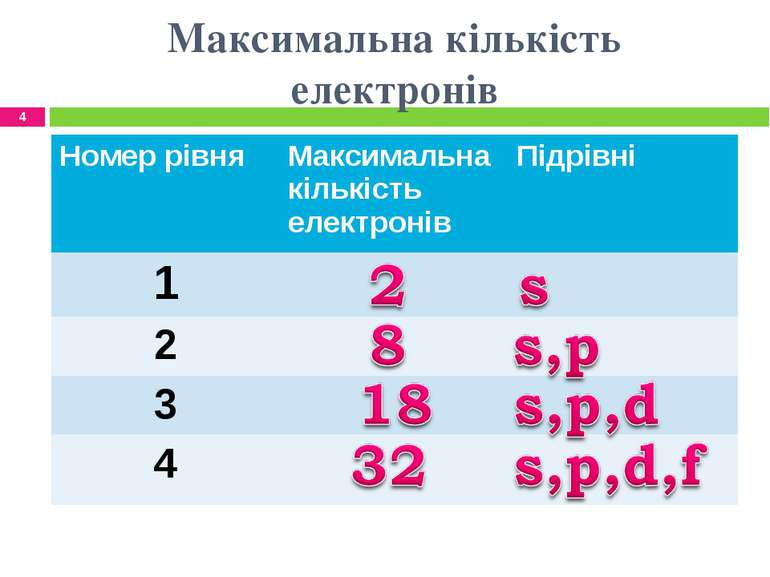
Максимальна кількість електронів * Номер рівня Максимальна кількість електронів Підрівні 1 2 3 4
Практика Побудуймо схему будови атома Гідрогену Н, запишіть електронну формулу, розподіл електронів по квантових комірках Н +1)1 1s Побудуйте схему будови атома Гелію Не, запишіть електронну формулу, розподіл електронів по квантових комірках He +2)2 1s *
Ключові моменти Загальне число електронів у атомі дорівнює номеру елемента в періодичній системі хімічних елементів; Число енергетичних рівнів у атомі дорівнює номеру періоду, в якому знаходиться елемент; Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи, в якому знаходиться хімічний елемент; В атомі не можу бути двох однакових електронів. *
Керована практика Побудувати схему будови атомів, електронну формулу та розподіл електронів по квантових комірках для таких елементів Літію, Берилію, Бору, Карбону Нітрогену, Оксигену, Флуору, Неону. *
Схожі презентації
Категорії