Презентація на тему:
Електролітична дисоціація. Електроліти й неелектроліти
Завантажити презентацію
Електролітична дисоціація. Електроліти й неелектроліти
Завантажити презентаціюПрезентація по слайдам:
Запитання Хто може пояснити, чому ця властивість притаманна металам? Який метал має найвищу електропровідність? Назвіть речовини, що проводять електричний струм (крім металів) і мають вільні електрони. Чи проводить електричний струм вода?
Чому? Чим відрізняються дистильована й водопровідна вода? Висновок: розчинені у воді кристали зробили розчин електропровідним.
— Чи всі речовини здатні так змінювати воду? Проведемо аналогічне дослідження із содою, цукром, лимонною кислотою. Робимо висновок: розчин цукру не проводить електричний струм; розчин лимонної кислоти проводить електричний струм; розчин соди проводить електричний струм.
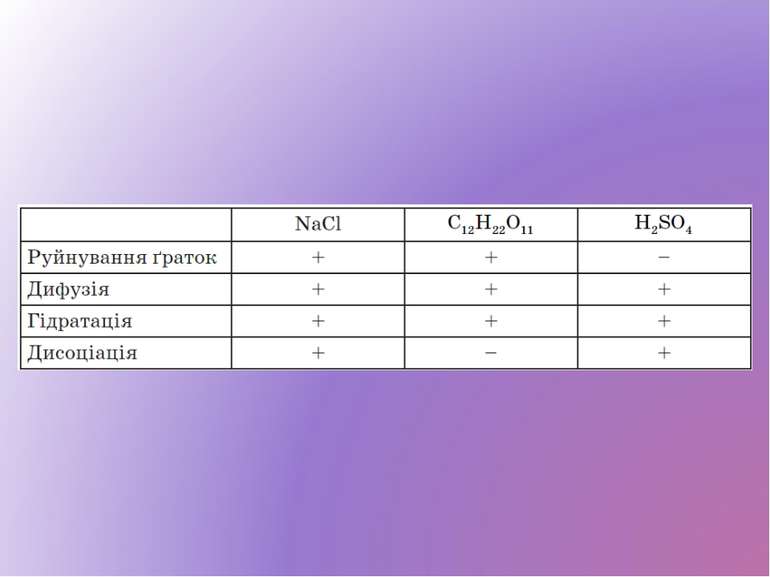
Речовини, розчини й розплави яких проводять електричний струм, називаються електролітами. (До них належать усі солі, кислоти, основи, більшість основних оксидів, тобто речовини з йонним і ковалентним полярним типами зв’язку.)
Речовини, розчини й розплави яких не проводять електричний струм, називаються неелектролітами. (Це прості речовини — неметали, речовини немолекулярної будови, більшість органічних речовин.)
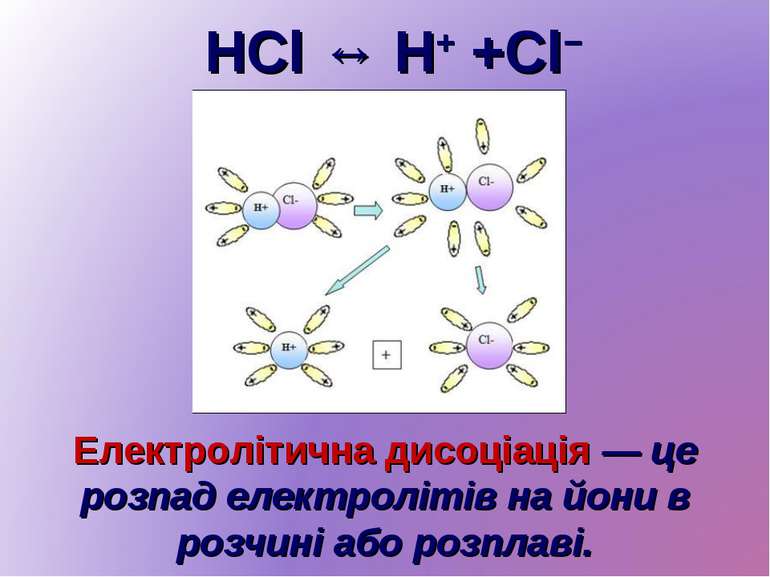
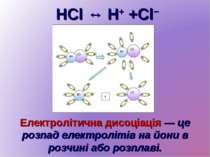
HCl ↔ H+ +Cl− Електролітична дисоціація — це розпад електролітів на йони в розчині або розплаві.
Основні положення ТЕД Дисоціація електролітів відбувається під дією полярних молекул розчинника. Дисоціація — оборотний процес. Зворотний процес називається асоціацією. Молекули, що дисоціюють, розпадаються на катіони й аніони, причому заряд усіх катіонів дорівнює сумарному заряду всіх аніонів. Під дією електричного струму в розчині виникає спрямований рух йонів: катіонів — до катода, аніонів — до анода.
Розглянемо на прикладах: Na2 SO4 ↔ 2Na+ + SO24− NaOH ↔ Na+ + OH− Самостійно запишіть рівняння дисоціації речовин: KOH ↔ CaCl2 ↔ HNO3 ↔
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Написати рівняння дисоціації в розчинах таких речовин: K2SO4, H2SO4, RbOH, BaCl2, HBr, AlCl3.
Схожі презентації
Категорії