Презентація на тему:
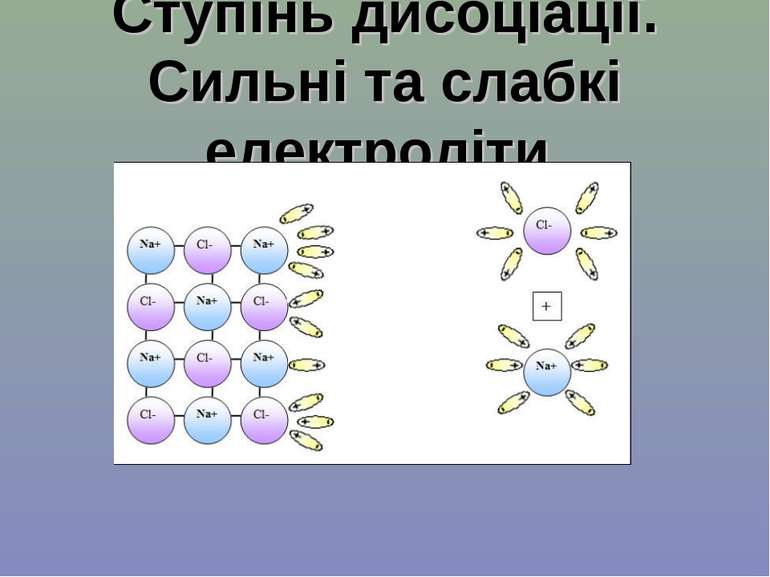
Ступінь дисоціації. Сильні та слабкі електроліти
Завантажити презентацію
Ступінь дисоціації. Сильні та слабкі електроліти
Завантажити презентаціюПрезентація по слайдам:
Робота в парах 1. Обчисліть число йонів у розчинах, що містять: 2 моль CuSO4 1,5 моль HCl 1 моль Al2(SO4)3 1 моль Na3PO4 4 моль NaOH 3 моль H2SO4
2. У розчині містяться йони: Na+ , SO42− , NO3− , OH− , Cu2− , Ba2+ . Напишіть формули електролітів, які могли помістити в розчин для одержання цих йонів. Назвіть йони, які не можуть одночасно міститися в розчині. Чому?
3. Виберіть речовини, у розчинах яких лампочка загориться: Натрій хлорид Етиловий спирт Хлоридна кислота Дистильована вода Бензин Натрій гідроксид Кальцій карбонат Калій сульфат
Кількісно процес дисоціації речовин у розчині можна оцінити за ступенем дисоціації: де Nдис — число молекул, що продисоціювали; Nзаг — загальне число молекул, поміщених у розчин; α залежить від природи розчиненої речовини й розчинника.
Умовно прийнято вважати якщо: α > 30 % — електроліт сильний (солі, луги, сильні кислоти); 2 % < α < 30 % — електроліт середній (H3PO4, НF); α < 2 — слабкі електроліти (H2O, NH4OH, органічні кислоти, H2CO3, H2SiO3, H2S та ін.).
У розчинах слабких електролітів одночасно містяться і йони, і молекули розчиненої речовини. Наприклад, у розчині карбонатної кислоти: H2O + CO2 ↔ H2CO3 ↔ H+ + HCO3− ↔ 2H+ + CO23−
Ступінь дисоціації α змінюється за умов: підвищення температури; зменшення концентрації розчинених речовин; заміни розчинника. Наприклад, у 98%-му розчині H2SO4 (слабкий електроліт) у разі розведення ступінь дисоціації збільшується.
Завдання 1 Запишіть рівняння поетапної дисоціації речовин: H2(CO)3 Mg(OH)2 H3PO4 Ca(OH)2 Завдання 2 Що означає вираз: ступінь дисоціації дорівнює 0,25; 50 %; 15 %; 0,0017?
Завдання 3 Обчисліть ступінь дисоціації, якщо відомо, що за температури 25 °С у воді розчинилося молекул речовини: 20 із 200; 10 із 80; 30 зі 100; 50 зі 150. Завдання 4 Чому дорівнює ступінь дисоціації, якщо Nдис = 0? якщо Nдис = Nзаг?
Завдання 5 За температури 18°С ступінь дисоціації води дорівнює 1,4·10−9. Обчисліть, скільки молекул продисоціює в 1 л води.
Завдання 6 Обчисліть кількість йонів H+ у розчині сульфатної кислоти масою 180 г, якщо масова частка кислоти — 50 %. Ступінь дисоціації прийняти за 100 %.
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Схожі презентації
Категорії