Презентація на тему:
Електрохімічні методи аналізу
Завантажити презентацію
Електрохімічні методи аналізу
Завантажити презентаціюПрезентація по слайдам:
План Класифікація електрохімічних методів аналізу Електрогравіметрія Кондуктометрія Кулонометрія
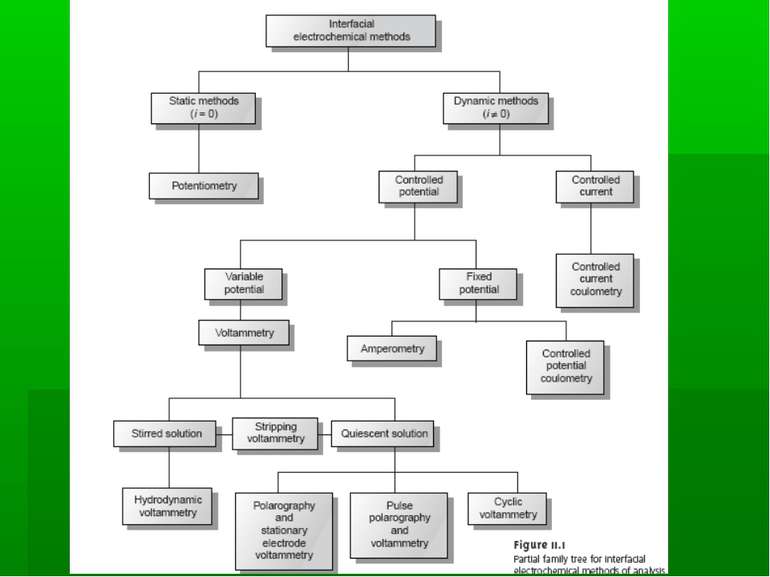
Класифікація електрохімічних методів аналізу Електрохімічні методи базуються на вимірюванні електричних параметрів електрохімічних явищ, які виникають в досліджуваному розчині. ЕХМА: методи без накладання ззовні потенціалу (потенціометрія) методи з накладанням потенціалу ззовні, які базуються на вимірюванні різних електричних параметрів (всі інші методи)
Методи з накладанням потенціалу ззовні базуються на вимірюванні: електропровідності розчинів – кондуктометрія кількості електрики, яка пройшла через розчин – кулонометрія залежності величини струму від накладеного потенціалу – вольтамперометрія часу, необхідного для проходження електрохімічної реакції - хроноелектрохімічні методи (хроновольтамперометрія, хронокондуктометрія) маси речовини, яка виділилася внаслідок проходження певної сили струму через розчин – електрогравіметрія
Електрогравіметрія Електрогравіметричний метод аналізу полягає в кількісному виділенні визначуваної речовини на попередньо зваженому електроді і встановленні вмісту речовини в пробі по зростанню маси електрода
закони Фарадея: кількість речовини, яка утворюється в результаті катодної або анодної реакції при електролізі, прямо пропорційна кількості електрики Q, яка пройшла через електролізер: m = k Q Q = i t. (Кл = 1А с).
закони Фарадея: при проходженні через розчин одної і тої ж кількості електрики на електродах виділяється одна і та ж кількість еквівалентів речовини.
Для електролізу, який проводиться з аналітичною метою, слід забезпечити 100% вихід по струму (ВПС)
Вимоги до осадів осад повинен бути певної кристалічної форми осад повинен бути практично нерозчинним чистота осаду повинна строго витримуватись осад повинен відповідати хімічній формулі (складу)
Умови проведення електролізу фізичні: напруга сила струму опір розчину густина струму (чим вища, тим швидше проходить осадження, але дуже велика приводить до утворення завеликих або замалих кристалів, нещільних осадів) – оптимальна 0.01-0.1А/см2
Умови проведення електролізу хімічні: середовище осадження (сульфатнокисле середовище – оптимальне) наявність конкуруючого комплексоутворення для забезпечення „маскування” під низько концентровані розчини (щоб осади були кристалічними, чистими)
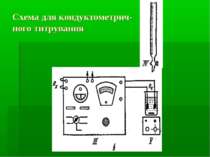
Головні вузли приладу для електрогравіметричного визначення: джерело постійного струму засіб подавання визначеної напруги електролізер: платиновий анод і платиновий катод (сітка) мішалка
Застосування електрогравіметрії для роздільного визначення металів, яке можливе, якщо: - для однозарядних катіонів різниця в потенціалах виділення становить 0.4 В - для двозарядних катіонів різниця в потенціалах виділення становить 0.2 В
Кондуктометрія Електропровідністю називають здатність речовини проводити електричний струм під дією зовнішнього електричного поля. Одиницею електропровідності є провідність провідника опором 1 Ом. В СІ ця одиниця отримала назву сіменс (См).
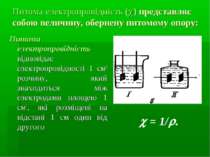
Питома електропровідність ( ) представляє собою величину, обернену питомому опору: Питома електропровідність відповідає електропровідності 1 см3 розчину, який знаходиться між електродами площею 1 см2, які розміщені на відстані 1 см один від другого = 1/ .
Еквівалентна електропровідність рівна електропровідності такого об’єму розчину, який поміщається між двома паралельними електродами, розміщеними на відстані 1 см, який містить 1 моль речовини.
Електропровідність пов’язана з рухливістю іонів: При нескінченно великому розведенні = 1 і еквівалентна електропровідність прямує до найбільшого значення
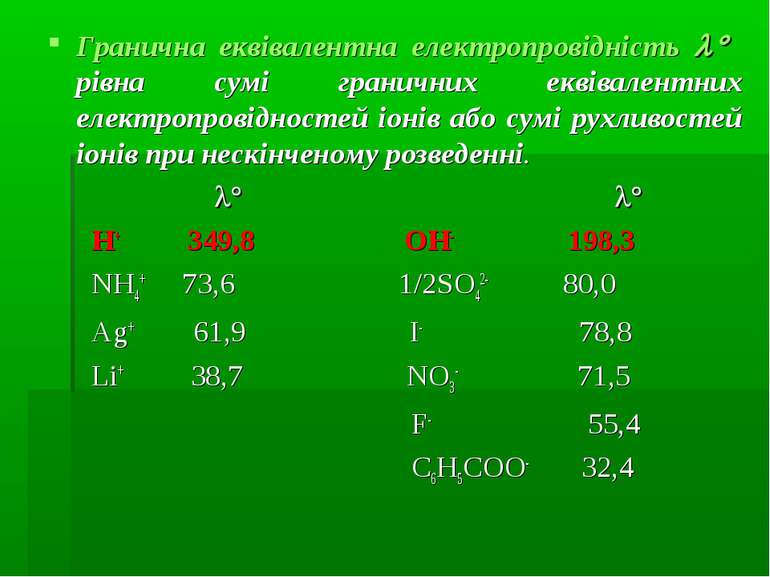
Гранична еквівалентна електропровідність рівна сумі граничних еквівалентних електропровідностей іонів або сумі рухливостей іонів при нескінченому розведенні. H+ 349,8 OH- 198,3 NH4+ 73,6 1/2SO42- 80,0 Ag+ 61,9 I- 78,8 Li+ 38,7 NO3- 71,5 F- 55,4 C6H5COO- 32,4
Фактори впливу на електропровідність електролітів: природа розчинника (в’язкість і діелектрична проникність розчинника) природа електроліту концентрація електроліту
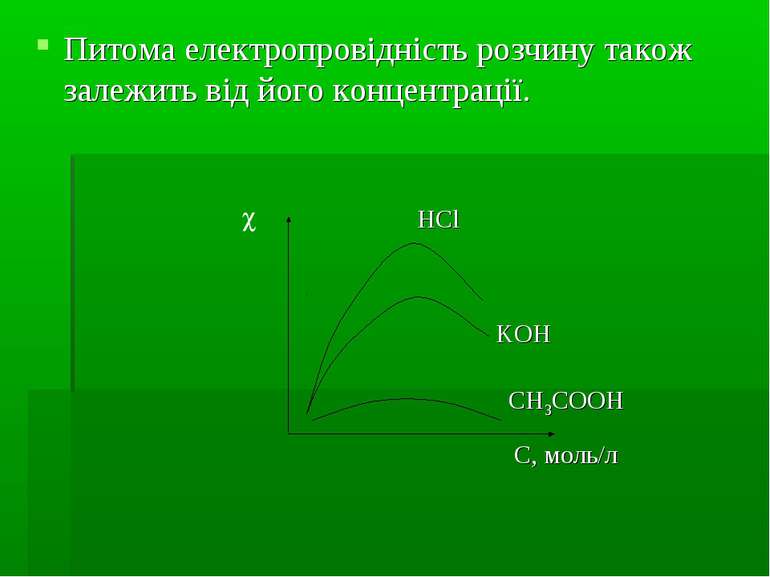
Еквівалентна електропровідність розчину електроліту залежить від концентрації: чим вища концентрація, тим нижча електропровідність: через посилення міжіонних взаємодій завдяки катофоретичному і релаксаційному ефектам Залежність еквівалентної електропровідності сильного електроліту, який дисоціює всього на два види іонів, від концентрації виражається рівнянням Онзагера: де В – функція, що залежить від: заряду іонів, динамічної в’язкості розчинника, температури, діелектричної проникності розчинника.
Питома електропровідність розчину також залежить від його концентрації. HCl KOH CH3COOH С, моль/л
В розведених розчинах сильних і слабких електролітів питома електропровідність розчину може бути розрахована, якщо відомі концентрації іонів і їх еквівалентні електропровідності:
Залежність електропровідності від температури виражають рівнянням: Підвищення температури на 1 С викликає збільшення електропровідності розчину на 2-2,5%.
Пряма кондуктометрія Якісний аналіз – наявність будь-яких іонів Кількісний аналіз - визначення концентрації електроліту безпосереднім вимірюванням електропровідності розчину, так як в певних межах існує прямолінійна залежність між концентрацією і електропровідністю.
Застосування прямої кондуктометрії: для визначення індивідуальних електролітів в розчині для визначення електролітів в сумішах в тих випадках, коли концентрації домішок не змінюються для здійснення неперервного контролю виробництва для контролю процесу очистки води оцінки забруднення стічних вод для визначення загального вмісту солей в мінеральній, морській і річній воді для здійснення контролю операції промивки осадів і регенерації іонітів для визначення чистоти малорозчинних осадів або органічних препаратів для визначення вологості органічних розчинників, газів, твердих солей, текстильних матеріалів, паперу для детектування при хроматографічному розділенні.
Установка для отримання води очищеної з кондуктометричним датчиком для контролю якості води очищеної
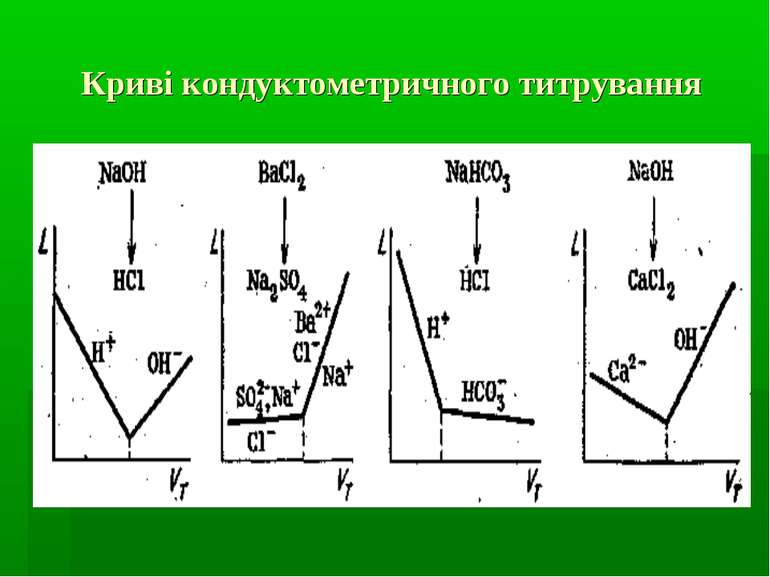
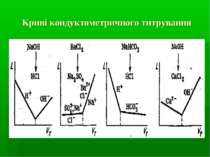
Кондуктометричне титрування Вимоги до реакцій: як в класичному титриметричному аналізі. Типи реакцій: кислотно-основної взаємодії осадження Комплексоутворення !!! Реакції ox-red практично не застосовуються
Кулонометрія Кулонометричний аналіз належить до групи електрохімічних методів і є абсолютним. Він базується на вимірюванні кількості електрики, витраченої на кількісне здійснення даного електрохімічного процесу в даній пробі. Вихід по струму стосовно електрохімічного процесу повинен складати 100%.
Схожі презентації
Категорії