Презентація на тему:
Електродні процеси в розчинах.
Завантажити презентацію
Електродні процеси в розчинах.
Завантажити презентаціюПрезентація по слайдам:
План. Електродні потенціали. Рівняння Нернста. Типи електродів. Окисно-відновні системи. Потенціометричне вимірювання рН.
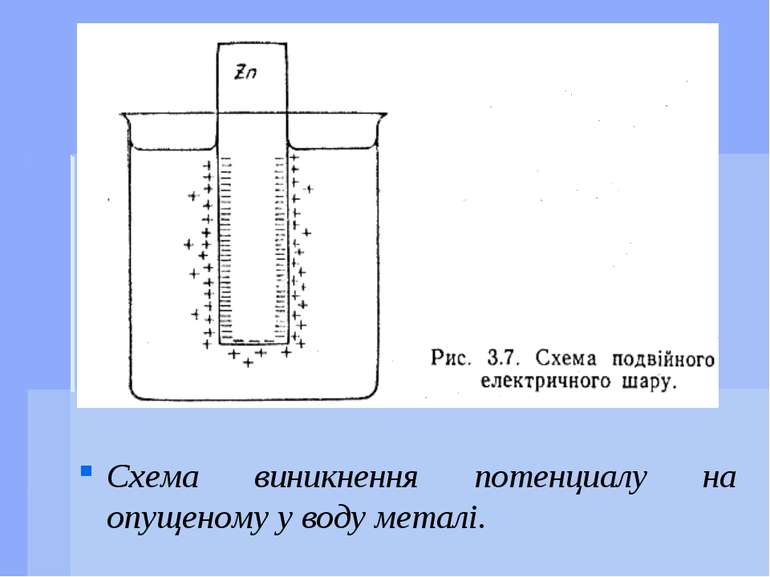
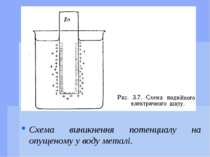
Виникнення потенціалів При зануренні металу у воду відбувається відрив іонів від кристалічної гратки під впливом полярних молекул розчинника. В результаті переходу катіонів металу в розчин метал набуває деякого негативного заряду за рахунок електронів, що на ньому залишилися. Прилеглий до металу шар води заряджається позитивно за рахунок катіонів металу. На межі розділення метал - вода утворюється подвійний електричний шар, що і називається електродним потенціалом.
Виникнення потенціалів При зануренні металу в розчин його солі можливий процес переходу катіонів металу в розчин - тоді метал заряджається негативно.Також можливий перехід катіонів з розчину на метал - тоді метал заряджається позитивно. Таким чином, кожному металу, зануреному у розчин своєї солі, відповідає той чи інший потенціал. Потенціали, що виникають на металах при зануренні у розчини власних солей, називаються електродними потенціалами. Такі металеві пластинки або дротини називаються електродами.
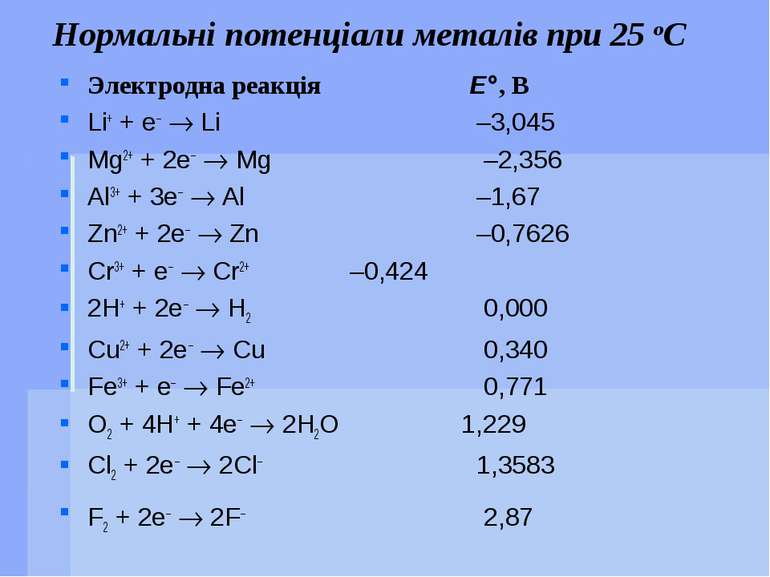
Нормальним електродним потенціалом називають потенціал, що виникає на металевій пластинці, зануренній в розчин солі цього ж металу з концентрацією 1 моль еквіваленту в літрі розчину, при порівнянні з потенціалом водневого електрода, потенціал якого прийнято вважати рівним 0.
Нормальні потенціали металів при 25 оС Электродна реакція E°, В Li+ + e– ® Li –3,045 Mg2+ + 2e– ® Mg –2,356 Al3+ + 3e– ® Al –1,67 Zn2+ + 2e– ® Zn –0,7626 Cr3+ + e– ® Cr2+ –0,424 2H+ + 2e– ® H2 0,000 Cu2+ + 2e– ® Cu 0,340 Fe3+ + e– ® Fe2+ 0,771 O2 + 4H+ + 4e– ® 2H2O 1,229 Cl2 + 2e– ® 2Cl– 1,3583 F2 + 2e– ® 2F– 2,87
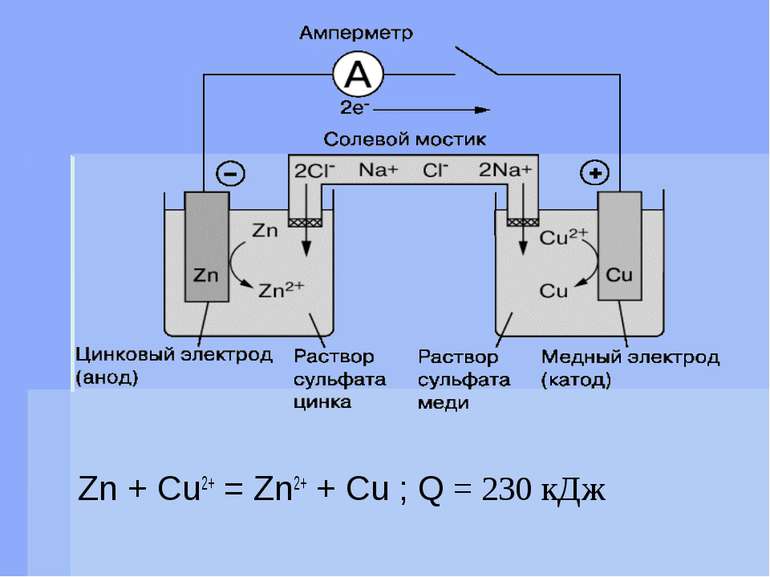
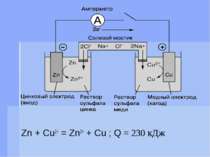
Електрорушійна сила При наявності системи двох електродІв, що знаходяться відповідно в розчинах своїх солей, між ними виникає електрорушійна сила, яка дорівнює різниці двох электродних потенціалів: Е = е+ - е- где Е – электрорушійна сила елемента (Е.р.с.) е+ , е- - потенціали позитивного і негативного електродів.
Рівняння Нернста: 2,303 ·R·T e = e0 + ————— lg α Men+ n F де е – електродний потенціал, В e0- нормальний (стандартний электродний потенціал), В R – универсальна газова постійна 8,31 Дж/моль·К Т – абсолютна температура, К n – число електронів,які віддає атом металлу, перетворюючись в іон F – число Фарадея (9,65·104 Кл/моль) α Men+- активність або концентрація іонів металу в розчині
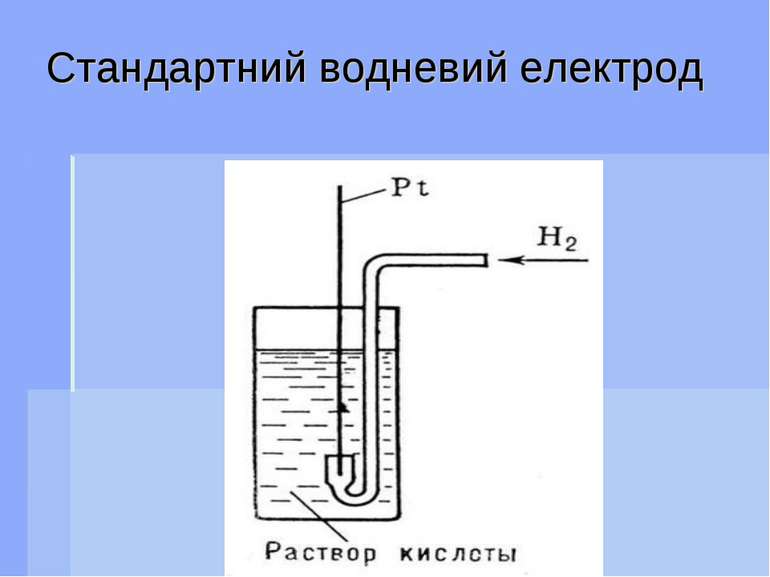
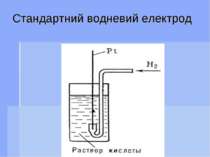
Стандартний водневий електрод Стандартным електродом называють напів елемент, що складається з черненої платинової пластинки, насиченої газоподібним воднем при тиску 101,3 кПа (1 атм) і яка знаходиться в розчині іонів водню с активністю, рівною 1 при температурі 298 К.
Стандартний водневий електрод записується таким чином: Pt (H2)H+ (pH2 = 101,3 кПа, αН+ = 1) На водневому електроді проходить реакція Н+ + е = ½Н2. Рівяння Нернста для потенціалу водневого електрода має вигляд: Е Н+/ Н = е0 + 0,059 lg αН+
Єлектроди I-го роду До електродів 1-го роду належвть металеві електроди, що знаходяться в розчині своїх іонів. Схематично електрод 1-го роду записується так: Ме/Меn+. Електродна реакція в таких напівелементах відповідає реакціям окиснення, якщо в гальванічному колі електрод негативний: Ме - nе = Меn+ и реакціям відновлення, якщо електрод позитивний: Меn+ + nе = Ме
Типові електроди 1-го роду: срібло в розчині нітрату аргентуму Ag/Ag+; мідь в розчині сульфату купруму Сu/Cu2+. Для срібного электроду електродний потенціал записується так: еAg+/Ag = e0Ag+/Ag + 0,059 lgαAg+
Електроди II-го роду До електродів 2-го рода належить хлорсрібний електрод. Він складається з срібної дротини або пластинки з нанесеним шаром хлориду аргентуму, зануреної в розчин КСl: Ag, AgCl / KCl На электроді встанавлюється рівновага : AgCl + e = Ag + Cl- Потенціал хлорсрібного електрода залежить від активності (концентрації) хлорид-ионів в розчині: e Ag, AgCl = e0 – 0,059 lgαcl-
Окисно-відновні електроди До окисно-відновних електродів належать півелементи, шо складаються з інертного металу (платина, золото), що знаходиться в разчині, що містить окиснену і відновлену форму одного і того ж елемента. Наприклад: Pt/ Fe3+/Fe2+
Інертний метал в цьому електроді не бере участі в електродній реакції, а тільки є переносником електронів. Розчин, що містить одночасно окиснену і відовлену форму речовини, утворює окисно-вілновну систему (редокс-систему). Наприклад, система, шо містить іони феруму Fe3+ + e = Fe2+ Fe3+ - окиснена форма, Fe2+ - відновлена форма
Потенціал окисно-відновного электрода разраховують за рівнянням Нернста-Петерса: RT аFe3+ e Fe3+/Fe2+ = e0 + —— lg ——— nF аFe2+
Мембранні електроди Найпоширенішим мембранним електродом є скляний. Він складається з скляної трубки, яка закінчується кулькою з спеціального електродного скла. Всередину наливають буферний розчин і для відводу струму поміщають хлорсрібний електрод. Між склом і розчином виникає потенціал, величина якого залежить від рН. Для вимірювання рН складають гальванічне коло з скляного електрода і електрода порівняння (хлорсрібного): Скляні електроди придатні для вимірювания рН в біологічних середовищах.
Схожі презентації
Категорії