Презентація на тему:
Функції біологічних мембран - повна діюча копія
Завантажити презентацію
Функції біологічних мембран - повна діюча копія
Завантажити презентаціюПрезентація по слайдам:
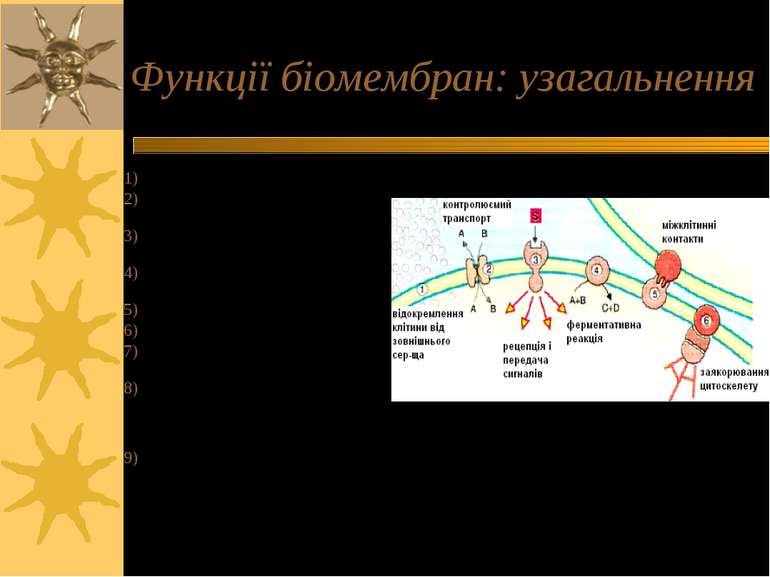
Функції біомембран: узагальнення Бар єрна функція (ПМ) Трансмембранні рухи речовин (транспортна функція, ПМ); Рецепторна функція (ПМ);передача сигналів Регуляція синтезу та дії циклічних нуклеотидів (ПМ); Міжклітинні взаємодії (ПМ); Заякорювання цитоскелету поширення процесів збудження (ПМ; збудливі тканини); Перетворення енергії в біомембранах (спряжені мембрани, зокрема, мітохондріальні мембрани) Детоксикаційна функція (мікросомальні мембрани )
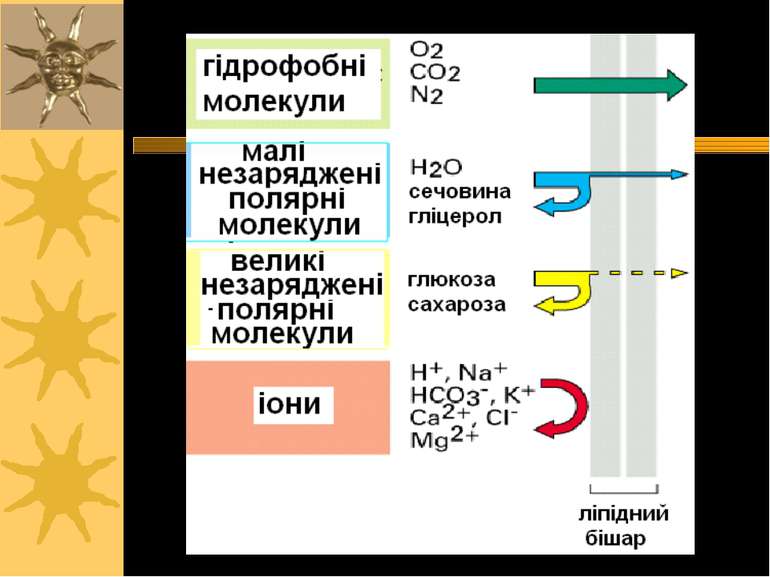
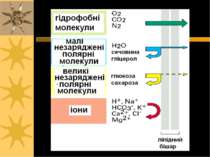
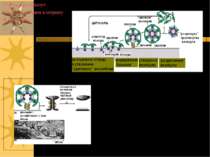
Транспортна функція Забезпечує створення і підтримку концентраційного й електрохімічного градієнтів Роль мембрани: спряження і регуляція потоків енергії, що спричиняють і супроводжують процеси транспорту Концентрація іонів зсередини клітини і поза нею:
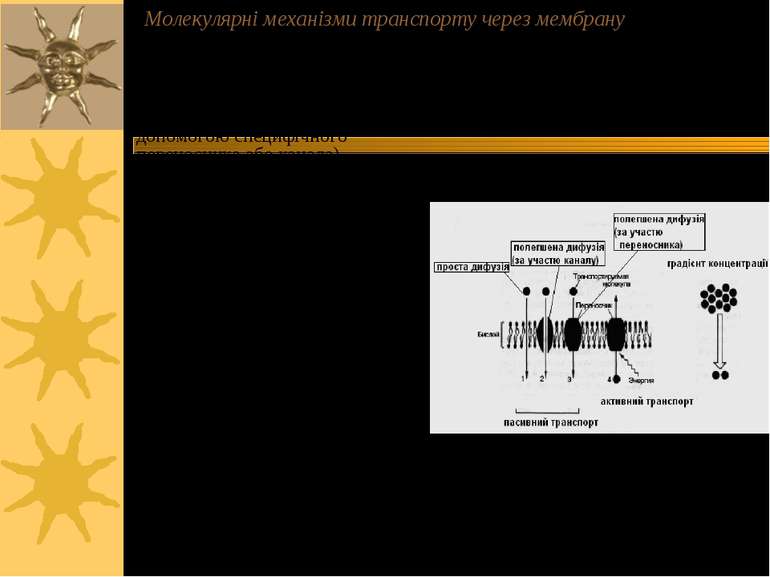
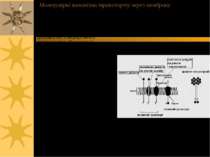
Молекулярні механізми транспорту через мембрану - пасивний транспорт ( за градієнтом концентрації): а) проста дифузія; б) полегшена дифузія ( за допомогою специфічного переносника або канала) - активний транспорт (проти градієнта концентрації за рахунок гідролізу АТФ): а) первинно-активний транспорт (напр., Na+, К+-АТФаза, Са++-АТФаза та ін. помпи (насоси)); б) вторинноактивний транспорт (напр., Na+-залежний котранспорт глюкози або амінокислот – т. зв. спряжений транспорт, або котранспорт, який здійснюється за рахунок енергії, зумовленої градієгтом інших іонів, в даному випадку – Na+) в) ендо- і екзоцитоз – вони також належать до активного транспорту, але пов язані з порушенням структурної цілісності мембран
Уніпорт – молекули речовин, що транспортуються (або іони) переносяться через мембрану незалежно від наявності і переноса інших сполук Симпорт - молекули речовин, що транспортуються (або іони) переносяться через мембрану одночасно і однонаправлено з іншими сполуками Антипорт – транспорт сполук зумовлений одночасним і протилежно направленим транспортом іншої сполуки Котранспорт – це і симпорт, і антипорт
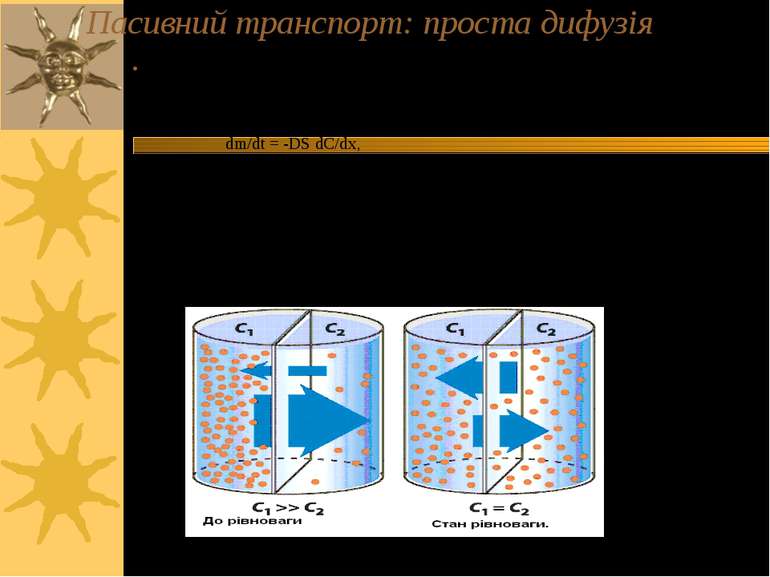
Пасивний транспорт: проста дифузія Проста дифузія – напр., транспорт СО2, Н2О, О2 – процес неспецифічний і дуже повільний Дифузійні процеси – самовільне переміщення речовини внаслідок теплового руху молекул – приводять систему в стан рівноваги й описуються рівнянням Фіка: dm/dt = -DS dC/dx, де dm/dt – кількість речовини m, що проходить через поверхню S за час t; D – коефіцієнт дифузії (см2/с); С – концентрація речовини; х – відстань Швидкість дифузії залежить від розміру молекул, що переносяться, і від їх концентрації
Пасивний транспорт: полегшена дифузія Полегшена дифузія – процес більш специфічний і більш швидкий; можлива за участю: - каналу (для К+, Са++, Mg++) - переносника (приклад – пермеази: транспортери для глюкози, тощо) - іонофорів - антибіотиків, здатних формувати канал (приклад – граміцидин – пронизує білкову мембрану наскрізь і формує канал, по якому можуть рухатися іони), або виступаючих в ролі мобільних переносників, які при зв язуванні з транслокуємою сполукою змінюють свою конформацію, із гідрофільних стають гідрофобними і, рухаючись навколо своєї вісі, перетинають мембрану (приклад – валіноміцин, що, зв язуючи іони К+, перетворюється на гідрофобну сполуку і перетинає мембрану)
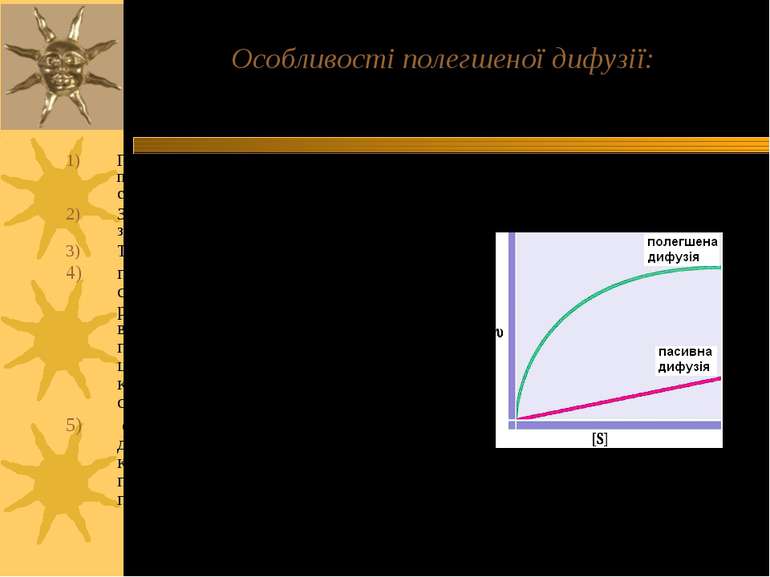
Особливості полегшеної дифузії: Переміщення речовини, як і у випадку простої дифузії, переводить систему у стан рівноваги; Застосування каналу або переноснику збільшує швидкість дифузії; Транспорт підлягає кінетиці насичення при полегшеній дифузії спостерігається конкуренція речовин, які переносяться, в тих випадках, коли одним переносником переносяться різні сполуки; при цьому одні речовини переносяться краще, ніж інші, й додавання цих сполук ускладнює транспорт інших; є сполуки, що блокують полегшену дифузію: вони утворюють міцний комплекс із молекулами переносника, що запобігає подальшому переносу.
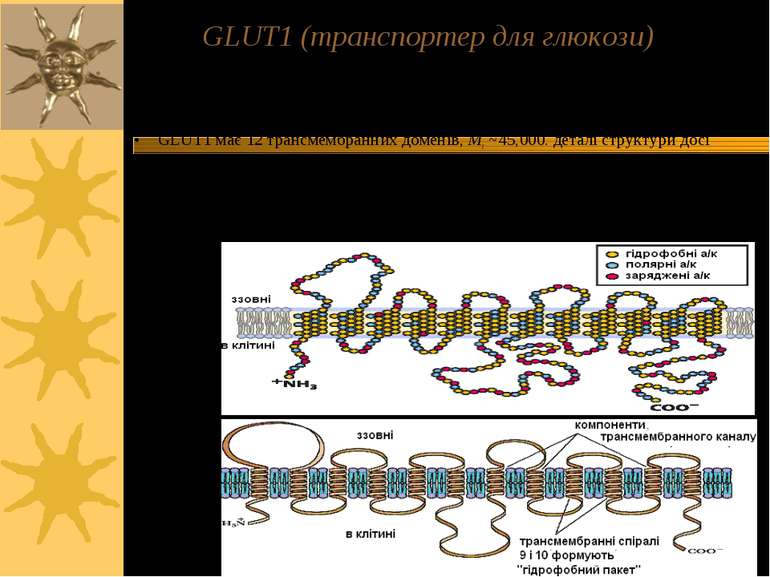
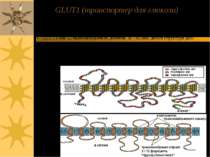
GLUT1 (транспортер для глюкози) Здійснює поглинання глюкози еритроцитами; належить до пермеаз. Пермеази – родина трансмембранниих білків, що полегшують дифузію специфічних молекул через біомембрани. GLUT1 має 12 трансмембранних доменів, Mr ~45,000. деталі структури досі не встановлені Кілька цих доменів створюють лінійний канал із гідрофільними залишками амінокислот; це дозволяє утворювати із молекулою глюкози водневі зв язки під час її транспортування через мембрану
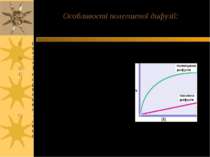
Полегшена дифузія: за участю молекулоспецифічної пермеази полегшується транспорт за градієнтом концентрації Концентрація глюкози поза клітиною , mM Проста дифузія Полегшена дифузія Vmax 1/2 Vmax Km Швидкість поглинання глюкози Транспортери повинні мати специфічний зв язуючий сайт для молекул, напр., для глюкози. Після входу в клітину глюкоза звичайно фосфорилюється і йде у метаболічні шляхи – тому зовнішня концентрація глюкози завжди вища, ніж внутрішньоклітинна Насичення
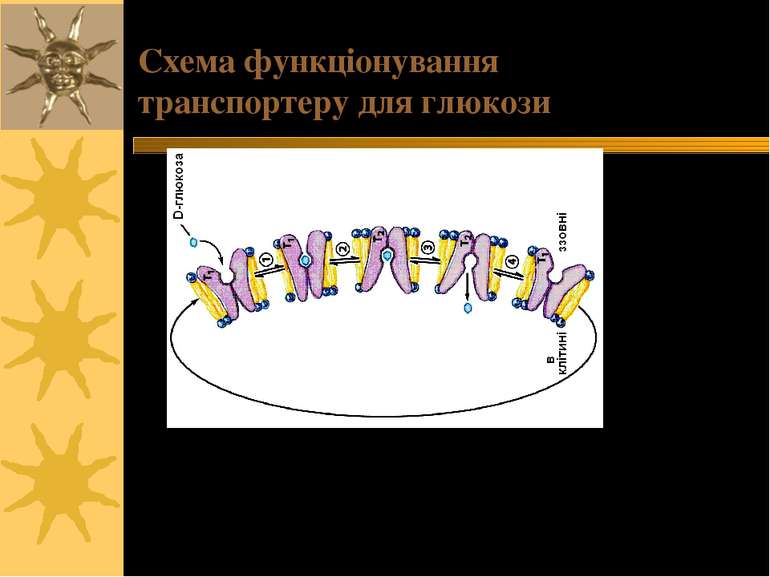
2 конформації: T1 and T2. Глюкоза рухається за градієнтом концентрації Схема функціонування транспортеру для глюкози
Переносники глюкози є родиною структурно близьких мембранних білків з різними функціями. GLUT-1 і GLUT -3 мають высоку спорідненість до глюкози (Кd біля 1 мМ). Вони виявлені майже в усіх клітинах, де забезпечують постійне надходження глюкози. GLUT -2 виявлений в клітинах печінки й підшлункової залози. Цей переносник має гораздо меншу спорідненість до глюкози (Kd 15-20 мМ). GLUT-4 с Kd біля 5 мМ виявлений в ПМ м язових і жирових клітин. Гормон інсулін спричиняє збільшення кількості молекул GLUT-4 на поверхні клітини і таким чином стимулює надходження глюкози в ці тканини. GLUT-5 синтезуються клітинами кишкового епітелію. Цей переносник забезпечує симпорт глюкози з іонами Na+
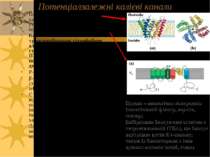
Канали Іонна проникність клітинних мембран забезпечується іонними каналами (напр., К+, Mg++, Cl-, Са++-канали) Властивості більшості іонних каналів: 1) Вбудовані у ліпідний бішар (є інтегральними білками); 2) специфічність (вибірковість); 3) феномен насичення при рості концентрації субстратів (іонів); 4) конкурентне пригнічення аналогами субстрата (іонами-блокаторами) Через різні канали за секунду проходить 106 – 109 іонів Канали працюють за принципом “все або нічого”: тобто можуть бути або закритими, або відкритими. Із закритого стану у відкритий їх переводять конформаційні зміни Регуляція роботи каналів: специфічні речовини м.б. їх активаторами чи інгібіторами; можлива регуляція через фосфорилювання за залишками треоніну, серину, тирозину.
Типи мембранних каналів Ліганд-залежні (ліганд може бути позаклітинним або внутрішньоклітинним, але не є іоном, який транспортується по каналу) Потенціал-залежні – в так званих “збуджуючихся” клітинах (нейрони, м язові клітини) механочутливі - відкриття механічними впливами звукових хвиль іонних каналів клітин внутрішнього вуха, що спричиняє виникнення нервового імпульсу, який надалі в мозку інтерпретується як звук світлочутливі
Ліганд-залежні іонні канали Позаклітинні ліганди: АХ, серотонін, глутамат, ГАМК, гліцин, тощо Внутрішньоклітинні ліганди: “вторинні месенджери” (цАМФ, цГМФ) активують відповідну протеїнкіназу. Пк каталізує приєднання до іонного каналу фосфату, що спричиняє його відкриття; фосфорилювання регуляторних компонентів каналу також контролює тривалість його існування у відкритому стані. Інший приклад – фосфорилювання CFTR-каналу
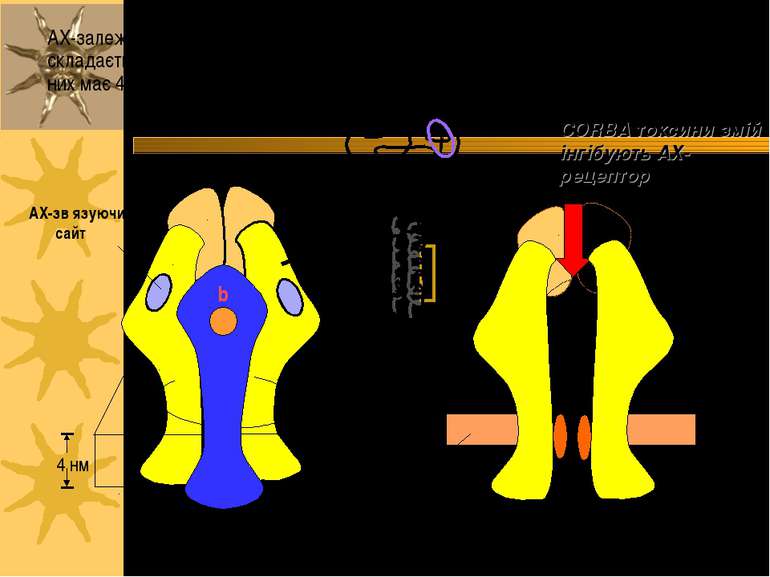
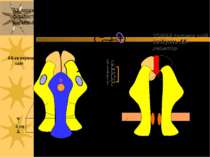
АХ-зв язуючий сайт Ліпідний бішар цитозоль канал пора ворота АХ-залежний катіонний канал складається із 5-ти п/п с/о; кожна з них має 4 трансмембранних домени a a g d 4 нм b CORBA токсини змій інгібують АХ-рецептор
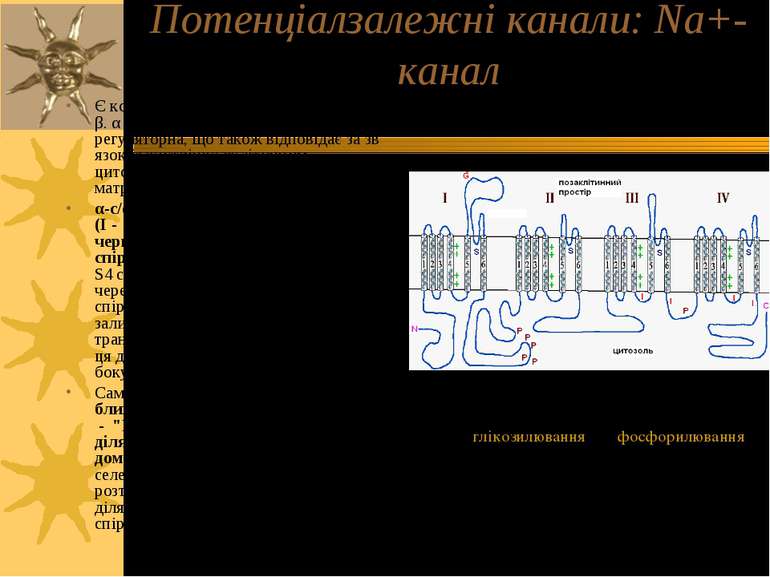
Потенціалзалежні канали: Na+-канал Є комплексом 2-х типів білкових с/о - α і β. α с/о формує пору каналу; β с/о – регуляторна, що також відповідає за зв язок із внутрішньоклітинним цитоскелетом і позаклітинним матриксом. α-с/о має 4 домени, що повторюються (І - IV); кожен такий домен, в свою чергу, має 6 трансмембранних спіралей (S1 - S6). Висококонсервативна S4 спіраль діє як сенсор напруги каналу через те, що в кожній 3-й позиції цієї спіралі розташовані “+” заряджені залишки амінокислот. Коли трансмембранний потенціал змінюється, ця ділянка рухається до позаклітинного боку ПМ і відкриває канал для іонів. Сама пора м.б. поділена на 2 частини: ближче до позаклітинного середовища - "P-loops" (Р-петлі), утворені ділянками між S5 і S6 кожного із 4-х доменів. Ця частина відповідає за селективність каналу. Внутрішня – та, що розташована ближче до цитоплазми – ділянка пори утворена безпосередньо спіралями S5 і S6 всіх 4-х доменів. α-с/о Na+-каналу: G - глікозилювання, P - фосфорилювання, S – іонна селективність, I - інактивація, позитивні (+) заряди S4 важливі для трансмембранної напругочутливості
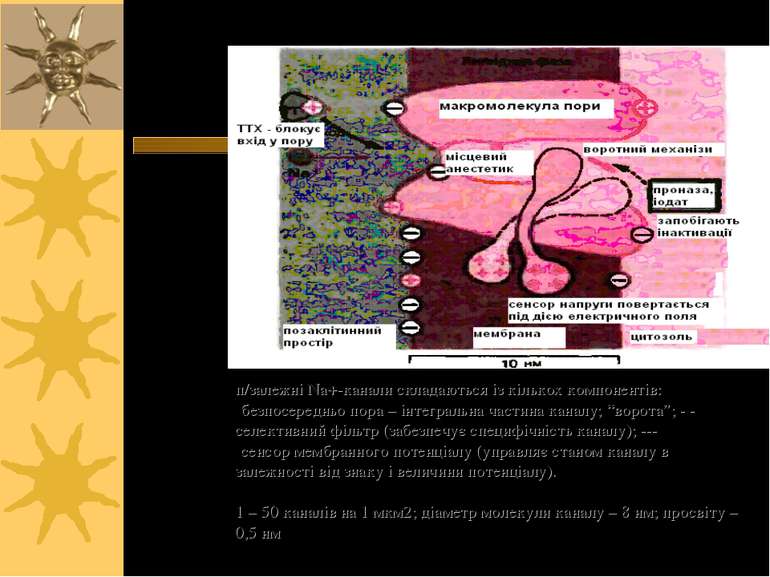
п/залежні Na+-канали складаються із кількох компонентів: безпосередньо пора – інтегральна частина каналу; “ворота”; - - селективний фільтр (забезпечує специфічність каналу); --- сенсор мембранного потенціалу (управляє станом каналу в залежності від знаку і величини потенціалу). 1 – 50 каналів на 1 мкм2; діаметр молекули каналу – 8 нм; просвіту – 0,5 нм
Блокатори Na+-каналів Тетродотоксин - міститься у яєчниках, печінці, у шкірі риб родини Tetraodontidae (“puffer fish”), в організмі деяких видів тритонів (Taricha torosa); Сакситоцин деяких синьо-зелених водоростей (зокрема, міститься у джгутикових Gonyaulax catanella): їх надлишкова концентрація можлива в устрицях, в mussels, а також за умов “цвітіння водоростей” Ці блокатори Na+-каналів можуть спричинити асфікцію внаслідок того, що блокується контроль дихання нервовою системою. За низьких доз – паралітичний ефект Рецептори до цих сполук – біля зовнішнього вустя каналу риба родини Tetraodontidae
Блокатори Na+-каналів: сакситоцин водоростей і тетродотоксин puffer fish. Високі дози можуть спричинити асфікцію Тетродотоксин виявлений в печінці й гонадах puffer fish, але не в інших частинах тіла; суші із рuffer fish вважаються японським кулінарним делікатесом Taricha torosa Gonyaulax catanella
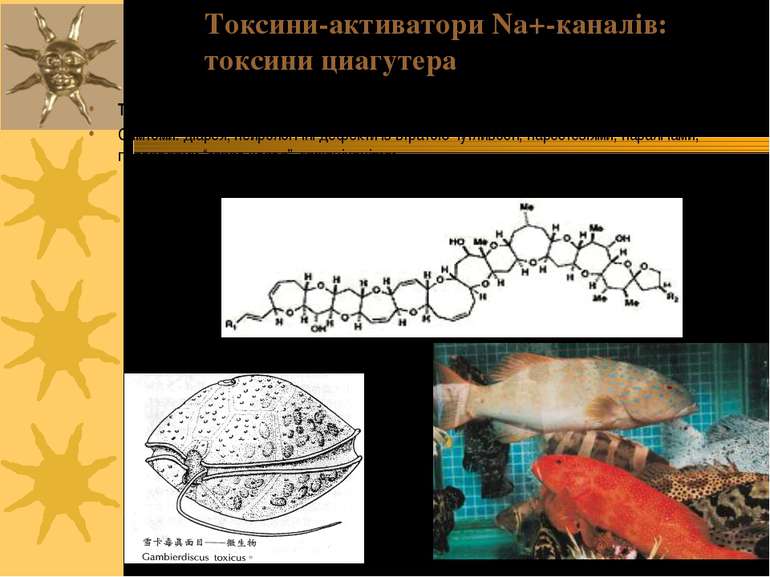
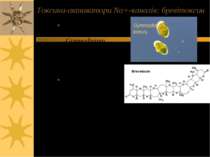
Токсини-активатори Na+-каналів (т. зв. розчинні у ліпідах активатори натрієвих каналів) Вератридин, грайанотоксин, батрахотоксин Циагутера-подібні токсини (напр., бревітоксин)
Токсини-активатори Na+-каналів: батрахотоксин Батрахотоксин – отрута секрету жаби Phyllobates aurotaenia; як і інші активатори цієї групи, зв язується з рецептором на межі між ліпідами мембрани і пептидними ланцюгами молекули натрієвого каналу Phyllobates aurotaenia
Токсини цигуатера продукуються Gamberdiscus, але акумулюються в тілі коралових риб Симтоми: діарея, нейрологічні дефекти із втратою чутливості, парестезіями, паралічами, перепадами “тепло-холод”, галюцінаціями Токсини-активатори Na+-каналів: токсини циагутера
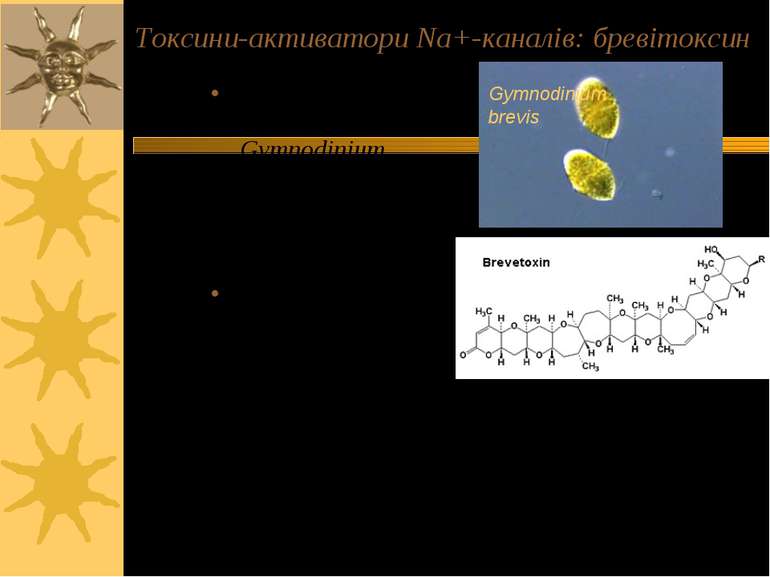
Токсини-активатори Na+-каналів: бревітоксин Продуцент: дінофлагелят Gymnodinium brevis; акумулюється в тілі коралових риб Симптоми отруєння: гастрентерологічні прояви (біль, діарея); нейрологічні прояви – як у цигуатерових токсинів Gymnodinium brevis
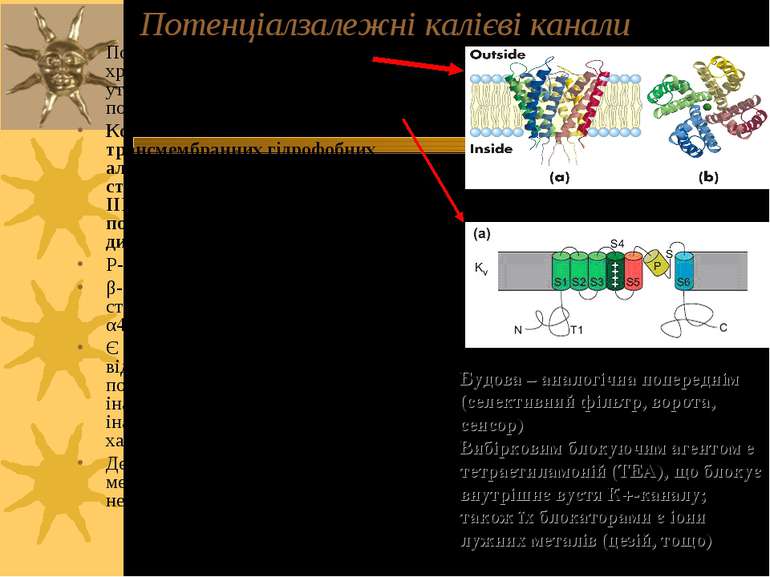
Потенціалзалежні калієві канали Потенціал-залежний K+-канал хребетних – тетрамер (4 α-с/о утворюють стінки трансмембранної пори) Кожна α-с/о має 6 трансмембранних гідрофобних альфа-спіралей S1-S6 (тобто структура всієї α-с/о подібна І, ІІ, ІІІ і ІV-доменам натрієвого потенціалзалежного каналу – дивись наступний слайд) P-ділянка - зв язує S5 і S6 сегменти. β-с/о асоціюється із α-с/о в стехіометичному співвідношенні α4β4. Ці с/о мають регуляторну роль Є кілька підвидів К+-каналів, що відрізняються за потенціалозалежністю, здатністю до інактивації, кінетикою активації й інактивації, фармакологічними характеристиками Деякі з К+-каналів регуляюються як мембранним потенціалом, так і нейромедіаторами й гормонами Будова – аналогічна попереднім (селективний фільтр, ворота, сенсор) Вибірковим блокуючим агентом е тетраетиламоній (ТЕА), що блокує внутрішнє вустя К+-каналу; також їх блокаторами є іони лужних металів (цезій, тощо)
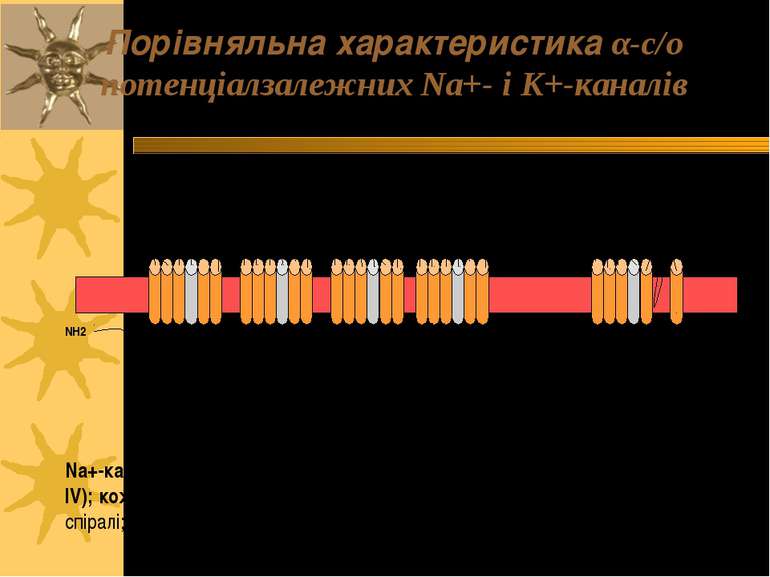
Порівняльна характеристика α-с/о потенціалзалежних Na+- і К+-каналів Na+-канал має 4 трансмембранних домени (І – ІV); кожний з них має 6 трансмембранні α-спіралі; четверта з них є сенсором напруги К+-канал: І домен, 6 трансмембранних α-спіралі COOH COOH NH2 NH2
Блокатори К+-каналів Органічні: 4-амінопіридин; фенциклідин; 9-аміноакридін, тетраетиламоній; Поліпептиди: Фалоїдин (Amanita phalloides) (1) Apamin (2) (Apis mellifera) Agitoxin-2 (отрута жовтого скорпіону Leiurus quinquestriatus herbraeus) (3) Charybdotoxin (скорпіон Leiurus quinquestriatus ) (3) маргатоксин (Centruroides margaritatus) Tityus toxin K-α (скорпіон Tityus serrulatus ) (4) Imperator toxin (скорпіон Pandinus imperator); (5) Dendrotoxin (Dendroaspis angusticeps) (6) Токсини тарантулів (токсин сенсору напруги 1, =Voltage sensor toxin 1, = VSTX1; ханатоксини 1 і 2 ) (7) 1 2 3 4 5 6 7
Са++-залежні К+-канали активуються суттєвим зростанням концентрації внутрішньоклітинного Са++. Кілька їх підтипів, що відрізняються за провідністю поодиноких каналів, іонною провідністю Можуть бути як потенціалозалежними (тобто їх воротні механізми реагують на зміну електричного потенціалу мембрани), так і потенціалонезалежними
Са++ - канали: лігандзалежні Са++-канали Важливим проміжним етапом у механізмі проникнення іонів Са++ через мембрану є їх зв язування з певною структурою Са++-каналу Двовалентні катіони стронцій і барій легко проходять через Са++-канали Інші - нікель, кобальт, кадмій, марганець - є блокаторами Са++-каналів, конкурентно зв язуючи Са++-канал 2 класи: потенціалзалежні й ліганд-залежні Ліганд-залежні канали – подібні до рецепторів, за певних умов формують канал. Мають зовнішній глікозильований домен, який сприймає ліганд (сигнал), при цьому змінюючи свою конформацію, що сприяє формуванню каналу і переносу речовин через мембрану; приклади: ріанодиновий рецептор та І3Ф-рецептор, NAADP-рецептор (їх функції і структура буде розглянута в подальших лекціях).
Са++ - канали: потенціалзалежні Са++-канали Кілька типів; відрізняються за с/о складом, провідністю, швидкістю активації та інактивації, специфічними блокаторами, локалізацією: L-тип (“Long lasting”) Ca++ каналу Блокада: чутливий до дигідропіридину, фенілалкіламінів (верапаміл), бензотіазепінів (ділтіазем) і кальцісептинів Активується за умов сильної деполяризації Інактивація: дуже слабка мають найвищу провідність; N-тип Ca++ каналу Активується за умов сильної деполяризації; Інактивація: повільна проміжні за провідністю Блокада: w-конотоксини GVIA (сильна, незворотня) & MVIIA ; нечутливий до дигідропіридину T-тип (“Transient Transient” ) Ca++ каналу: кілька підформ в залежності від локалізації – відрізняються й за ін. параметрами Активується за умов навіть дуже слабкої деполяризації (біля потенціалу спокою); Швидка інактивація та швидке відновлення каналу мають низьку провідність; Блокатори: іони Ni, пептид скорпіону Південної Африки Parabuthus transvaalicus; не блокується дигідропіридином
Са++ - канали: потенціалзалежні Са++-канали P-тип Ca++ каналу Активується за умов сильної деполяризації; Інактивація: повільна Блокада: отрута воронкових водяних павуків - funnel web spider (атратоксини; agatoxin IVA); w-конотоксин MVIIC; нечутливий до дигідропіридину і w-конотоксини GVIA Q-тип Ca++ каналу: за властивостями подібні до Р-типу Активується за умов сильної деполяризації; Інактивація: повільна Блокада: більш чутливий до w-конотоксину MVIIC, ніж Р-тип; R-тип Ca++ каналу Activation: високий поріг, сильна деполяризація Інактивація: напругозалежна; швидка Блокада: SNX-482 пептид африканського тарантула, Hysterocrates gigas воронкові водяні павуки Hysterocrates gigas
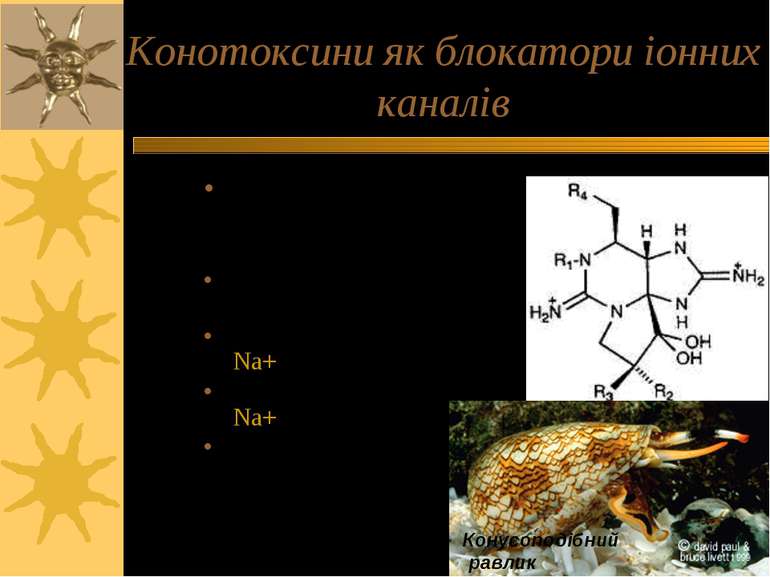
Конотоксини як блокатори іонних каналів cone snails - конусоподібні равлики Конотоксин α: блокує рецетор до АХ; Конотоксин δ: зв язує Na+ канали Конотоксин μ: зв язує Na+ канали Конотоксин w: зв язує Ca++ канали (N-, P- & Q-типів) Конусоподібний равлик
Хлорні канали Відрізняються за: Локалізацією (ПМ, везикули); Провідністю поодинокого каналу; Механізмом відкриття Молекулярною структурою Функції Забезпечують полегшену дифузію аніонів; Можуть переносити інші аніони (напр., I- або NO3-) краще, ніж Cl- ; але називаються Cl- каналами , т.я. Cl- - найчисленніший аніон в організмі Функціонують у ПМ чи у мембранах внутрішньоклінних органел Основні функції Cl- каналів у тканинах: М язи: Стабілізація потенціалу спокою; Гладенькі м язи: відкриття Cl- каналів спричиняє деполяризацію Блокатори: Chlorotoxin (скорпіон) Активність каналів м. регулювати внутрішньоклітинна концентрація Cl-
Класи Cl- каналів: Ліганд-залежні Cl- канали (зокрема, ГАМК, гліцин-залежні С1- канали постсинаптичної мембрани); в ролі ліганду можуть виступати і іони (аніони, H+ (pH), Ca++), фосфати (за умов фосфорилювання внутрішньоклітинних а/к залишків різними Пк) Cystic fibrosis transmembrane conductance regulator (CFTR) (відкриття каналу регулюється внутрішньоклітинним АТФ і фосфорилюванням ПкА чи ПкG) Потенціалзалежні С1- канали Механочутливі (залежать від об єму клітини); Ін
Найхарактерніші хвороби іонних каналів Хвороби С1- каналів: Муковісцидоз Підвищена тенденція до утворення ниркових каменів Хвороби К+-каналу: Порушення роботи серця; Підвищення тенденції до епілептичних нападів у новонароджених Хвороби Na+-каналу: Підвищення тенденції до виникнення м язових спазм; Синдром Ліддла. Неадекватний транспорт натрію із нирок внаслідок мутації каналу веде до зростання осмотичного тиску крові й результується гіпертензією
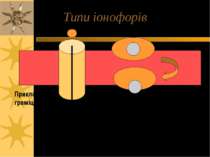
Іонофори Це бактеріальні антибіотики, що вбивають мікробні клітини внаслідок порушення процесів транспорту і іонного градієнту, результатом чого стає іонний дисбаланс в клітинах Іонофори часто використовують в експериментальних цілях, зокрема, і для дослідження механізмів транспорту іонів через них 2 типи іонофорів: пептидні іонні канали на ПМ (приклад – граміцидин) або мобільні переносники (валіноміцин)
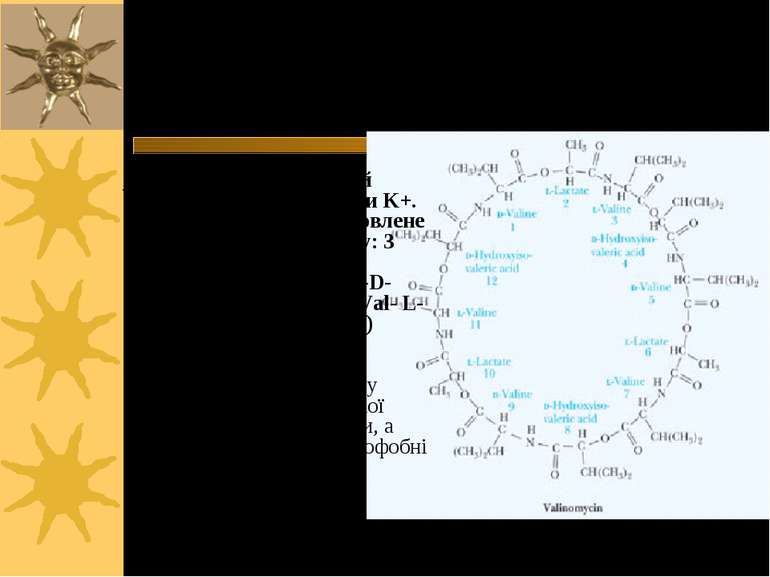
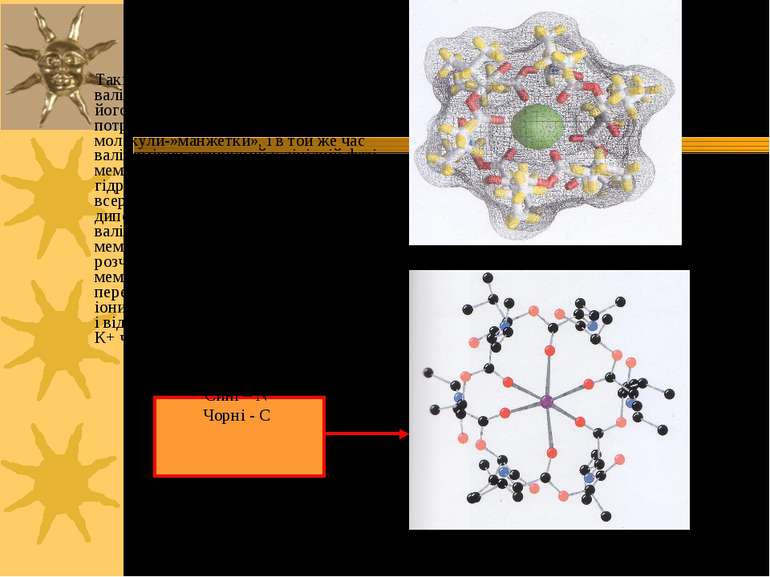
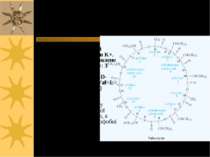
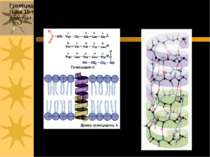
Валіноміцин – пептидне кільце, що переносить іони К+ через ПМ Валіноміцин – циклічний пептид, що зв язує іони K+. Таке зв язування зумовлене будовою валіноміцину: 3 “одиниці”, що повторюються: L-Val-D-hydroxyisovalerate-D-Val- L-Lactate (3-6; 7-10; 11-2) В ліпідній фазі молекула валіноміцину має форму манжетки, всередині якої містяться полярні групи, а ззовні - неполярні гідрофобні залишки молекули
Такі особливості хімічної будови валіноміцину дозволяють утворювати його молекулі комплекс з іонами К+, що потрапляють всередину молекули-»манжетки», і в той же час валіноміцин розчинний у ліпідній фазі мембрани, так як ззовні його молекула гідрофобна. Іони К+ утримуються всередині молекули за рахунок сил іон-дипольної взаємодії. Молекули валіноміцину, що містяться у поверхні мембрани, захоплюють із оточуючого її розчину іони К+. Дифундуючи в мембрані, молекули валіноміцину переносять К+ через мембрану і віддають іони в розчин по інший бік мембрани. Так і відбувається човниковий перенос іонів К+ через мембрану Червоні кола – О; Сині – N Чорні - С
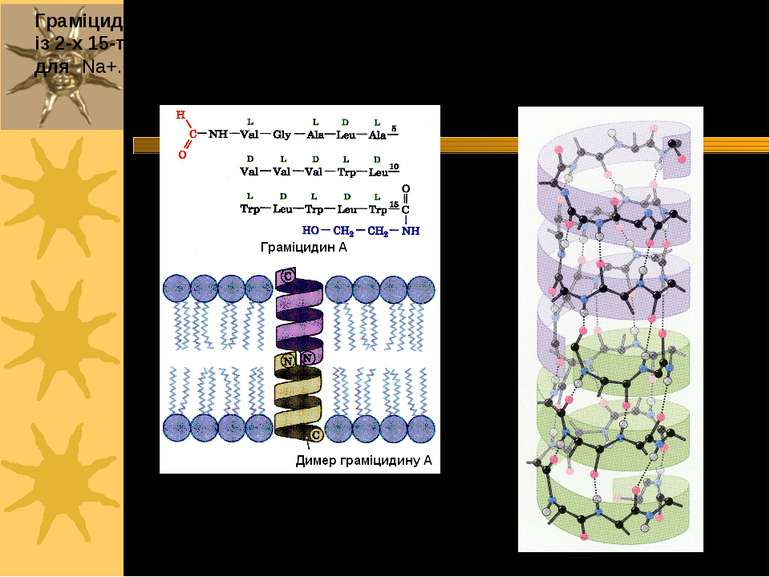
Граміцидин A (Bacillus brevis) з трансмембранним каналом, що складається із 2-х 15-ти а/кислотних спіральних структур; робить мембрану проникною для Na+. Може блокуватися Ca++.
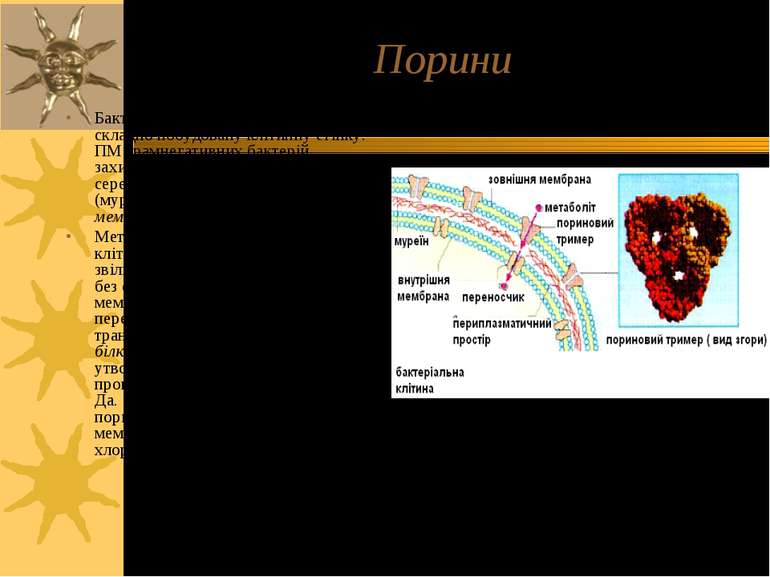
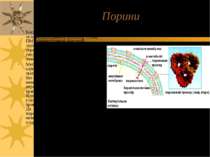
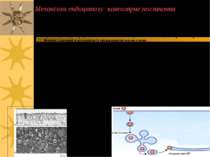
Порини Бактерії мають одну, але достатньо складно побудовану клітинну стінку. ПМ грамнегативних бактерій захищена від зовнішнього середовища сіткою пептидогліканів (муреїн) і додатковою зовнішньою мембраною. Метаболіти, що бактериальній клітині необхідно абсорбувати або звільнити, повинні мати можливість без складнощів пересікати зовнішню мембрану. Для забезпечення процесу переносу у бактерій є трансмембранні каналоутворюючі білки порини - тримеры, що утворюють пори, заповнені водою і проникні для молекул з М.м. до 600 Да. У вищих організмів пориноподібні білки виявлені в мембранах мітохондрій і хлоропластів. Структура порину зовнішньої мембрани бактерії Rhodopseudomonas blastica.
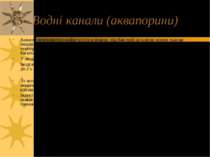
Осмозіс (= осмос) – транспорт Н2О Осмос – дифузія Н2О через ПМ із меншконцентрованого розчину у більшконцентрований (із гіпотонічного у гіпертонічний). Хоча Н2О є полярною молекулою, вона здатна проходити через ліпідний бішар ПМ. Цей процес здатні посилювати трансмембранні білки, що формують гідрофільні канали (аквапорини). За відкриття водних каналів (аквапоринів) у 2003р Peter Agre та Rod Mackinnon отримали Нобелівську Премію. Вода ніколи не транспортується активним шляхом; тобто, ніколи не рухається проти власного градієнту концентрації. Однак, концентрація води м.б. змінена під впливом активного транспорту інших іонів і молекул – це контролює рух води із і в клітину Приклад: реабсорбція Н2О в ниркових канальцях залежить від реабсорбції шляхом активного транспорту іонів Na+.
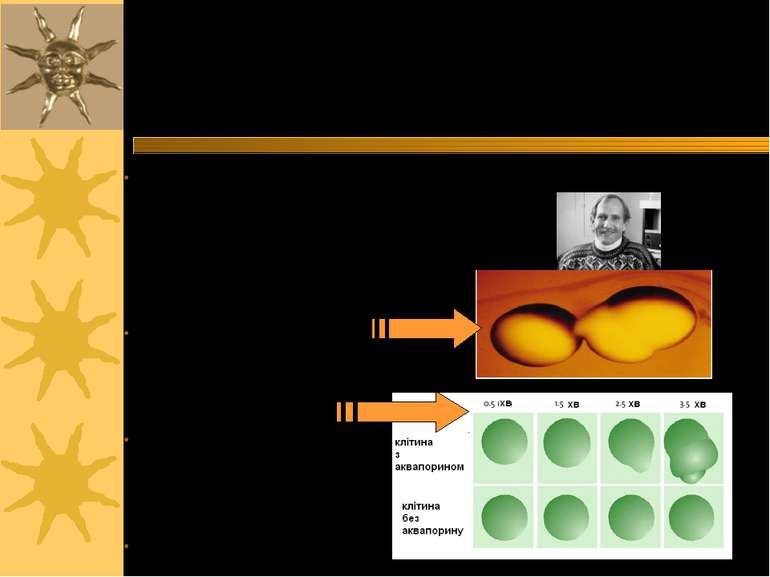
Peter Agre: відкриття аквапоринів В середині 1980-х він досліджував різні білки, виявлені в мембрані еритроцитів, і також виявив один білок, який зустрічається і в нирках – це пептид CHIP28 28kDa, визначив його амінокислотну послідовність і відповідну йому послідовність нуклеотидів у ДНК Експресія CHIP28 в ооцитах Xenopus показала, що при розміщенні таких гібридних ооцитів у гіпоосмотичному середовищі клітини швидко розбухали Ще одним доказом причетності CHIP28 до транспорту води став простий експеримент: порівняння 2-х клітин – одна з цим білком, а інша – без Подібні результати також були отримані на ліпосомах
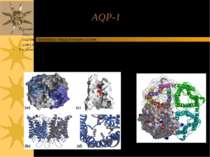
Peter Agre: відкриття аквапоринів Він назвав ці канальні білки аквапоринами – “водяними порами” Знаючи, що Hg+2 блокують рух води в клітинах, він також показав, що клітини з білком CHIP28 теж стають неактивними за дії цих іонів. Це підтвердило, що Agre відкрив дійсно водний канал In 2000 з іншими дослідниками він показав першу тривимірну структуру аквапорину (AQP-1 еритроцитів людини)
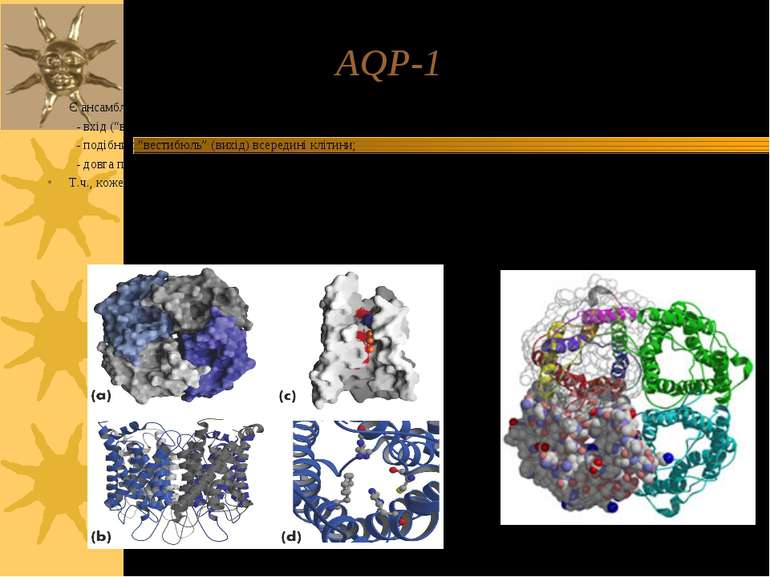
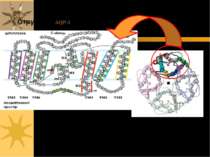
AQP-1 Є ансамблем 4-х с/о; кожна з них має 3 основні структурні ділянки: - вхід (“вестибюль”) ззовні клітини; - подібний “вестибюль” (вихід) всередині клітини; - довга пора, що їх поєднує Т.ч., кожен мономер формує канал, через який рухаються молекули води
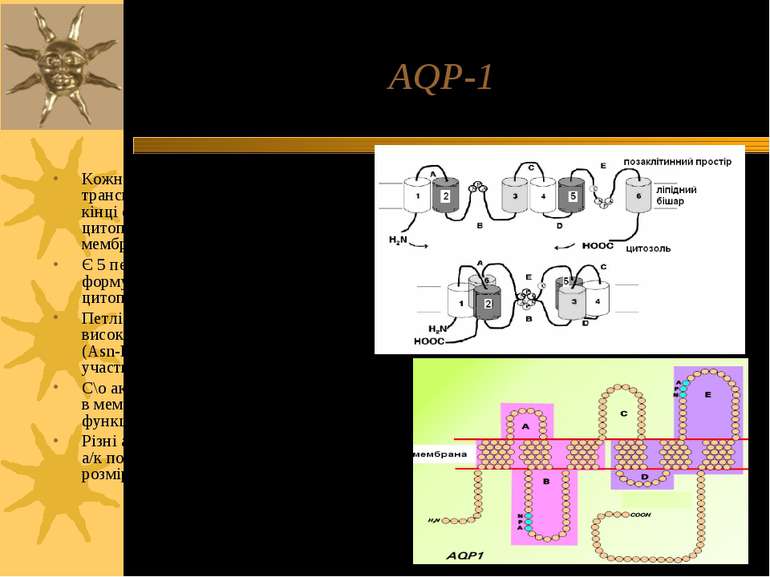
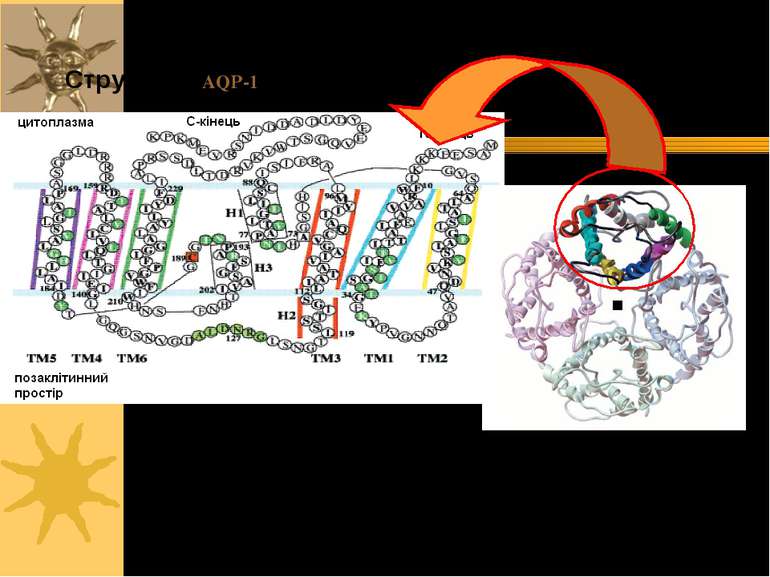
AQP-1 Кожна субодиниця аквапорину має 6 трансмембранних α-спіралей; С- і N-кінці с/о розташовані на цитоплазматичній поверхні мембрани Є 5 петлевих ділянок (A – E), які формують позаклітинний і цитоплазматичний вестибюлі Петлі B і E є гідрофобними і містять висококонсервативний Асн-Про-Ала (Asn-Pro-Ala, =NPA)-мотиф, що бере участь в утворенні пори. С\о аквапоирнів формують тетрамери в мембрані; кожний мономер функціонує як водний канал Різні аквапорини мають відміни в їх а/к послідовності, що впливає на розміри пори
Водні канали (аквапорини) Аквапорини виявлені майже в усіх клітинах, від бактерій до клітин різних тканин людини. Від функціонування аквапоринів залежать такі процеси, як підримка температури тіла, дозрівання, внутрішньоочний тиск, реабсорбція води у нирках і багато-багато інших. У людини - 10 різних генів аквапоринів, у Arabidopsis thaliana - 38. Іноді вміст молекул аквапоринів в ПМ може досягати дуже великого значення – (напр., до 2 x 105 на 1 еритроцит) Їх активність зростає внаслідок індукованого руху латентних неактивних молекул аквапорину (асоційованих з внутрішніми цитоплазматичними везикулами) до мембран клітин, де вони стають інтегральними білками з функціями активних водних каналів Індукторами можуть бути різні чинники, напр., в кінцевих відділах дистальних звивистих канальців нефрону й у збірних трубках таку роль відіграє антидіуретичний гормон
Аквапорини і захворювання 2 найяскравіших приклади захворювань через мутації аквапоринів: AQP-2 - вроджений нефрогенний нецукровий діабет людини Зрідка зустрічається тотальний дефіцит AQP-1 – такі люди зовні здорові, але мають дефект щодо здатності нирок концентрувати сечу і зберігати воду в умовах недостатності питної води. Набутий нецукровий нефрогенний діабет: причина – зниження регуляції AQP-2 внаслідок, зокрема, впливу солей літію (при лікуванні маніакально-депресивного синдрому, = “біполярне зрушення”), гіпокаліємії, гіперкальціємії, за умов хронічного надмірного вживання води при нормальній потребі в ній Аутоімунна реакція проти AQP-4 – хвороба Девіка (Devic's disease)
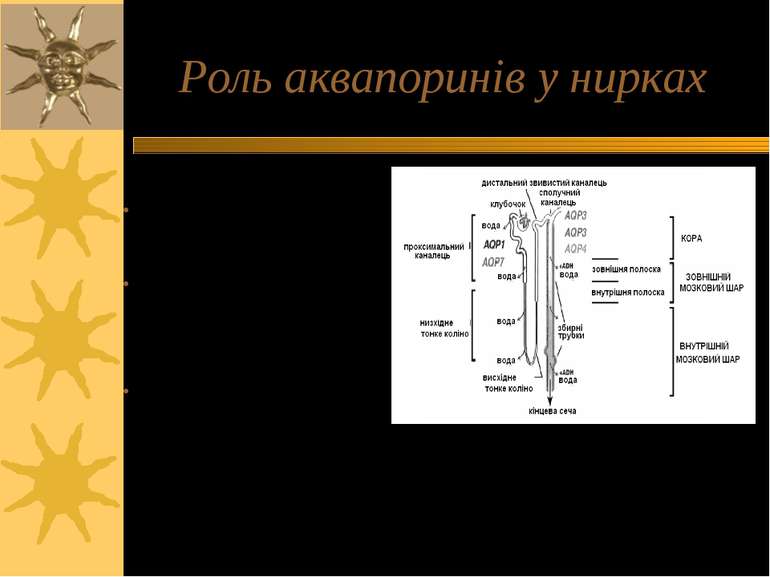
Роль аквапоринів у нирках 170 л первинної сечі продукується за добу; екскретується – лише біля 1 л Причини – механізми у нирках: - 70% води реабсорбується через AQP1 в кров 10% - через AQP2 Дефіцит антидіуретичного гормону – вазопресину – може спричинити нецукровий діабет; при цьому екскреція сечі зростає до 10 – 15 л за день
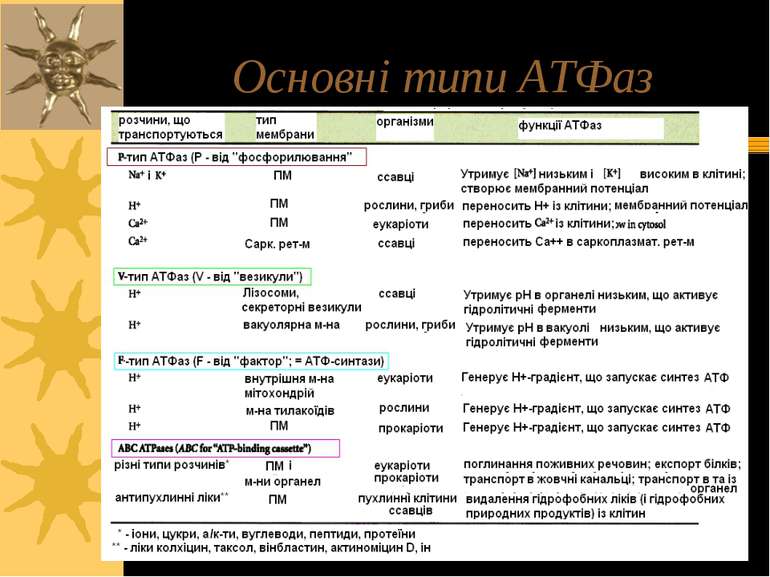
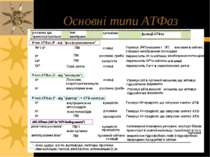
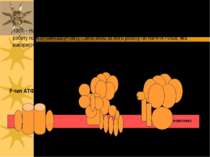
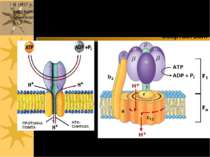
Первинноактивний транспорт Джерело енергії для первинноактивного транспорту – АТФ; всі іонні насоси одночасно є ферментами, що гідролізують АТФ – АТФазами Є АТФази 3-х типів: - Р-тип – в ході функціонування термінальний фосфат АТФ переноситься на карбоксил Асп активного центру з утворенням швидкоперетворюючогося фосфоферменту ЕР; ванадат-іон є специфічним і високоефективним зв язувачем цієї ділянки АТФази, тобто її інгібітором; до цього типу належать, зокрема, Na+, К+-АТФаза, Н+-АТФаза і Са++-АТФаза. Na+, К+-АТФаза також інгібується серцевим глікозидом уабаїном, строфантином К, Н+-АТФаза – дициклогексилкарбодиімідом, Са++-АТФаза – тіоловими отрутами Na+, К+-АТФаза є тетрамером α2β2; велика α-субодиниця відповідає за гідроліз АТФ, а також містить ділянку зв язування кардіотонічних стероїдних інгібіторів уабаїну й дигітоксину та ін; β-субодиниця містить вуглеводні групи (схема на наступному слайді) - V-тип – погано вивчені переносники протонів, для яких не характерне утворення комплексу ЕР, містяться у вакуолях дріжджів, лізосомах, ендосомах, секреторних гранулах, тощо. Інгібуються низкою специфічних сполук, але не інгібуються ні ванадатом, ні олігоміцином - F-тип – мають складну олігомерну будову. Зокрема, Н+-АТФаза (=АТФ-синтетаза) склдається із 10-ти субодиниць, що формують F1-частину (“шапинка гриба”, здійснює фосфорилювання АДФ до АТФ) і F0-частину (гідрофобний білок, що виконує функцію каналу, через який Н+ надходять до F1 – ця частина фіксується у мембрані і пронизує її наскрізь) ( F0 – від “олігоміцин”, F1 - ...)
P-, V- і F-типи АТФаз. α α β β P-тип ATФaз V-тип ATФаз F-тип ATФаз F1 комплекс F0 комплекс V1 комплекс V0 комплекс 1997 – Нобелівська Премія по фізіології і медицині (Paul Boyer і John Walker за їх роботу по ATP-синтазі (F-тип), і Jens Skou за його роботу по Na-K-ATФазі, яка використовує 1/3 всієї кількості ATФ, яка виробляється ATФ-синтазою. ATФ- синтаза Протонна помпа
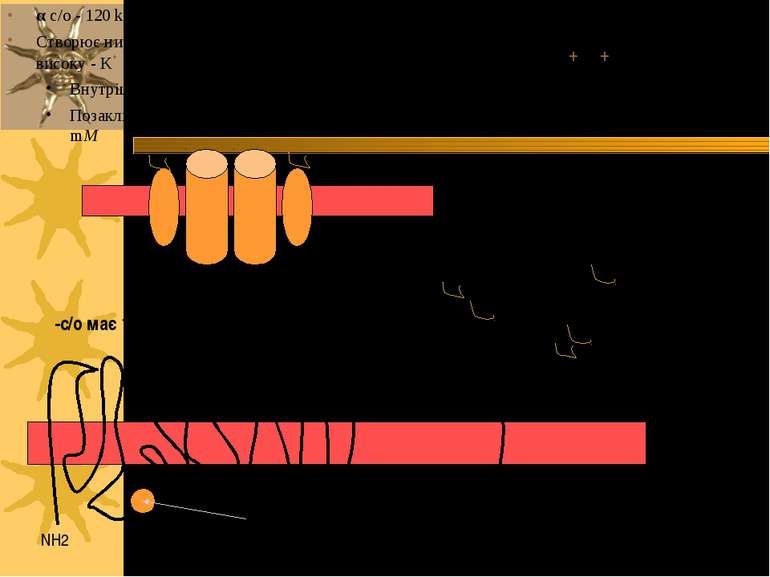
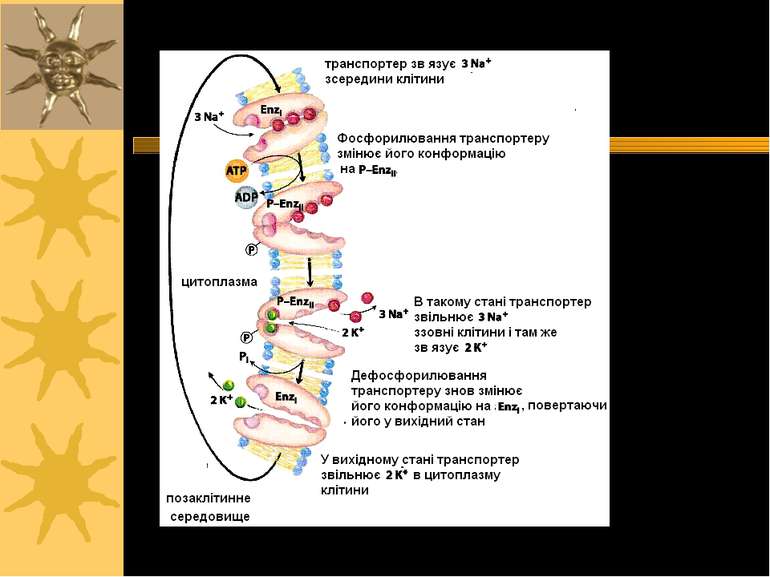
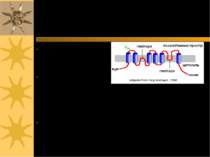
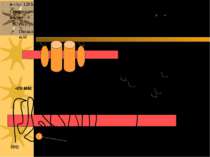
Структура Na+/K+ATФази: 2α і 2β с/о олігосахаридніланцюги Сайт фосфорилювання COOH COOH NH2 NH2 α α α-с/о має 12 трансмембранних доменів β β β-с/о глікозильована, має 1 трансмембранний домен α с/о - 120 kД; β с/о - 35 kД Створює низьку внутрішньоклітинну концентрацію Na+ і високу - K+ Внутрішньоклітинна: [Na+] = 10 mM, [K+] = 100 mM Позаклітинний простір: [Na+] = 100-140 mM, [K+] = 5-10 mM
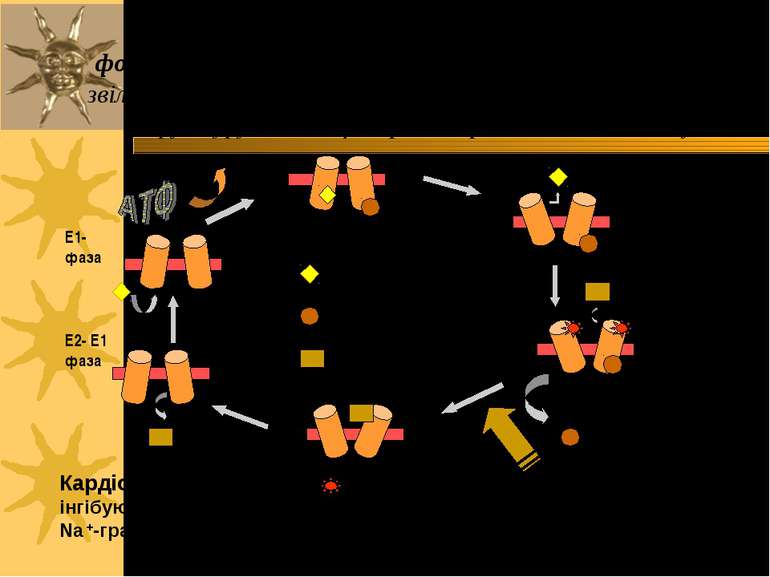
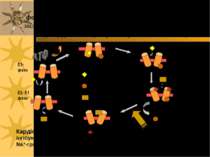
Ферментативний цикл Na+-K+-ATФази: фосфорилювання змінює конформацію α-с/о – при цьому звільнюються 3 Na+ із клітини; дефосфорилювання змінює структуру α-с/о – це сприяє перенос 2 K+ в клітину. Кардіотонічні стероїди ( напр., дігіталіс із наперстянки і уабаїн) інгібують E2-Ф фазу (дефосфорилювання) Na+/K+-ATФази і знижують Na +-градієнт в клітинах серцевого м язу. Фосфат 3 Na+ 2 K+ AДФ E1-Ф фаза E1- фаза E1-Ф фаза E2-Ф фаза E2- фаза E2- E1 фаза
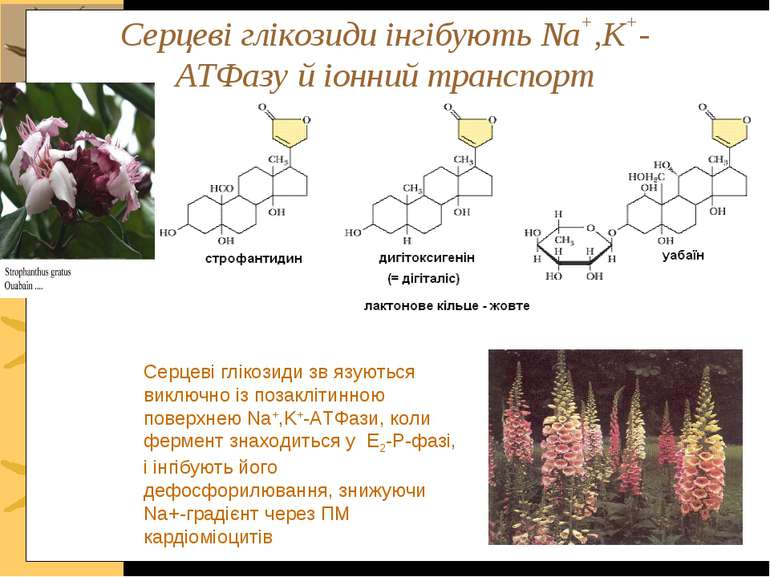
Серцеві глікозиди інгібують Na+,K+-ATФазу й іонний транспорт Серцеві глікозиди зв язуються виключно із позаклітинною поверхнею Na+,K+-ATФази, коли фермент знаходиться у E2-P-фазі, і інгібують його дефосфорилювання, знижуючи Na+-градієнт через ПМ кардіоміоцитів
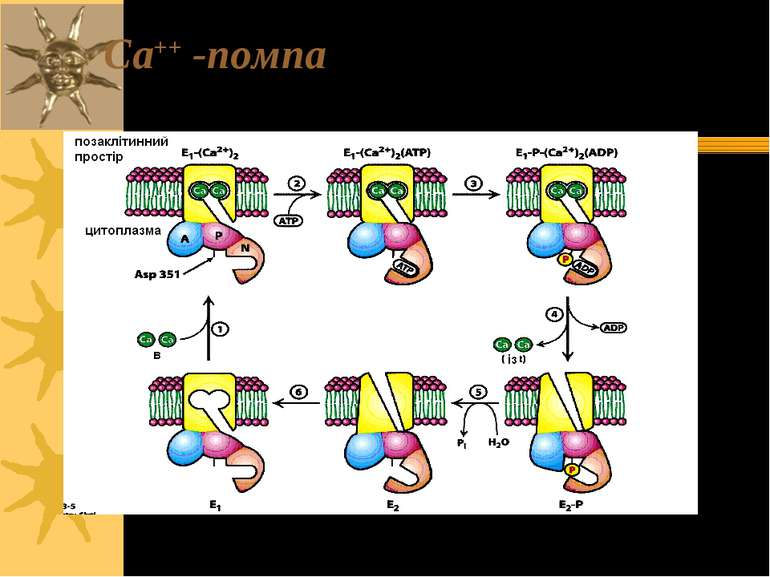
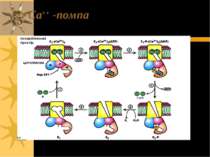
Транспорт Са++: Ca2+-ATФаза Ca++-ATФаза локалізована у ПМ та ЕР (або СР). ЇЇ функція – підтримання цитозольної концентрації Са++ на низькому рівні шляхом транспорту іонів Са++ або у позаклітинне середовище (Са++-АТФаза ПМ), або у внутрішньоклітинне депо (Са++-АТФаза СР і ЕПР): - [Са++] в клітині в стані спокою ~0.1 M (= 10-7 M); - позаклітинна концентрація Са++ - 10-3M Ca2+-ATФаза ПМ є у всіх клітинах еукаріот; енергія гідролізу 1 молекули АТФ використовується на транспорт 1 іону Са++ із клітини. Саме завдяки Са++-АТФазі ПМ зупиняється сигнал, опосередкований дією Са++ як вторинного месенджера Рівні Са++ у цитоплазмі м язових клітин у спокої підтримуються на низькому рівні завдяки дії Ca2+-ATФази СР. Нервовий імпульс спричиняє звільнення Са++ із СР в цитоплазму через Са++-звільнюючі канали (полегшена дифузія); [Ca2+] в цитозолі при цьому зростає до 10 M, що і спричиняє скорочення м язів. Після скорочення Са++ “заганяється” у СР 110 kD-білком, який дуже подібний до α-с/о Na+,K+-ATФази - іншою Са++-АТФазою, яка енергію гідролізу 1 молекули АТФ використовує на транспорт 2 іонів Са++ Механізм: внаслідок фосфорилювання Asp-351 утворюється E-P-інтермедіат; функціонування Ca2+-помпи також підлягає під E1-E2 модель
Ca2+ATФаза Інші транспортери бівалентних катіонів мають структуру, подібну до цієї Ca2+-ATФази й α-с/о Na+-K+-ATФази NH2 COOH Ca2+-зв язуючий сайт Аспартат АТФ-зв язуючий сайт ATФ AДФ Ca2+
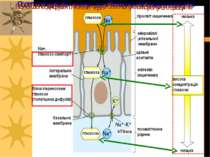
Шлункова H+,K+-ATФаза Фермент, що підтримує pH шлунку в межах 0.8 – 1 Парієтальні клітини слизової оболонки шлунку мають цитозольне рН 7.4 H+,K+-ATФаза “виганяє” протони із цих клітин в шлунок, створюючи градієнт рН на їх ПМ в 6,6 – найбільший трансмембранний градієнт рН в клітинах еукаріот!
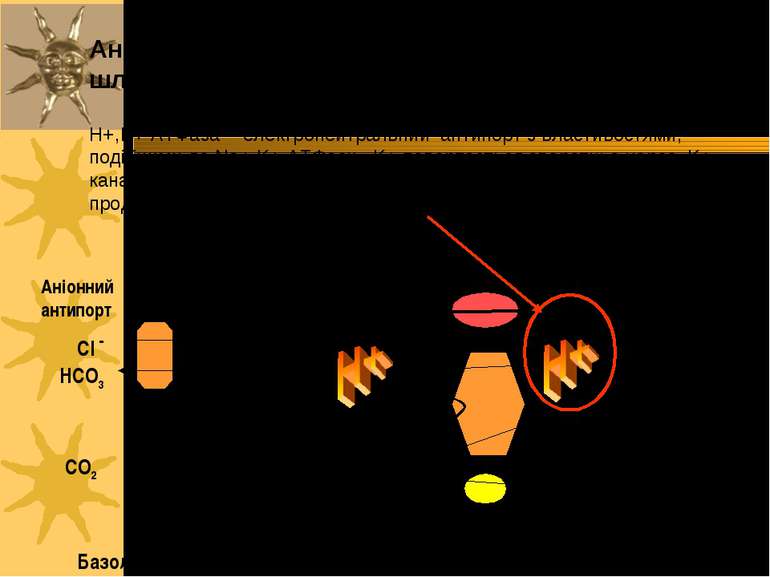
Аніонний антипорт в парієтальних клітинах шлунку та H+- K+ -ATФаза продукують НС1. Базолатеральна мембрана Апікальна мембрана CO2 CO2 HCO3 Карбо-ангідраза Cl - Cl - Cl - HCO3 K+ K+ K+-канал Аніонний антипорт Cl -канал H+-K+-ATФаза ATФ AДФ + Фн K+ H2O + OH - H+,K+-ATФаза - електронейтральний антипорт з властивостями, подібними до Na+,K+-ATФази. K+ повертається зворотньо через K+-канал; С1- канал в тому ж напрямку переносить іони С1-. Т.ч., загальним продуктом цього транспорту стає НС1 у просвіті шлунку
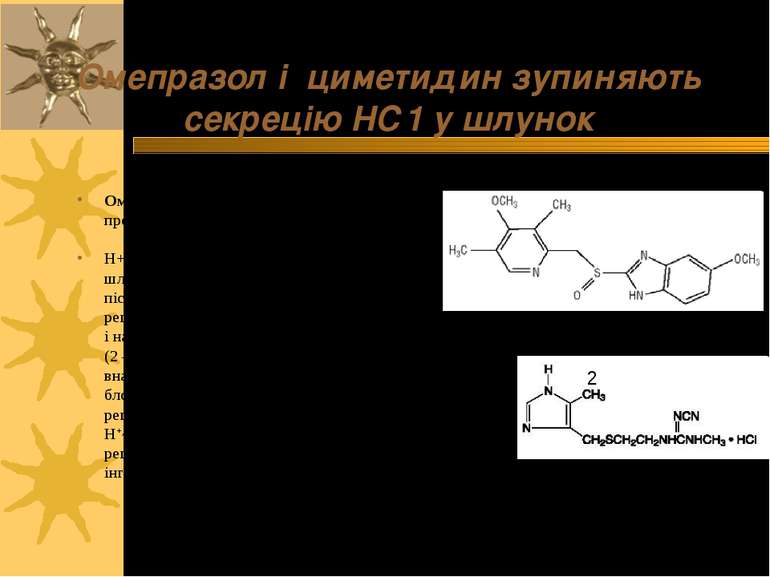
Омепразол і циметидин зупиняють секрецію НС1 у шлунок Омепразол (1) безпосередньо інгібує протонну помпу H+ -K+-ATфаза слизової оболонки шлунку активується гістаміном, який після зв язування із своїми рецепторами стимулює синтез цАМФ і надалі - продукцію НС1. Циметидин (2 – циметидину гідрохлорид) внаслідок своєї подібності до гістаміну блокує зв язування гістаміну з його рецепторами, т.ч. інгібуючи активацію H+,K+-ATФази гістаміновим рецептором, тобто здійснює непряму інгібіцію Н+, К+-АТФази 1 2
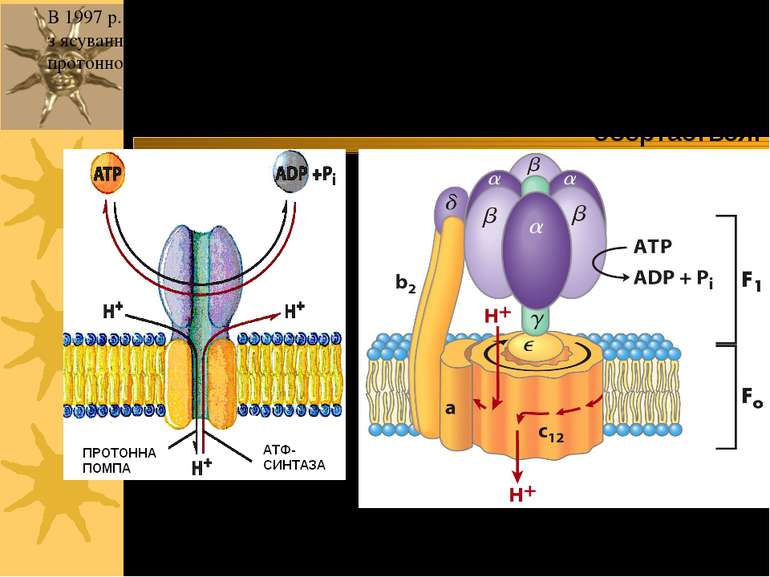
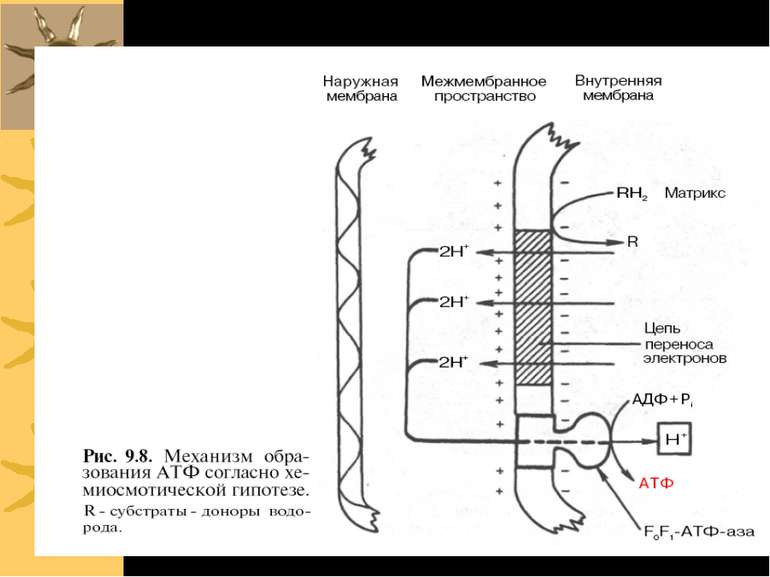
F-тип ATФаз: FoF1 ATФаза/ATФ синтаза Протонні помпи (Н+-АТФази). Протони рухаються проти концентраційного градієнту, використовуючи для транспорту енергію, що звільнюється при гідролізі АТФ Складаються із 2-х умовних частин: Fo (“o” - oligomycin sensitivity) і F1 Працюючи в зворотньому напрямку, синтезують ATФ! З цією властивістю Н+-АТФази пов язані мітохондріальне окисне фосфорилювання й фотофосфорилювання у хлоропластах рослин – процеси, в результаті яких за рахунок транспорту протонів за градієнтом концентрації Н+-АТФаза/АТФ-синтаза синтезує АТФ. Протонний градієнт створюється іншими процесами ( поглинання світла, катаболізм вуглеводів й жирів)
F1 дійсно обертається! В 1997 р. П. Бойєр й Дж. Уокер були нагороджені Нобелівською премією за з ясування молекулярних механізмів дії головного ферменту біоенергетики - протонної АТФ-синтази
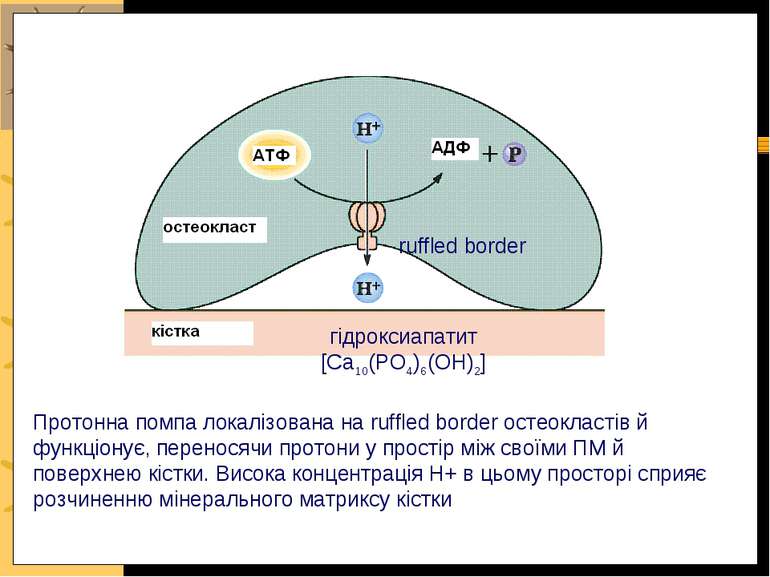
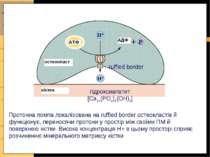
Протонна помпа остеокластів Кісткова тканина підлягає постійному ремоделюванню: остеокласти “вимивають” кісткову тканину остеобласти – добудовують її Остеокласти функціонують, секретуючи кислоту в простір між мембранами остеокластів та поверхнею кістки; кислота розчиняє Ca++-фосфатний матрикс кістки АТФ-залежна протонна помпа мембрани остеокластів залучена в цей процес!
Протонна помпа локалізована на ruffled border остеокластів й функціонує, переносячи протони у простір між своїми ПМ й поверхнею кістки. Висока концентрація Н+ в цьому просторі сприяє розчиненню мінерального матриксу кістки гідроксиапатит [Ca10(PO4)6(OH)2] ruffled border
V-тип ATФаз Структурно подібні до F-типу V - від “вакуолярна” Значення pH в численних внутрішньоклітинних органелах - 3 - 6 (цитозоль ~7.5)
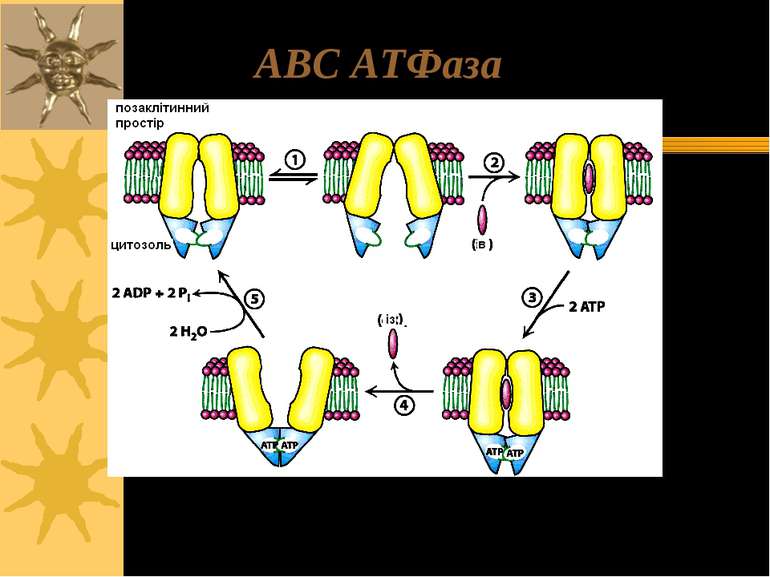
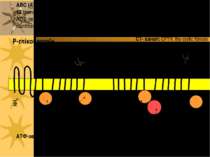
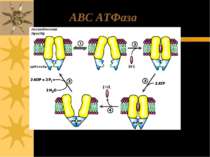
АВС-транспортери ATP-binding cassette transporters (ABC-транспортери) – члени однієї з найбільших суперродин транспортних білків, яка представлена в різноманітних організмах – від прокаріот до людини Ці транмембранні білки функціонують, використовуючи енергію гідролізу АТФ на перенос через плазматичні й внутрішньоклітинні мембрани широкого кола субстратів, включаючи продукти метаболізму (амінокислоти, цукри, неорганічні іони, пептиди), ліпіди й стероїди, лікарські речовини, у т.ч. цитотоксичні антипухлинні агенти; до АВС-транспортерів також належить фліппаза, що здійснює транспорт ліпідів між моношарами мембран АВС-транспортери містять 2 трансмембранних домени, кожен з яких складається із 6 – 12 (частіше 6-ти) α-спіралей. Всі АВС-транспортери мають 2 висококонсервативні АТФ-зв язуючі домени (= nucleotide-binding folds (NBFs))
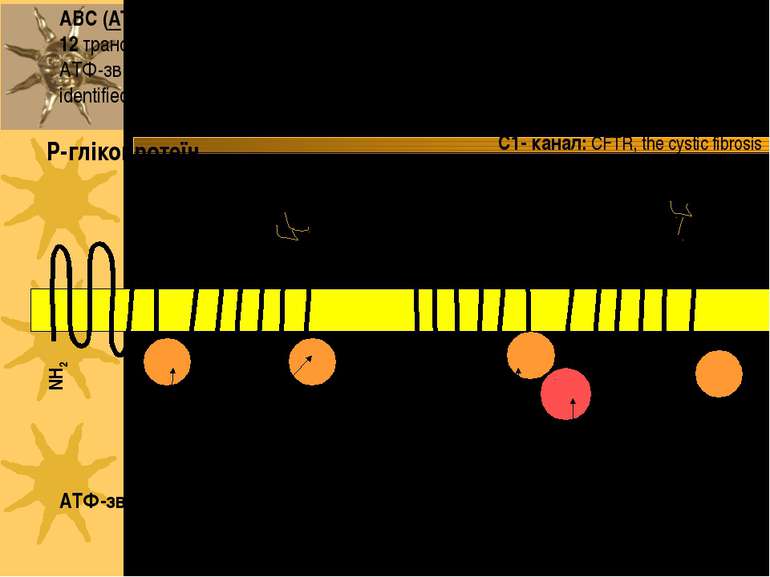
ABC (ATP-Binding Cassette) транспортери: 2 домени; кожен з них має 6 або 12 трансмембранних спіралей з 1 АТФ-зв язуючим сайтом (на всю молекулу – 2 АТФ-зв язуючих сайти), ліки- або ліганд- зв язуючі сайти yet to be clearly identified. ATФ-зв язуючі сайти NH2 COOH Олігосахаридні ланцюги P-глікопротеїн R домен NH2 ATФ-зв язуючі сайти COOH С1- канал: CFTR, the cystic fibrosis transmembrane conductance regulator, ще має регуляторний R-домен
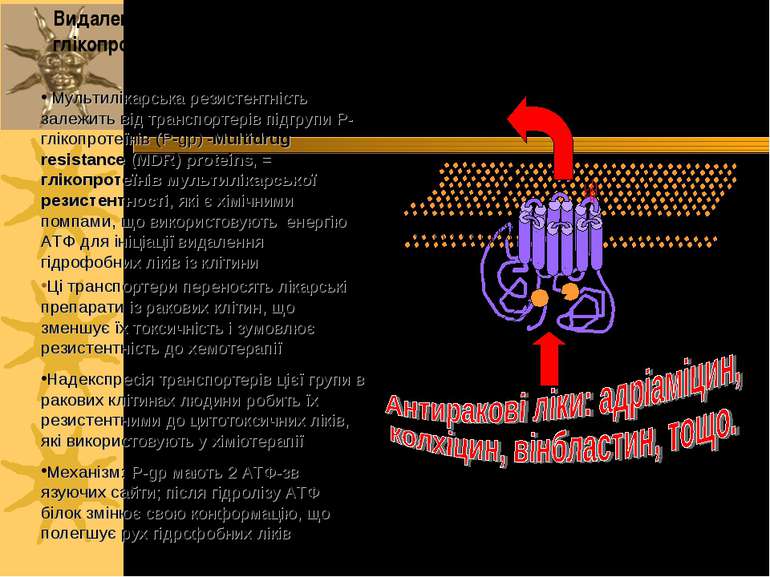
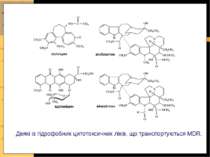
Найважливіші групи АВС-транспортерів 1) підгрупа Р-глікопротеїнів (Pgps - P-glycoproteins): - експортний насос жовчних кислот (BSEP - bile salts export pomp) - Р-глікопротеїни мультилікарської резистентності (MDR - multidrug resistance): MDR-3 (Р-глікопротеїн людини) і Mdr2 (Р-глікопротеїн гризунів) - АТФ-залежна фліппаза фосфатидилхоліну; MDR-1 - опосередковує каналікулярну екскрецію великої кількості ліпофільних катіонів (у т.ч. протипухлинних препаратів, блокаторів Са-каналів, циклоспорину А, стероїдних гормонів, гідрофобних пептидів, гліколіпідів) 2) підгрупа білків мультилікарської резистентності (МRP - multidrug resistance proteins): МRP2 - відповідає за транспорт у канальці амфіпатичних аніонних субстратів ( зокрема, лейкотрієну С4, кон югатів глутатіону, глюкуронідів, сульфатів) і частково відповідає за секрецію жовчі, незалежну від ЖК 3) CRTF (cystic fibrosis transmembrane conductance regulator) АВС-транспортери причетні до розвитку мультилікарської резистентності пухлин та бактеріальних інфекцій, cystic fibrosis
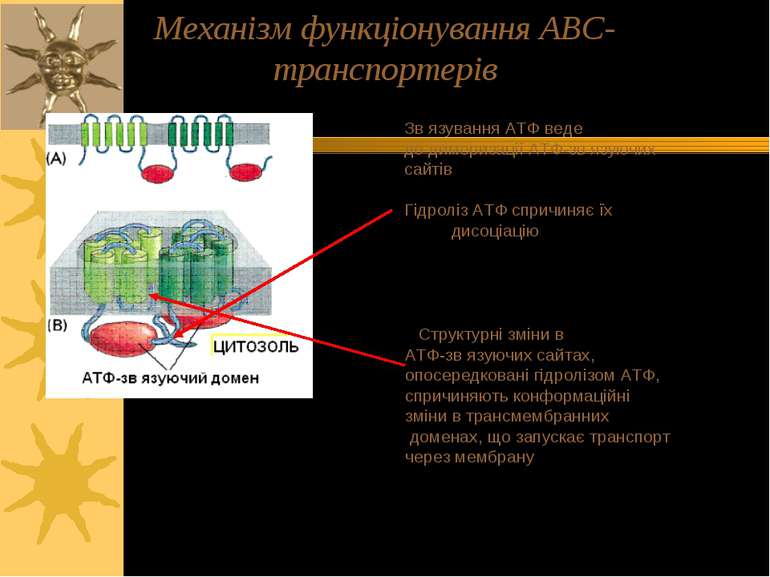
Зв язування АТФ веде до димеризації АТФ-зв язуючих сайтів Гідроліз АТФ спричиняє їх дисоціацію Структурні зміни в АТФ-зв язуючих сайтах, опосередковані гідролізом АТФ, спричиняють конформаційні зміни в трансмембранних доменах, що запускає транспорт через мембрану Механізм функціонування АВС-транспортерів
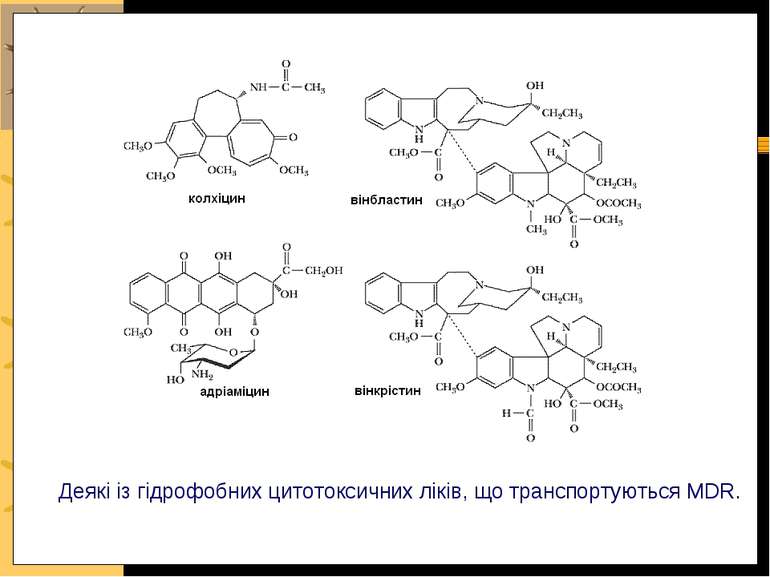
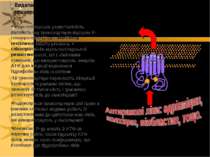
Мультилікарська резистентність залежить від транспортерів підгрупи P-глікопротеїнів (P-gp) -Multidrug resistance (MDR) proteins, = глікопротеїнів мультилікарської резистентності, які є хімічними помпами, що використовують енергію АТФ для ініціації видалення гідрофобних ліків із клітини Ці транспортери переносять лікарські препарати із ракових клітин, що зменшує їх токсичність і зумовлює резистентність до хемотерапії Надекспресія транспортерів цієї групи в ракових клітинах людини робить їх резистентними до цитотоксичних ліків, які використовують у хіміотерапії Механізм: P-gp мають 2 АТФ-зв язуючих сайти; після гідролізу АТФ білок змінює свою конформацію, що полегшує рух гідрофобних ліків ATP зв язуючі сайти N C Видалення антиракових ліків P-gp з використанням енергії ATФ: глікопротеїни мультилікарської резистентності
Cystic Fibrosis – кістозний фіброз, = фіброзно-кістозна дегенерація, = муковісцидоз CF спричиняє продукцію організмом надмірно в язкого і густого слизу на поверхнях епітелію Цей генетичний дефект виявляють приблизно у 30,000 дітей і дорослих в США. Це – одне із найбільш летальних спадкових захворювань серед мешканців Кавказу (1/1000). На 1997: середня тривалість життя чоловіків із CF - 32.7 років, жінок - 28.9 років 1 із 31 американців (1 із 28 мешканців Кавказу) - понад 10 млн людей – є безсимптомними гетерозиготами-носіями дефектного гену симптоми Зниження очищення війчастого епітелію від мокроти веде до хронічної ендобронхіальної бактеріальної колонізації. Наслідки: Надпродукція мокроти Важке дихання Диспное (одишка) Обмеженість перенесення фізичних навантажень Загибель Панкреатична недостатність у 85% пацієнтів, що спричиняє погану абсорбцію жирів і розлади у травленні. Також цекроий діабет, кишкова непрохідність, артрити, безпліддя.
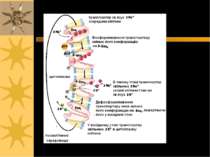
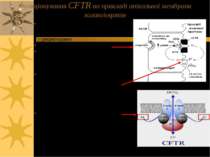
Причиною CF є генетичні дефекти CFTR. Хоча CFTR є членом суперродини ABC-транспортних білків, він не здійснює активного транспорту. Це С1- канал, через який здійснюється полегшена дифузія і який активується фосфорилюванням При CF загибель клітин епітелію легень здійснюється внаслідок втрати іонного балансу, що спричиняє зниження функцій клітин із слизовою обструкцією, зокрема, порушення обміну газів і т.ч. летальність у молодому віці G А/циклаза ATФ ATФ цАМФ AДФ Агоніст Мембранний рецептор ПкAa ПкAн CFTR - Cl- канал, що є ATФ- і цAMФ-залежним Cl- каналом мембран епітеліальних клітин CFTR і Cystic Fibrosis
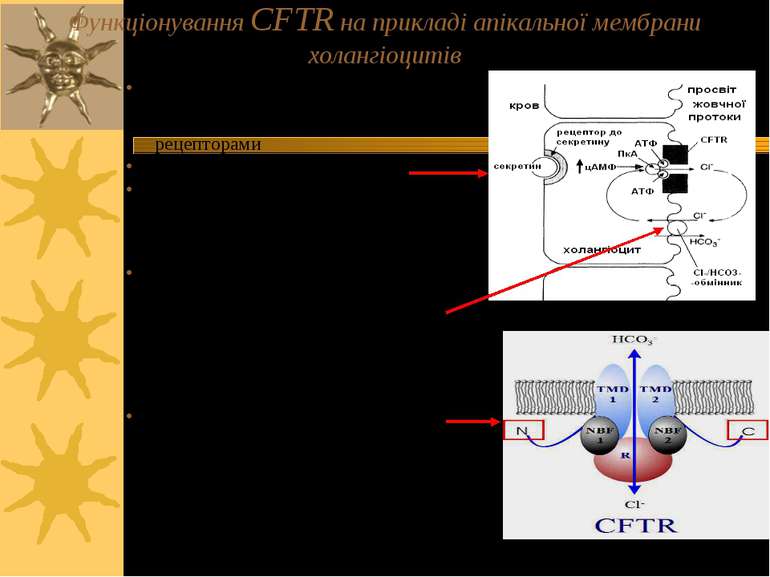
Функціонування CFTR на прикладі апікальної мембрани холангіоцитів Секретин (агоніст в цьому випадку – див. попередній слайд) взаємодіє із своїми базо-латеральними рецепторами Зростає синтез цАМФ цАМФ із залученням ПкА фосфорилює і активує CFTR, який функціонує як С1-канал С1-канал CFTR повертає С1- із холангіоцитів, куди надійшли іони С1- внаслідок функціонування С1-/НСО3- -обмінника, у простір протоки CFTR – член родини АТФ-зв язуючих касетних білків – має 2 АТФ-зв язуючих центри; саме зв язування АТФ регулює відкриття С1-каналу
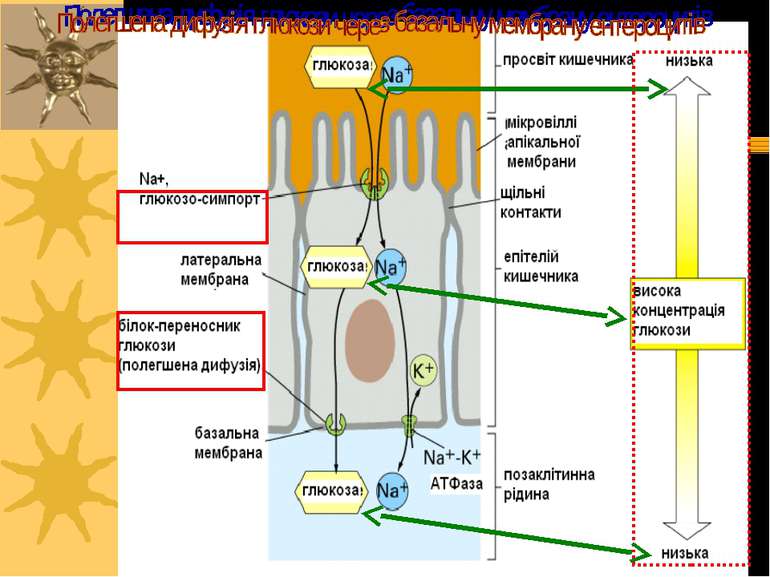
Вторинноактивний транспорт Це активні транспортні процеси, які безпосередньо не зв язані із гідролізом АТФ, а спряжені з потоком іонів по електрохімічному градієнту Зокрема, електрохімічний градієнт іонів Na+, що забезпечується функціонуванням Na+, К+-АТФази, забезпечує енергією транспорт амінокислот і цукрів у клітинах тварин. При цьому, напр., захоплення глюкози цими клітинами забезпечується одночасним входом натрію, іони натрію і глюкози зв язуються із специфічним білком-переносником і проникають у клітину одночасно Приклади – реабсорбція амінокислот і глюкози в проксимальних звивистих канальцях нефрону, Na+,таурохолат-котранспортер базолатеральної мембрани гепатоцитів, транспорт цукрів у мікроворсинках щітинкової облямівки ентероцитів кишечника Іони Na+, що входять у клітину разом із транспортуємою сполукою, виводяться із клітини за участю Na+, К+-АТФази
Первинний і вторинноактивний транспортери працюють зкоординовано в тваринних клітинах. Вони генерують мембранний потенціал, генерують протонний градієнт, визначають кислотність, тощо... K+ K+ Na+ Na+ Na+ Na+-залежний симпорт КР Na+ Котранспортуєма речовина (КР) Na+,K+ ATФаза ATФ AДФ+ Фн ATФ H+ H+ H+-ATФаза K+ = 140 mM Na+ = 12 mM K+ = 4 mM Na+ = 145 mM ---- ++++ AДФ + Фн Системи котранспорту
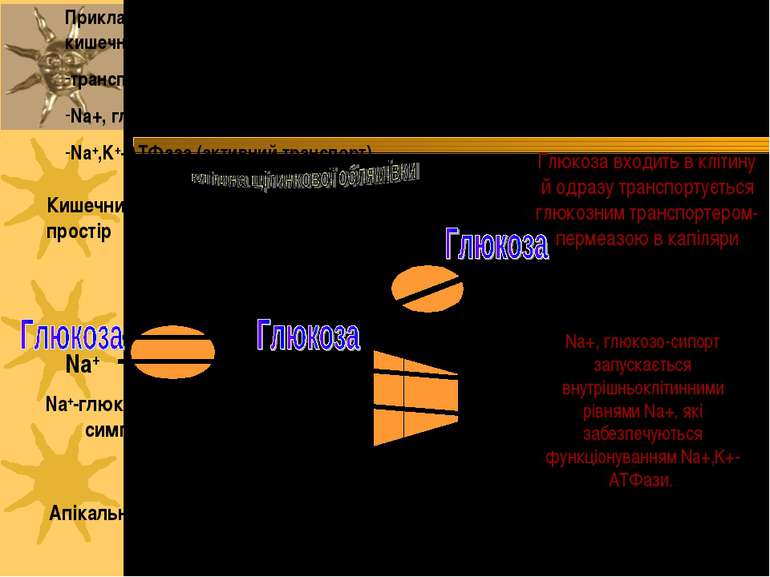
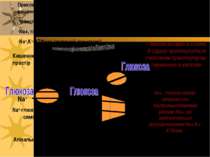
Приклад вторинноактивного транспорту: поглинання глюкози із просвіту кишечника в капіляри використовує: транспортер для глюкози (пермеаза; полегшена дифузія); Na+, глюкоза-симпорт (вторинноактивний транспорт); Na+,K+-ATФаза (активний транспорт). Глюкоза входить в клітину й одразу транспортується глюкозним транспортером-пермеазою в капіляри . Na+ Na+ Na+ K+ K+ Na+-глюкоза- симпорт ATФ AДФ + Фн Na+,K+-ATФаза Пермеаза Кишечний простір капіляри Na+, глюкозо-сипорт запускається внутрішньоклітинними рівнями Na+, які забезпечуються функціонуванням Na+,K+-ATФази. Апікальна мембрана Базальна мембрана
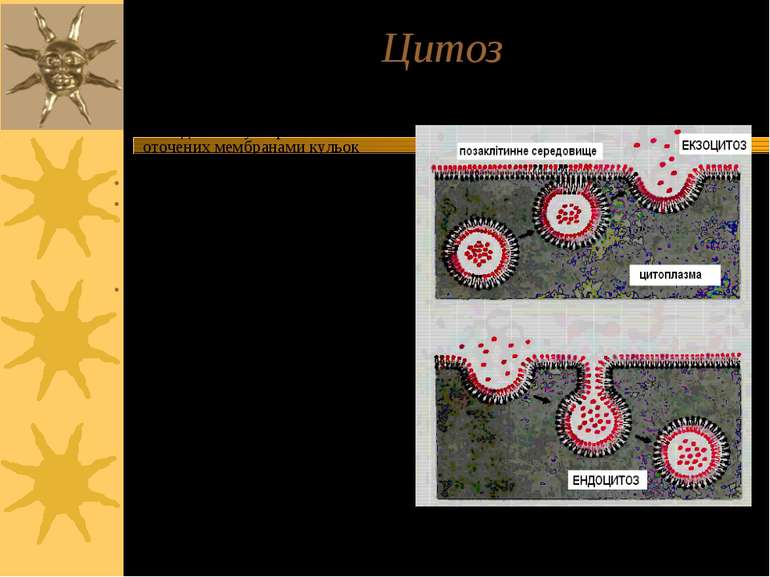
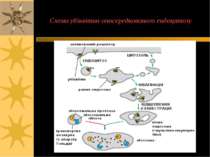
Цитоз Особливий вид транспорту, що належить до активного. Це перенос речовин за рахунок послідовного утворення оточених мембранами кульок (везикул). Ендоцитоз і екзоцитоз В ці процеси залучені периферійні мембранні білки і рецептори, що хдійснюють координацію і специфічну регуляцію Стадії: І – речовини, що транспортуються, адсорбуються на мембрані (ендо- - на зовнішній, екзо- - на внутрішній) ІІ – вп ячування мембрани та її замикання з утворенням везикул; кілька везикул надалі зливаються з утворенням ендосоми чи екзосоми
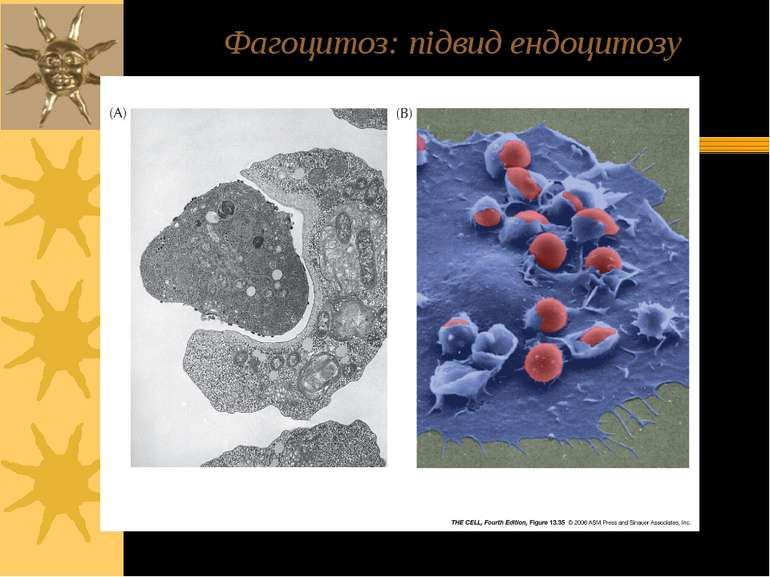
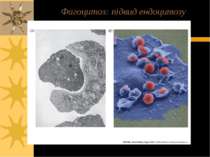
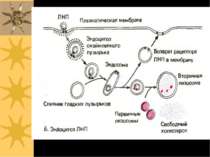
ТРИ ВАРІАНТИ ЕНДОЦИТОЗУ: Піноцитоз – (=“пиття клітин”) - транспорт позаклітинної рідини з іонами й мілкими молекулами (1-0.2 µM); фагоцитоз – (=“травлення клітин”) - транспорт твердих субстанцій розмірами 1-2 µM (бактерій, фрагментів клітин, тощо); до фагоцитозу здатні простіші, а в організмі вищих тварин – макрофаги. Фаголізосоми – фагасоми, що злитьі із лізосомами – містять лізосомальні кислі гідролази, що перетравлюють вміст фагосом Високоспецифічний варіант ендоцитозу, що опосередковується мембранними рецепторами – таким шляхом в клітину потрапляють різноманітні ліганди, напр., ЛПНЩ. Для такого типу ендоцитозу необхідна низка клітинних білків, зокрема, клатрин.
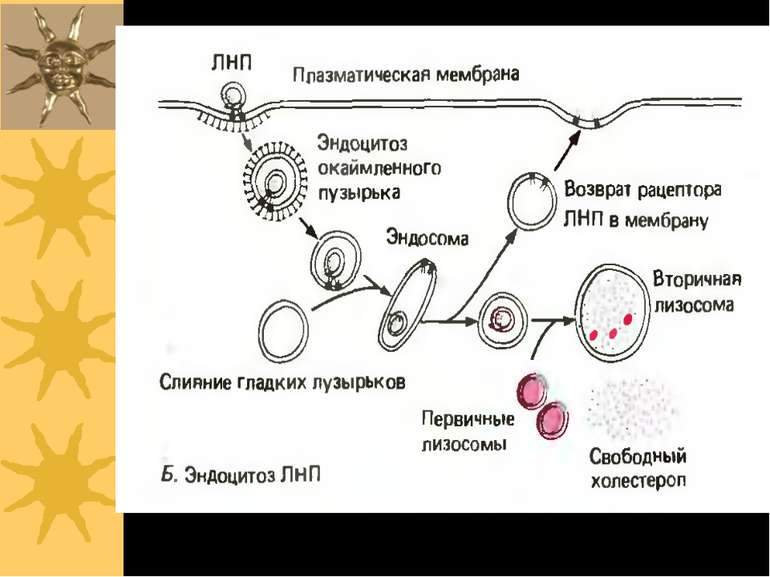
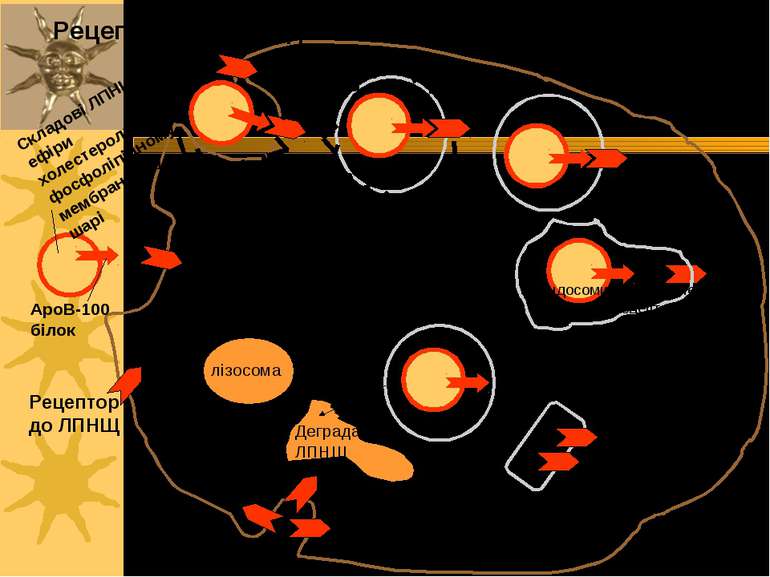
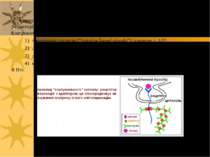
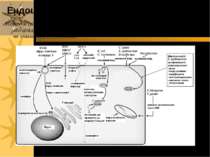
Схема рецептор-опосередкованого ендоцитозу ЛПНЩ 1) Рецептор до ЛПНЩ спочатку зв язується із B-100 білком ЛПНЩ. 2) Формуються ендосоми із ЛПНЩ всередині; ЛПНЩ відокремлюються від власних рецепторів 3) Рецептор до ЛПНЩ і клатрин повертаються у поверхню мембрани; деградація ЛПНЩ продукує холестерол, жирні кислоти й амінокислоти у вторинних лізосомах Родинна гіперхолестеролемія: мутації гену рецептору до ЛПНЩ спричиняє ушкодження поглинання ЛПНЩ і високі рівні холестеролу в крові Аналогічний механізм – для транспорту іонів заліза (захоплюється трансферин, іони заліза надходять у лізосоми, а трансферин із рецептором повертаються на поверхню клітини), гормонів, регуляторних білків
повернення клатрину до ПМ Рецептор до ЛПНЩ ApoB-100 білок Складові ЛПНЩ: ефіри холестеролу в фосфоліпідному мембранному шарі “Coated Pit” – ”одягене вгинання” лізосома Деградація ЛПНЩ “роздягена” везикула Ендосоми: відокремлення ЛПНЩ від рецепторів Ревикористання рецепторів до ЛПНЩ Рецептор-опосередкований ендоцитоз ЛПНЩ
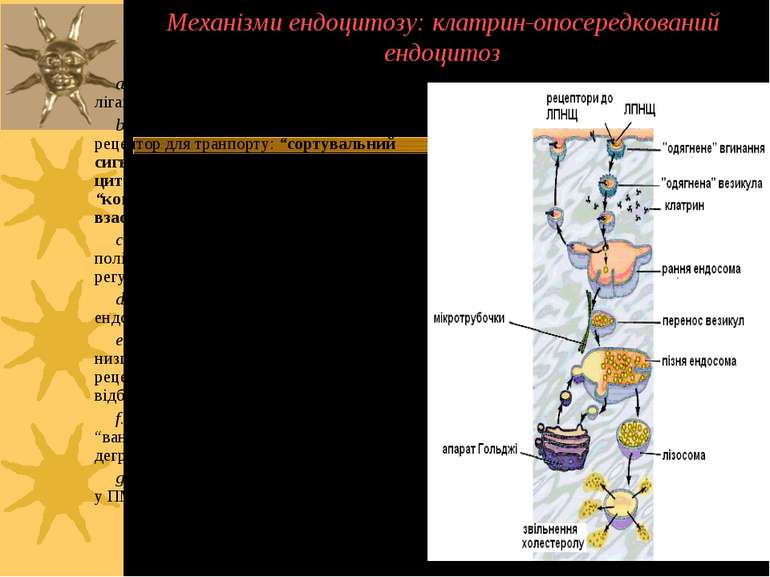
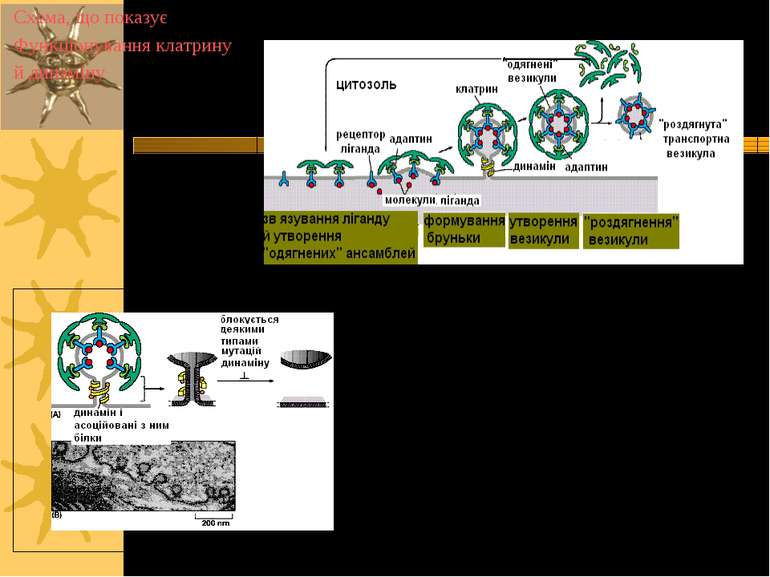
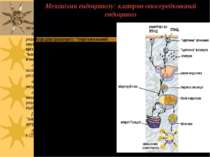
Механізми ендоцитозу: клатрин-опосередкований ендоцитоз a. Рецептори забезпечують зв язування лігандів (ліпіди, білки, віруси). b. Вибір рецептора або комплексу ліганд-рецептор для транпорту: “сортувальний сигнал" в хвості рецептора взаємодіє з цитозольним адаптером, формуючи “комплексні частки" (КЧ), які надалі взаємодіють із клатрином c. Везикули формуються за рахунок полімеризації клатрину із використанням регуляторних білків (динамін, ін.). d. Везикули транспортуються до ранніх ендосом. e. Вплив кислого pH ранніх ендосом в низці випадків відокремлює ліганд від рецептора; в ін. випадках дисоціації не відбувається f. “Вантаж” рецептора, або рецептор із “вантажем” направляються у лізосому, де деградують g. Дисоційований рецептор повертається у ПМ для ревикористання.
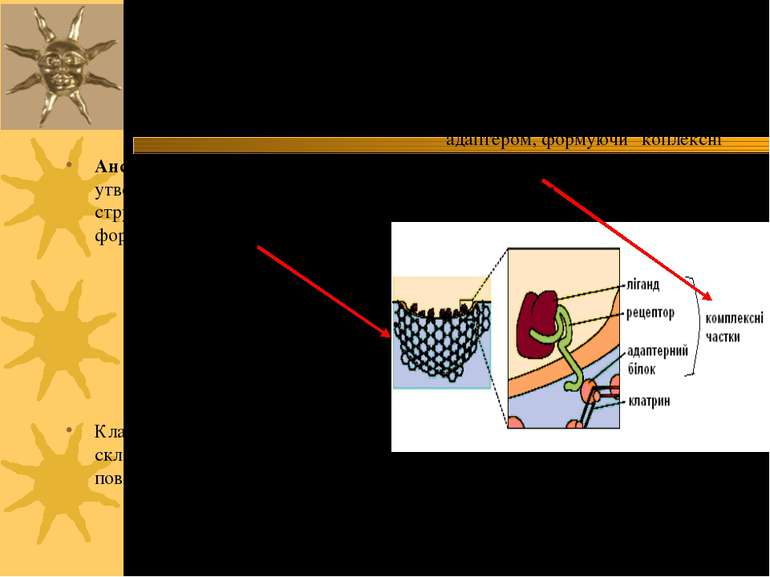
Ансамблі КЧ + клатрин утворюють кошикоподібні структури, що викривляють ПМ, формуючи “одягнені вигинання” Клатрин-одягнені вигинання складають біля 1-2% всієї поверхні ПМ. Вибір рецептора або комплексу ліганд-рецептор для транпорту: “сортувальний сигнал" в хвості рецептора взаємодіє з цитозольним адаптером, формуючи “коплексні частки" (КЧ), які надалі взаємодіють із клатрином
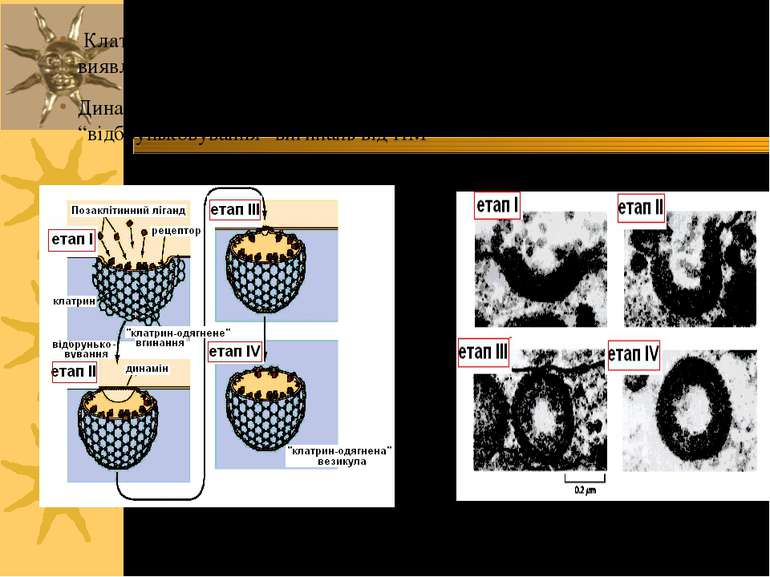
Клатрин-одягнені вигинання – спеціалізовані ділянки ПМ, в яких виявлені специфічні рецептори клітинної поверхні Динамін – мембранозв язана ГТФаза, що залучена у “відбруньковування” вигинань від ПМ
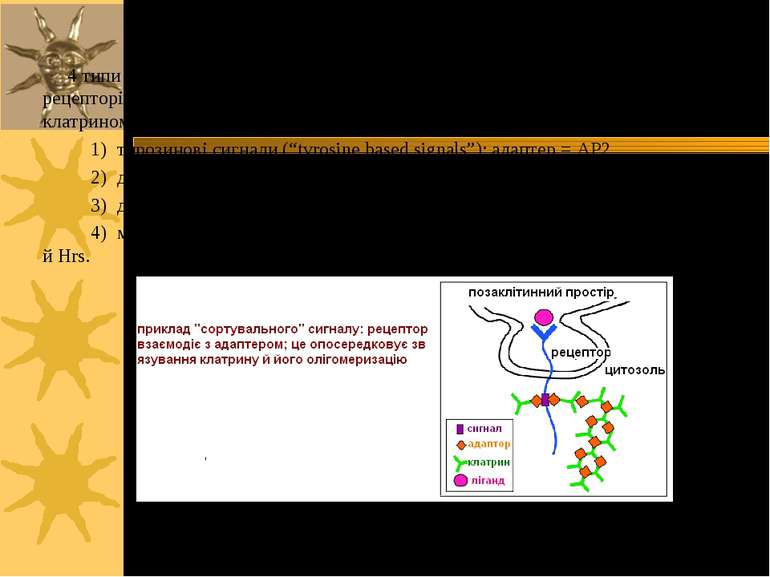
4 типи “сортувальних сигналів” на цитоплазматичному домені мембранних білків-рецепторів, що забезпечують їх подальшу взаємодію з цитозольним адаптером і клатрином: 1) тирозинові сигнали (“tyrosine based signals”); адаптер = AP2 2) ділейцин (LL) –вмісні сигнали; адаптер = AP2 3) домен, багатий на фосфорильований серин на С-кінці 4) мотиф, утворений шляхом моноубіквітинації; адаптери = Eps15/15R, епсини й Hrs.
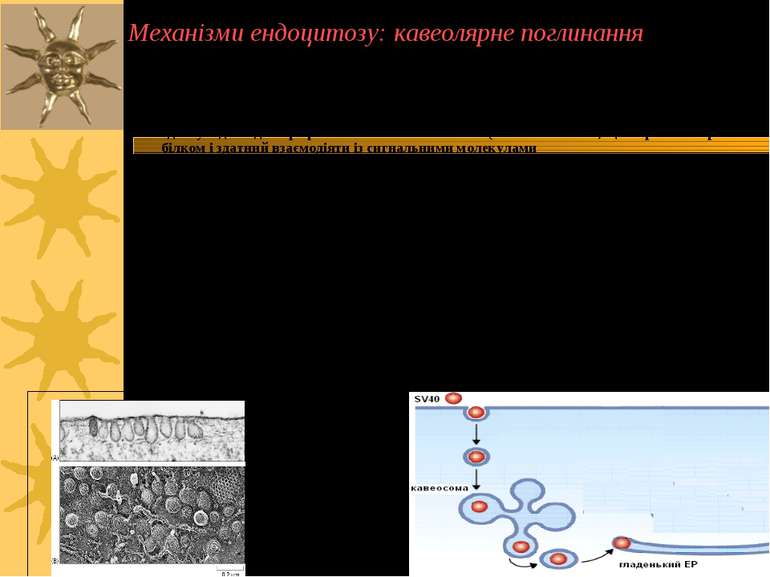
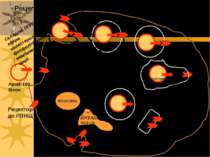
Кавеоли: мають колбоподібну або сплощену форму, “неодягнені” мембранні впячування, 50 - 100 нм За структурою подібні до ліпідних рафт: містять холестерол, глікосфінголіпіди, якорні глікопротеїни, рецептори На відміну від ліпідних рафт містять білок кавеолін-1 (178 а/к залишки, що є трансмембранним білком і здатний взаємодіяти із сигнальними молекулами Ліпідні рафти є попередниками в утворенні кавеол Кавеоли є центрами сигнальної активності, а також залучені у ендоцитоз Вони не містять у рецепторів, що беруть участь в клатрин-залежному поглинанні Недостатність холестеролу порушує рафти й кавеолярне поглинання, і не впливає на кларитин-опосередкований ендоцитоз Кавеосоми є більш стабільними, ніж ендосоми, і переносять “вантаж” до ЕР і апарату Гольджі Кавеоли є сайтами поглинання харчових компонентів, гормонів, хемокінів, деяких вірусів, бактерій, паразитів й бактеріальних токсинів Поглинання в ділянках кавеол дозволяє патогенам уникнути перетравлення в лізосомах і деградації Ліворуч: кавеоли. Праворуч: SV40 входить через кавеоли й прямує до ЕР. Механізми ендоцитозу: кавеолярне поглинання
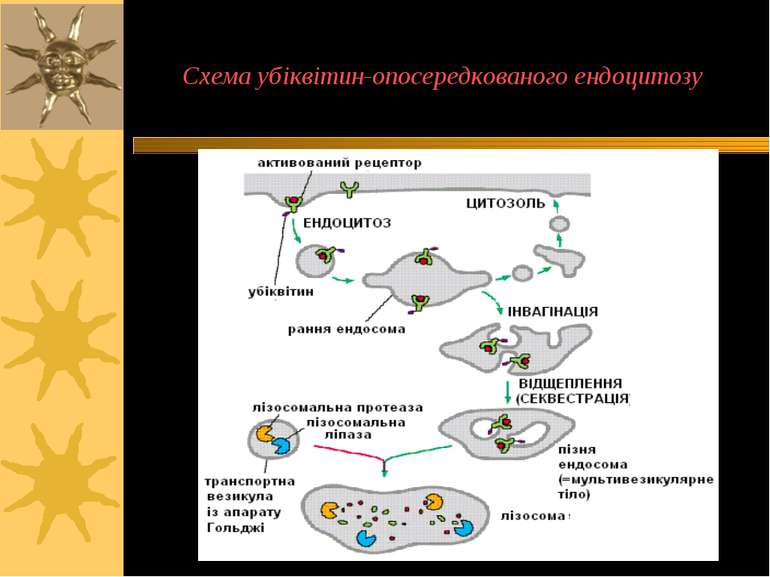
Убіквітин: 76 a/к залишки; кон югує із білками-субстратами: - поліубіквітинування зумовлює деградацію модифікованих білків-мішенейу протеасомі; - моноубіквітинування є сигналом для ендоцитозу білків на поверхні клітини Убіквітиновані білки інтерналізуються у ендосоми, мультивезикулярні тільця ( =пізні ендосоми), лізосоми. Неубіквітиновані рецептори рециклізуються в ПМ через рециклічні ендосоми Моноубіквітиновані інтерналізовані білки взаємодіють з ендоцитозними адаптерними комплексами. Адаптерні білки (напр., епсини) мають убіквітин-взаємодіючі домени, що “впізнають” моноубіквітиновані білки й надалі взаємодіють із клатрином Сортування убіквітинованих субстратів у ранні й пізні ендосоми і лізосоми у ссавців потребує адаптернихї білків Tsg101 і Hrs Ферменти деубіквітинування видаляють убіквітин із білків для їх подальшого використання Приклади із патології: віруси використовують такий механізм ендоцитозу для вбудовування: HIV-1 і Ebola використовують клітинні білки-адаптери (Tsg101 і Vps4), що включаються у ендоцитозне сортування убіквітинованих білків для полегшення відбруньковування вірусів у клітину Механізми ендоцитозу: убіквітин-опосередкований ендоцитоз
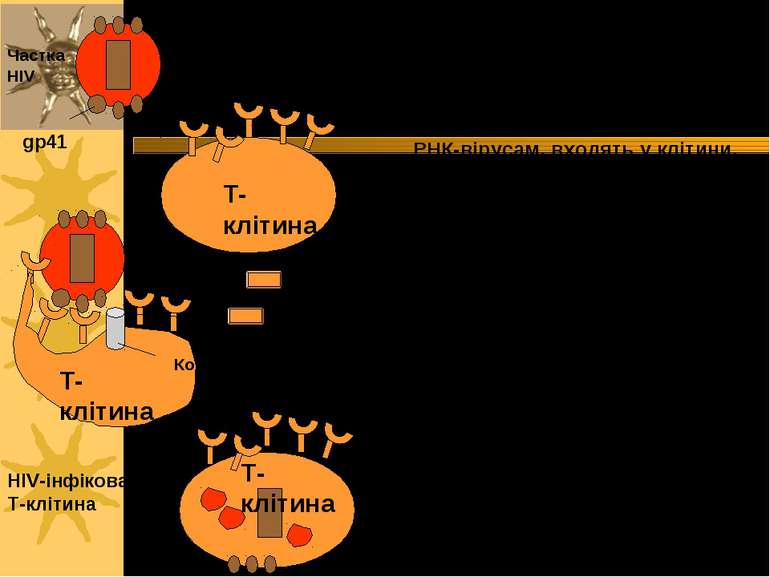
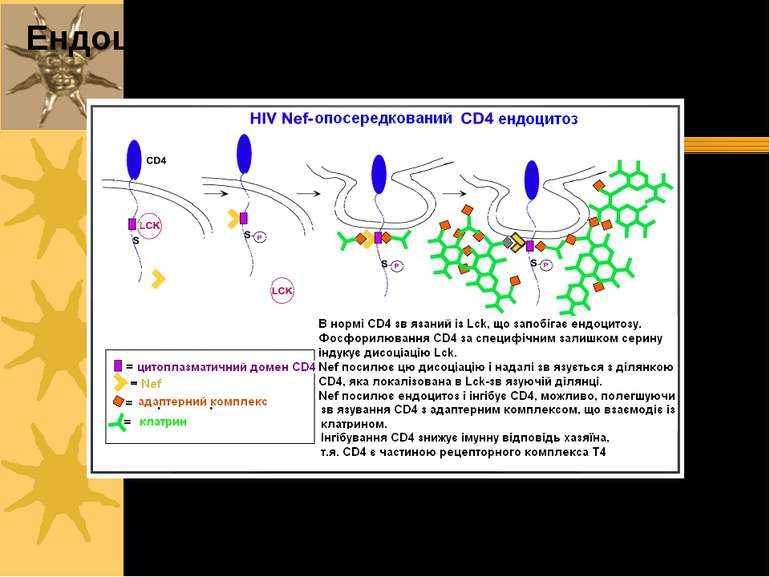
Віруси, подібні HIV або іншим РНК-вірусам, входять у клітини, коли вони розпізнаються поверхневим рецептором специфічних клітин. HIV-вірус входить у Т-клітини, розпізнаючи CD4-білок за допомогою gp41 і gp120. Gp120 полегшує ендоцитоз вірусних часток Вірус грипу (Influenza virus) використовує власний білок гемагглютинації (ГА) для розпізнання глікофорину А або сіалової кислоти на поверхні еритроцитів, активуючи ендоцитоз, за допомогою якого віруси входять у клітини T-клітина T-клітина T-клітина gp41 gp120 CD4 Кофактор злиття Частка HIV HIV-інфікована T-клітина Ендоцитоз: приклади із патології
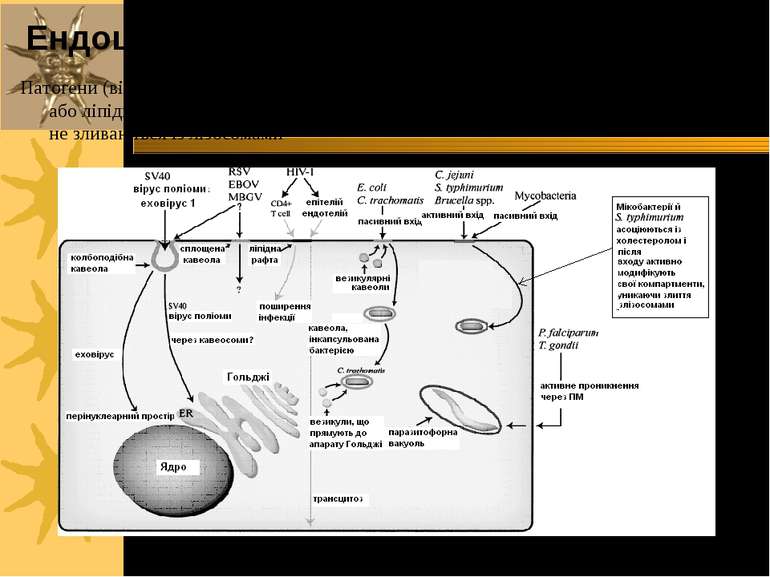
Патогени (віруси, бактерії, мікобактерії, паразити), що входять в клітини через кавеоли або ліпідні рафти, можуть далі прямувати до різних внутрішньоклітинних відділів і не зливаються із лізосомами Ендоцитоз: приклади із патології
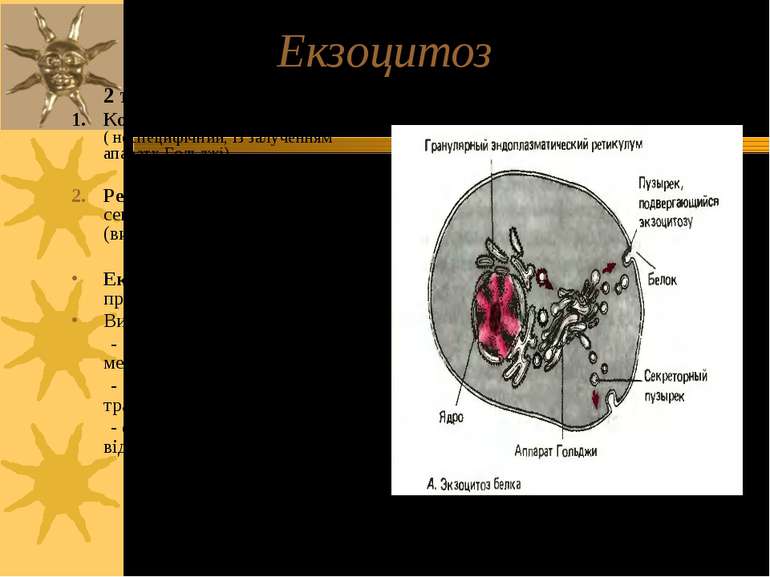
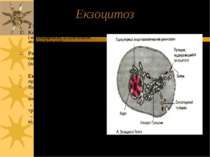
Екзоцитоз 2 типи екзоцитозу: 1. Конститутивний шлях ( неспецифічний, із залученням апарату Гольджі) Регульований шлях, напр., секреція гормонів (високоспецифічний) Екзоцитоз – це кінцева стадія процесу секреції Виділення: - нервовими закінченнями медіаторів - клітинами травних залоз травних ферментів - ендокринними клітинами – відповідних гормонів
САМОСТІЙНО – З КУРСІВ БІОХІМІЇ, БІОФІЗИКИ, ФІЗІОЛОГІЇ ЛЮДИНИ І ТВАРИН, ФІЗІОЛОГІЇ РОСЛИН, ЦИТОЛОГІЇ ТА ІН: Роль мембран у проведенні збудження Сопрягаючі мембрани Рецепторна функція біологічних мембран Міжклітинні взаємодії
Сопрягаючі мембрани Мембрани, в яких енергія зовнішніх ресурсів перетворюється на енергію АТФ Це внутрішні мембрани мітохондрій, тилакоїдні мембрани хлоропластів Вони містять компоненти ланцюгів переносу електронів і фосфорилювання, а також фосфоліпіди Детальніше - САМОСТІЙНО
Рецепторна функція біологічних мембран Роль мембранних рецепторів у передачі гормональних сигналів буде детально розглянута в наступних лекціях Фоторецепція – САМОСТІЙНО Рецептори збудливих тканин (холінові, ГАМК, дофамінові, глутаматні, гліцинові, опіатні, серотонінові, адренергічні тощо) – типи й особливості функціонування САМОСТІЙНО Рецептори, що відповідають за перенос макромолекул через мембрану в клітину шляхом специфічного ендоцитозу (рецептори до ЛПНЩ) - САМОСТІЙНО
Схожі презентації
Категорії