Презентація на тему:
Поняття про хімічний зв’язок та взаємний вплив атомів в молекулах органічних сполук
Завантажити презентацію
Поняття про хімічний зв’язок та взаємний вплив атомів в молекулах органічних сполук
Завантажити презентаціюПрезентація по слайдам:
Тема 1. Хімічний зв’язок та взаємний вплив атомів в молекулах органічних сполук. Тема 2. Кислотні та основні властивості органічних сполук. Класифікація органічних реакцій і реагентів.
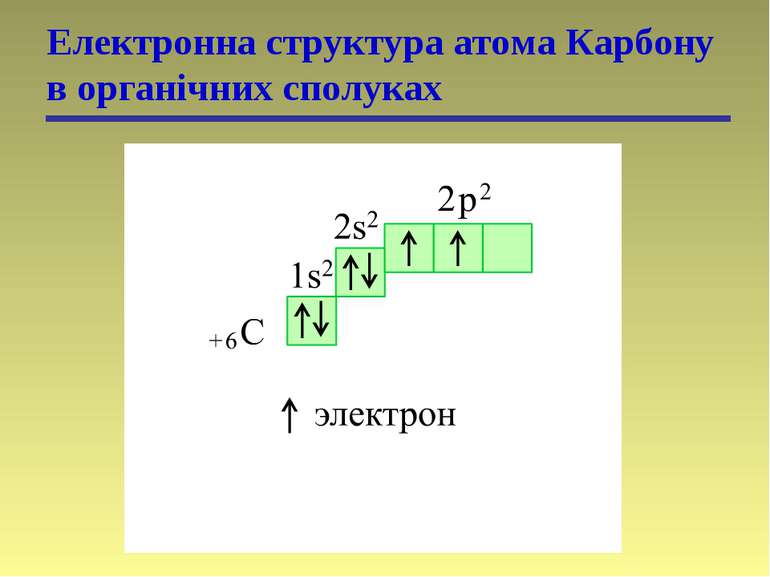
Одне з головних питань – питання про хімічний зв’язок. Це питання було розв’язане тільки після відкриття електрону. На початку XX ст., коли були досягнуті успіхи в питанні будови електронних оболонок атомів, коли стало відомо, що властивості атомів визначаються переважно електронами останнього енергетичного рівня, питання про хімічний зв’язок набрало ваги. Розробка електронних уявлень в органічній хімії (Штарк, Коссель, Льюїс, Ленгмюр) приводить до виникнення “октетної теорії”, або “теорії електронних пар” (1916-1917 р.) для практикування природи хімічного зв’язку. Автори звернули увагу на стабільність конфігурації з 8 електронів (інертні гази) і на те, що при утворенні зв’язку атоми намагаються утворити стійкий октет. (формули Льюїса)
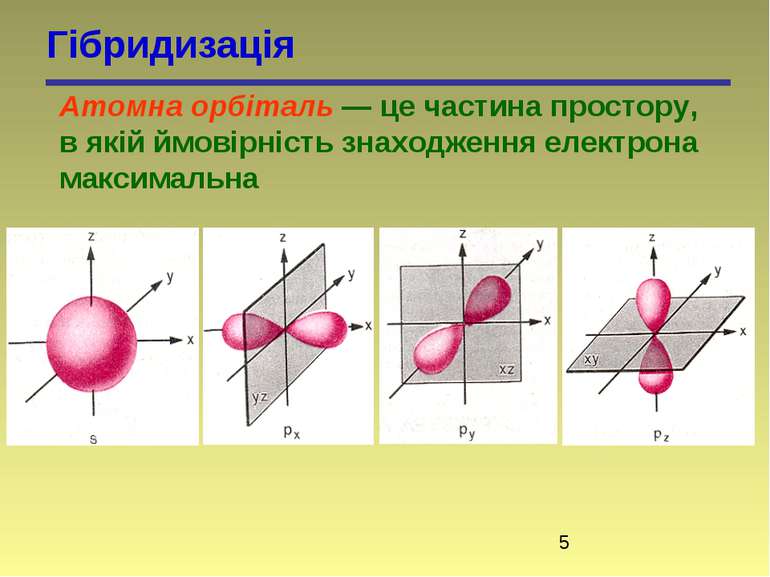
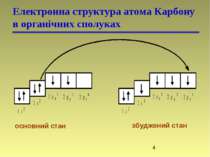
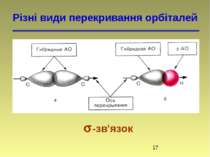
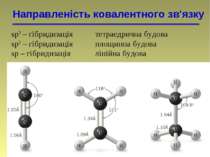
Гібридизація Атомна орбіталь — це частина простору, в якій ймовірність знаходження електрона максимальна
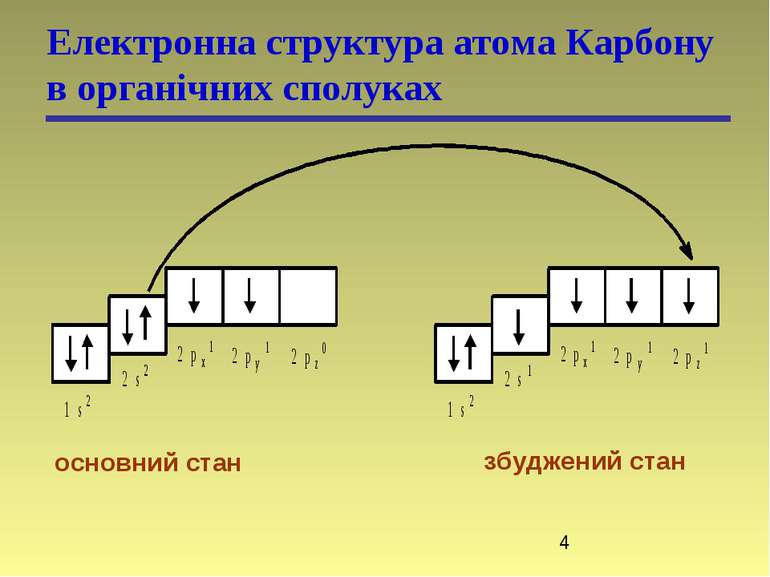
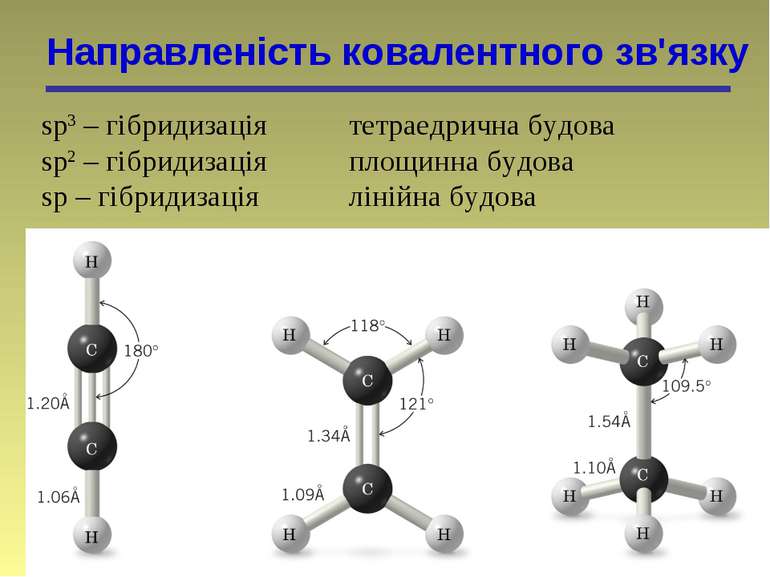
Гібридизація Гібридні орбіталі і характер атомів Карбону Стан атома Карбону Орбіталі Валентний стан атома Карбону Тип гібридизації і будова молекули Збуджений, вихідний стан 2s 2px 2py 2pz – – Збуджений, в алканах 2sp3 2sp3 2sp3 2sp3 I (sp3) Тетраедрична Збуджений, в алкенах 2sp2 2sp2 2sp2 2p II (sp2) Тригональна (площинна) Збуджений, в алкінах 2sp 2sp 2p 2p III (sp) Дигональна (лінійна)
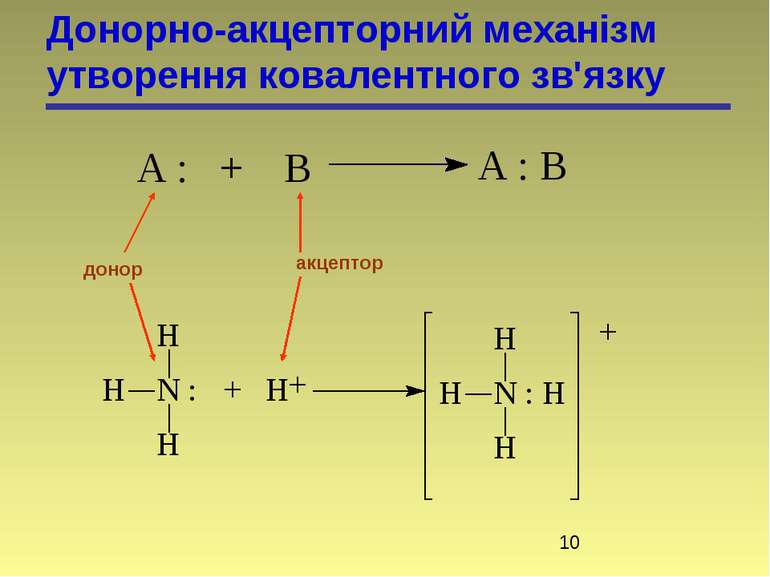
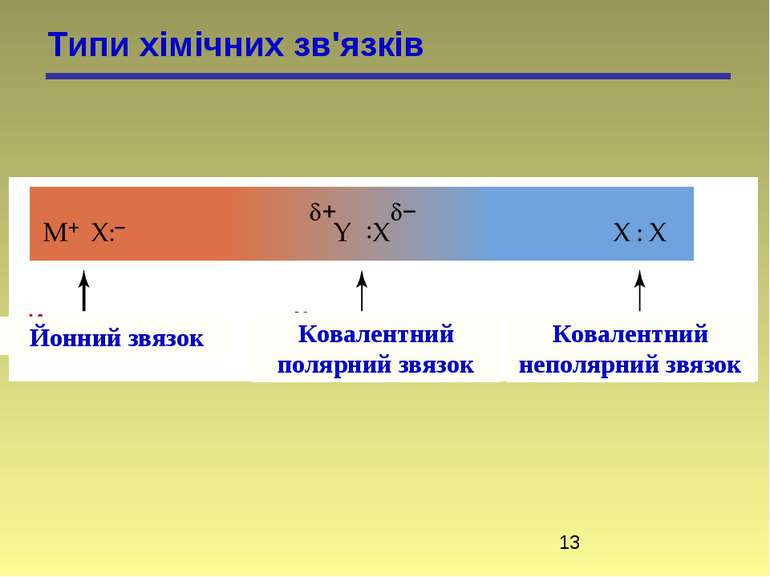
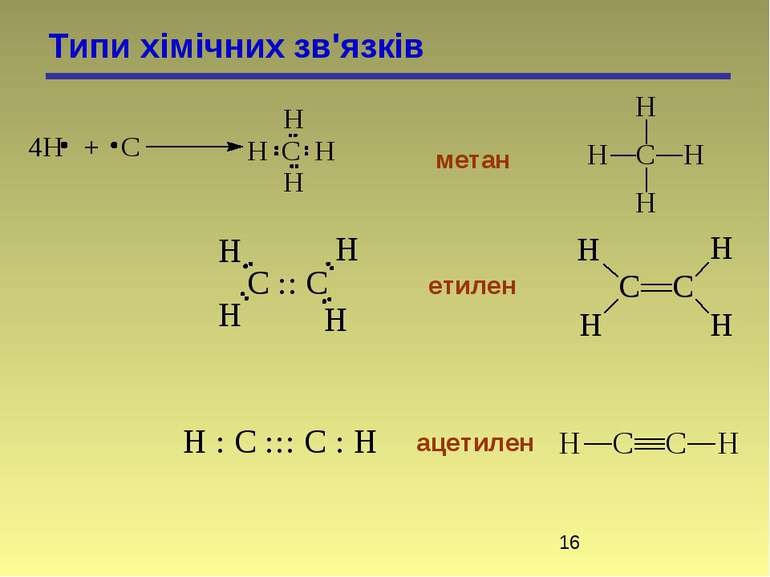
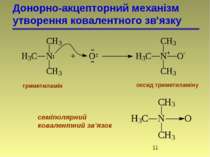
У відповідності з октетною теорією утворення октету може проходити двома шляхами, тому є два види хімічного зв’язку: гетерополярний і гомеополярний зв’язки. 1. Гетерополярний, електровалентний (Коссель, Ленгмюр) або іонна взаємодія пов’язана з повною віддачею атомами електронів. Атоми перетворюються в іони. 2. Гомеополярний зв’язок, атомний. Стійкі октети створюються шляхом узагальнення електронів. Зв’язок створений спільними електронними парами, називається ковалентним. Виникнення ковалентного зв’язку йде двома механізмами: а) коллігація (обмінний механізм), кожний з атомів дає електрони для спільного користування): СН3 + СН3 СН3 – СН3
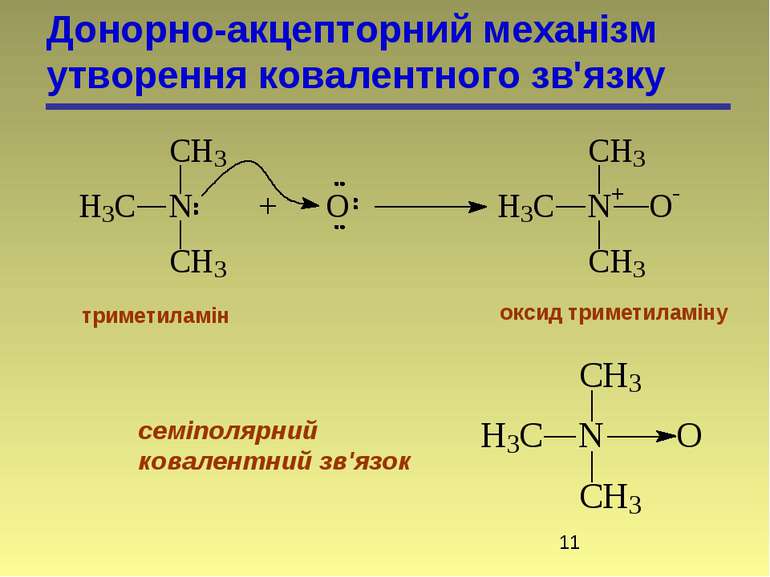
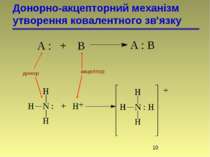
б) координація (донорно-акцепторний механізм) – один з атомів є донором електронів, а другий – акцептором. СН3 + СН3 СН3 – СН3
Ці два методи – це два різних шляхи утворення одного і того ж зв’язку, структура якого не залежить від механізму утворення. По донорно-акцепторному механізму взаємодіють сполуки, які містять в своєму складі атоми N, O, S. Льюїс розглядає подібні реакції як кислотно-основні. Донори – основи, акцептори – кислоти. хлорид метиламонію
Донорно-акцепторний механізм утворення ковалентного зв'язку триметиламін оксид триметиламіну семіполярний ковалентний зв'язок
Семіполярний зв’язок (біполярний, півполярний) – це різновидність ковалентного зв’язку, утвореного по донорно-акцепторному механізму. Це такий зв’язок, коли ковалентнозв’язані атоми несуть повні протилежні (формальні) заряди. Цей вид зв’язку являє собою комбінацію ковалентного і електровалентного зв’язку. Від звичайного ковалентного зв’язку відрізняється тим, що атоми несуть заряди; від електронновалентного тим, що крім іонної взаємодії атоми зв’язані ще й ковалентно, тому сполуки не дисоціюють у водному розчині на іони.
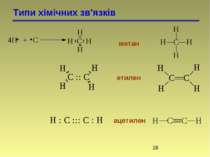
Типи хімічних зв'язків Йонний звязок Ковалентний полярний звязок Ковалентний неполярний звязок
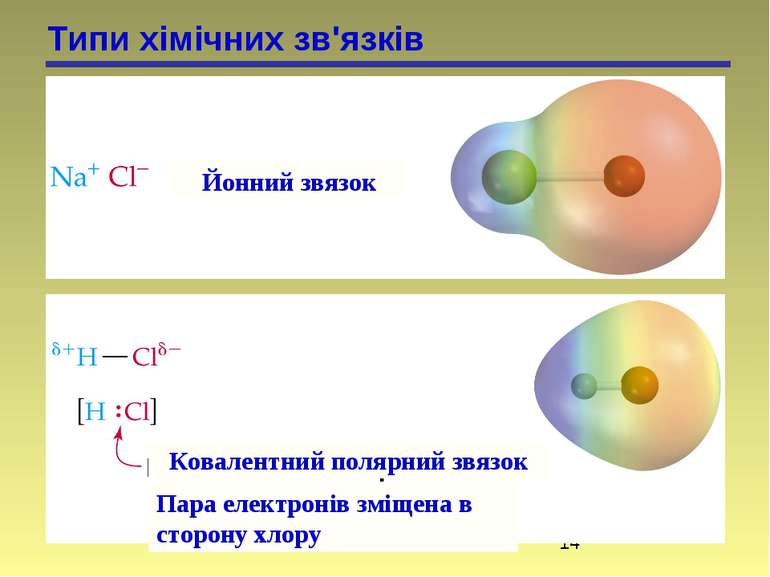
Типи хімічних зв'язків Йонний звязок Ковалентний полярний звязок Пара електронів зміщена в сторону хлору
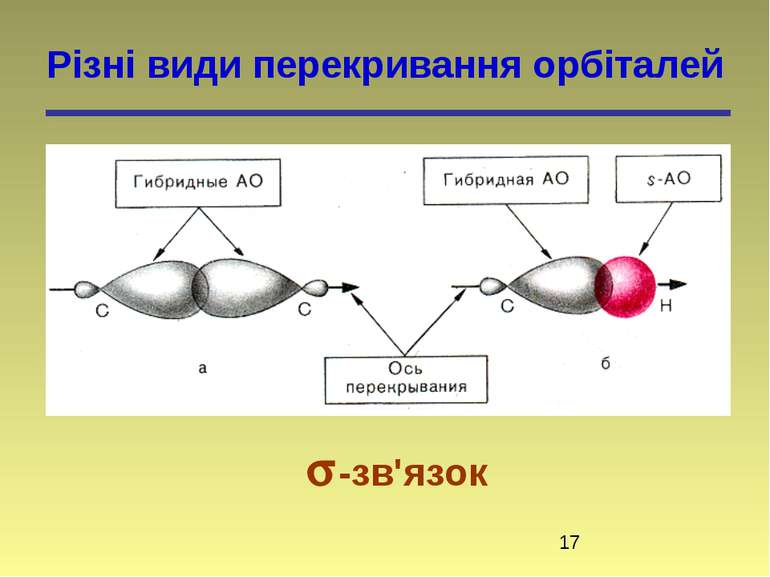
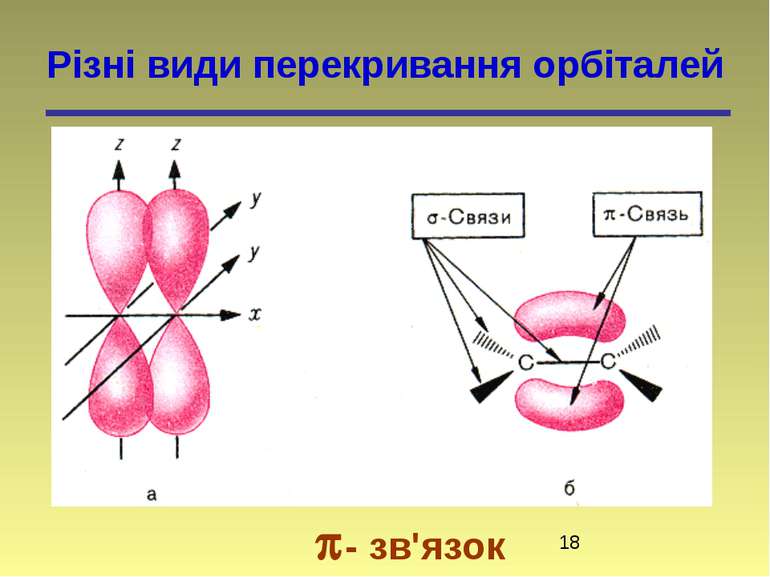
Властивості ковалентного зв'язку Ковалентний зв'язок характеризується такими параметрами: насиченістю, полярністю, поляризованістю, довжиною, енергією і направленістю в просторі (кутами між зв'язками).
Полярність зв’язку (статична поляризація) відбиває взаємний вплив безпосередньо зв’язаних атомів. Це зміщення електронної хмари зв’язку до більш електронегативного атома. Електронегативність – здатність атома або групи атомів відтягувати до себе електронну густину. Електронегативність елементів визначається шкалою Полінга: 4,0 3,5 3,2 3,0 2,8 2,75 2,6 2,5 2,2 F > O > Csp > N, Cl > Br > Csp2 > I > Csp3 > H Чим більша електронегативність атома, тим більш полярний зв’язок.
Кількісно полярний зв’язок можна охарактеризувати величиною дипольного моменту ( ). Полярні молекули утворюють диполі. Диполь – система з розділеними центрами електропозитивних і електронегативних зарядів. Одиниці виміру дипольного моменту Д (дебай) або Кулон метр (Кл м). = g l 1 Д = 3,33 10–30 Кл м. Для ковалентних молекул = 0 – 4 Д, для йонних – = 4 – 11 Д. Дипольний момент – величина векторна, показується від + до – . В молекулі дипольний момент являє собою геометричну суму дипольних моментів окремих зв’язків. Тому деякі симетричні молекули не полярні.
Поляризованість Ковалентний зв'язок володіє поляризованістю — здатністю змінювати свою полярність, наприклад, під дією зовнішнього впливу
Поляризованість зв’язку (динамічна поляризація) – це зміна розподілу електронної густини під дією зовнішніх чинників (реагентів, розчинників, каталізаторів). Поляризованість зростає із зменшенням ЕН та із збільшенням радіуса атома і є більш визначальною на реакційну здатність молекули. Чим більше електрони зсунуті в статичній молекулі, тим менше залишається можливостей для їх зсуву під дією зовнішнього поля. Найменш полярна молекула HJ являє собою саму сильну кислоту: у водному середовищі завдяки високій поляризованісті легко відщеплює протон. Поляризованість молекул має важливе значення для пояснення поведінки речовин в момент реакції. - зв'язки поляризуються значно легше, ніж - зв'язки
Довжина зв’язку (l) – відстань між ядрами атомів, що відповідає мінімальній енергії системи з двох ядер Енергія зв’язку (Е) – є мірою його міцності і визначається як кількість енергії, що виділяється при утворенні зв’язку, або яку потрібно затратити на його розрив. Виражається в кДж/моль або ккал 1 ккал = 4,184 кДж. С – С 330 - 360 кДж/моль, С = С 590 - 640 кДж/моль, С С 810 - 840 кДж/моль.
Довжина звязку і енергія Деякі параметри ковалентних Карбон-Карбонових звязків Сsp3 – Сsp2 0,150 нм Сsp3 – Сsp 0,146 нм С – Н 0,111 нм Ковалент-ний звязок Тип гібриди- зації атома Карбону Довжина звязку, нм Кут між гібридними орбіталями (міжвалент-ні кути) Енергія звязку, кДж/моль Форма молекули sp3 0,154 109° 28' 350 Тетраедри-чна sp2 0,134 120° 610 Площинна sp 0,120 180° 830 Лінійна
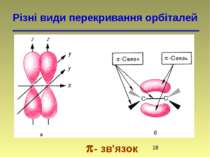
Направленість ковалентного зв'язку sp3 – гібридизація тетраедрична будова sp2 – гібридизація площинна будова sp – гібридизація лінійна будова
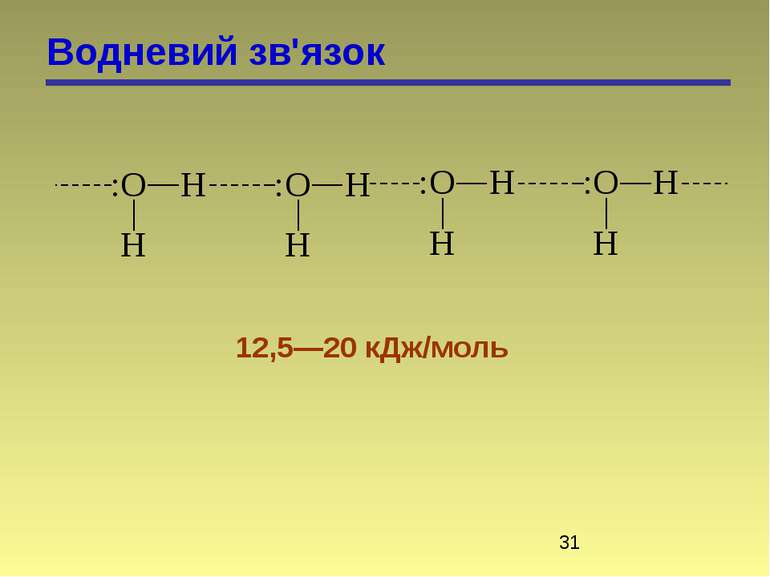
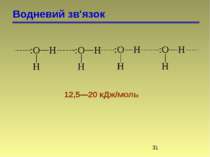
Водневий зв'язок Водневий зв’язок відноситься до особливого типу донорно-акцепторного зв’язку. Водневий зв’язок виникає у випадку, коли Гідроген зв’язаний ковалентно з сильно електронегативним (ЕН) елементом (F, O, N). Електронна пара при цьому значно зміщена до ЕН атому, а над Гідрогеном виникає +. При наближенні до атома Гідрогену іншого електронегативного атома іншої молекули, виникають сили взаємодії. При цьому ЕН атом виступає в якості донора електронів, а Гідроген – в якості акцептора. Атом Гідрогену займає проміжне положення між двома ЕН атомами, з одним з яких він зв’язаний ковалентно. Водневий зв’язок буває міжмолекулярним і внутрішньомолекулярним.
Водневий зв'язок Утворення міжмолекулярного зв’язку у випадку води, спиртів, приводить до збільшення Тк. Інколи зв’язки дуже міцні, утворюються асоціати: n – нітрофенол (не переганяються з водяним паром) о-нітрофенол (внутрішньо-молекулярні зв’язки) переганяються з водяною парою. Розчинність нижчих спиртів і амінів пов’язана з їх здатністю утворювати водневі зв’язки.
Водневий зв'язок Водневі зв’язки дуже поширені в природі, вони позначаються на властивостях білків, нуклеїнових кислот. Функціональні властивості білків визначаються їх здатністю утворювати водневі зв’язки. Ген-фрагмент ДНК – складна молекула, яка повинна зберегти свою конфігурацію, щоб вірно передавати спадковість. Водневі зв’язки відіграють важливу роль в підтриманні цієї конфігурації. Відомо, що з усіх взаємодій лише водневі зв’язки мають потрібну міцність і направленість, які характеризуються необхідними для підтримання структур молекул.
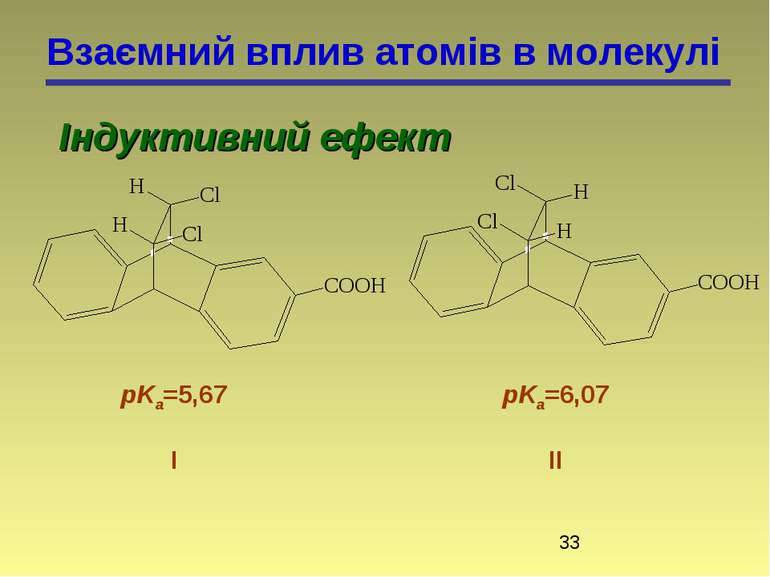
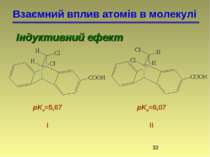
Взаємний вплив атомів в молекулі Індуктивний ефект Зміщення електронної густини по лінії - зв'язків називається індуктивним ефектом і позначається буквою I. метан хлорметан метанол Зв'язок C–H малополярний Зв'язок C–Cl полярний Зв'язок C–O полярний
Взаємний вплив атомів в молекулі Індуктивний ефект Електроноакцепторні замісники – це атом або група атомів, що зміщують електронну густину -звязку від атома Карбону, проявляють негативний індуктивний ефект (-I-ефект). Електронодонорні заместители замісники – це атом або група атомів, що зміщують електронну густину -звязку до атома Карбону, проявляють позитивний індуктивний ефект (+I-ефект).
Взаємний вплив атомів в молекулі Індуктивний ефект +I-Ефект проявляють аліфатичні вуглеводневі радикали, наприклад алкільні радикали (–CH3, –C2H5 і т. д.). Більшість функціональних груп проявляють -I-ефект: –Hal, –NH2, –OH, >С=O, –COOH. пропен
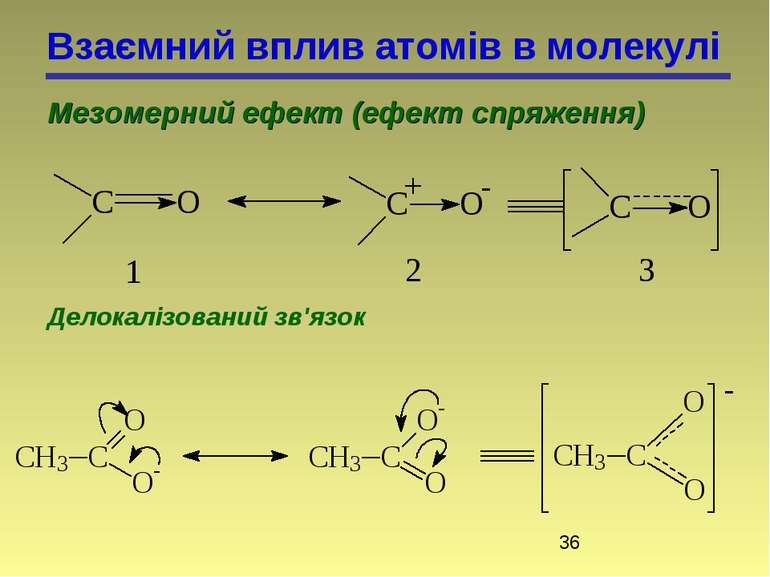
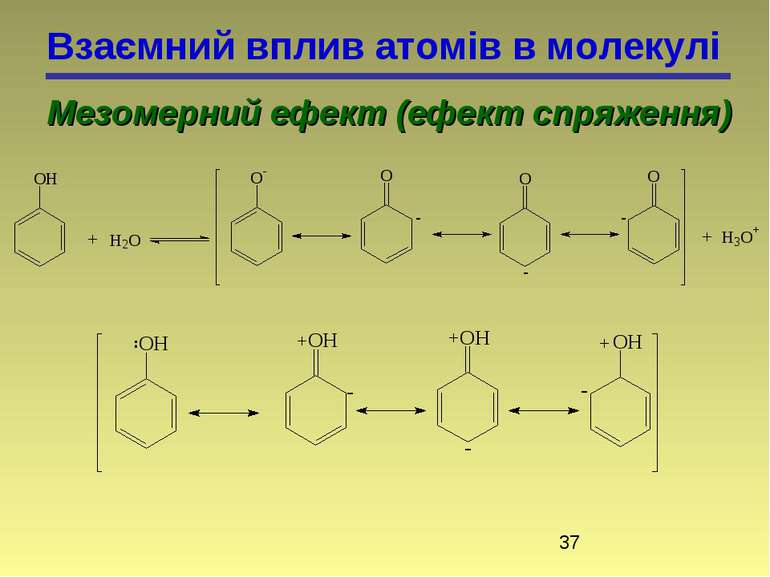
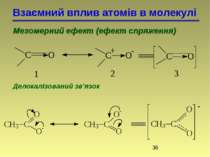
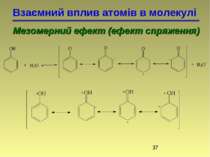
Взаємний вплив атомів в молекулі Мезомерний ефект (ефект спряження) Делокалізований зв'язок
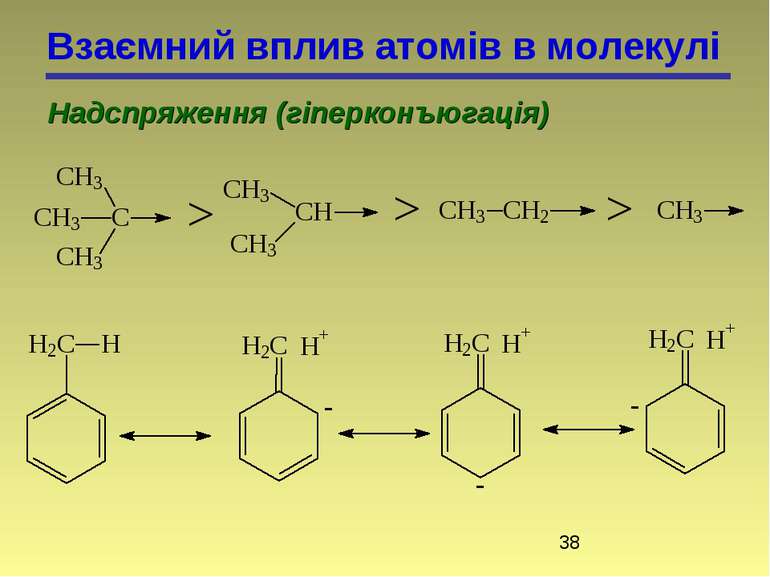
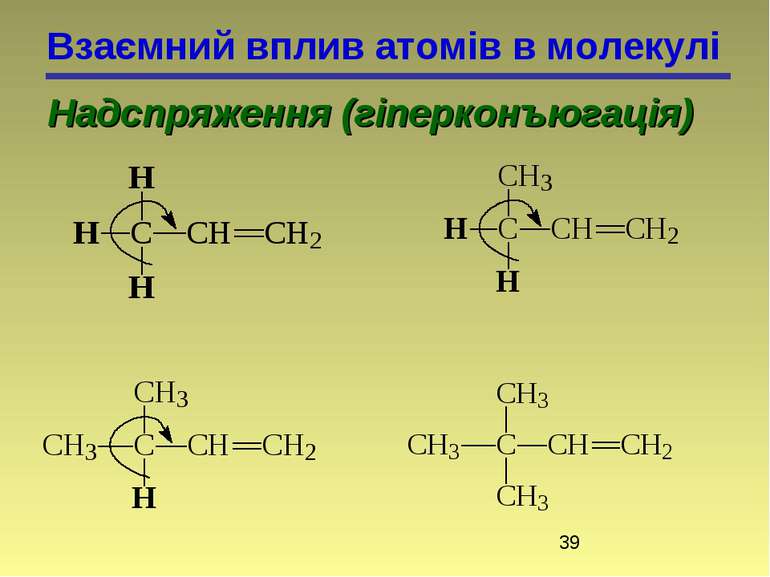
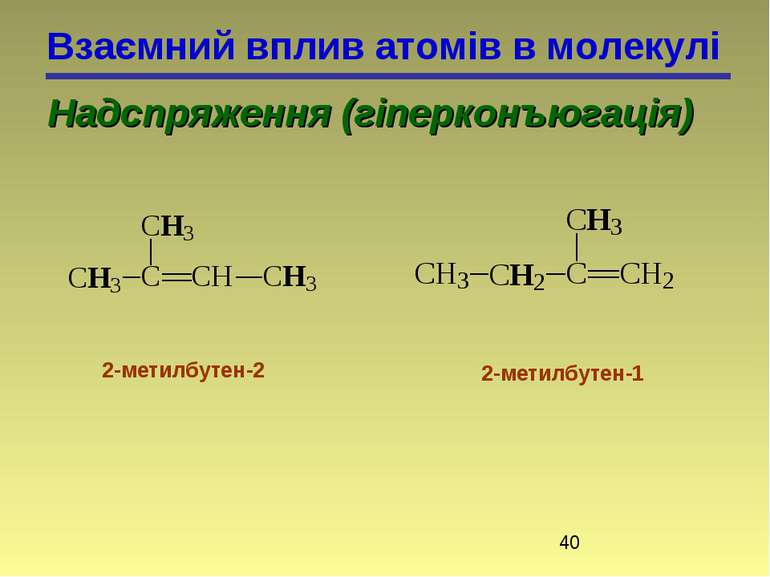
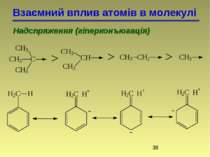
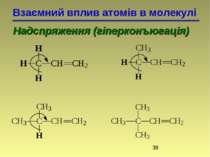
Взаємний вплив атомів в молекулі Надспряження (гіперконъюгація) 2-метилбутен-2 2-метилбутен-1
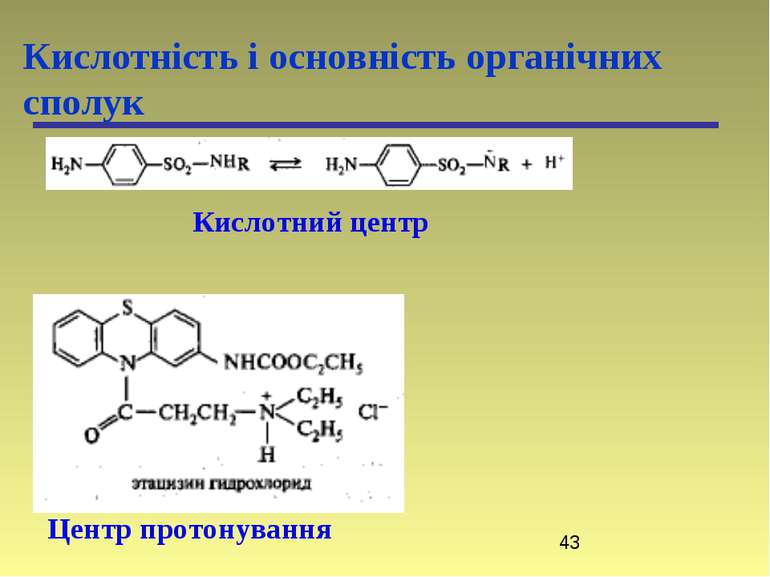
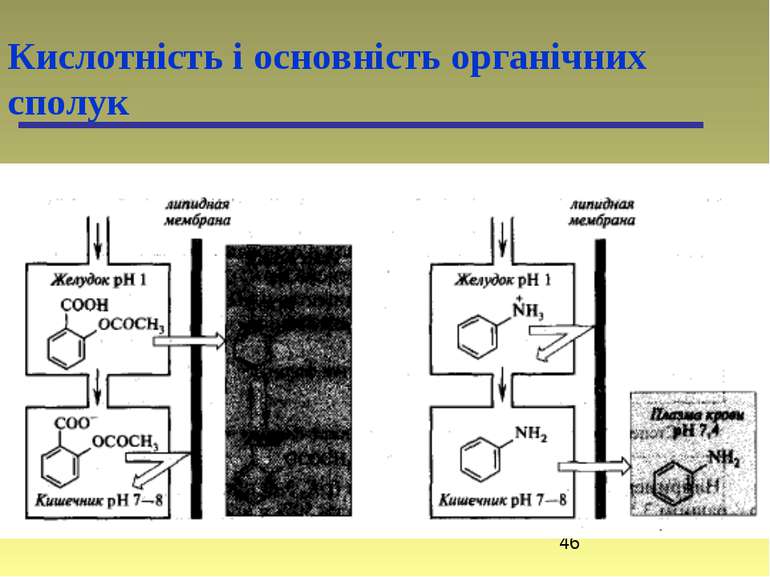
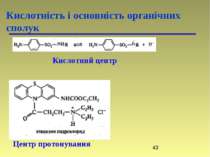
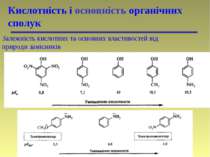
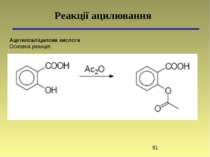
Кислотність і основність органічних сполук Переважно лікарські препарати проникають через ліпідну оболонку в неіонізованому стані, а тому знання їх кислотності і основності відіграє важливу роль в процесі вивчення їх метаболізму. Наприклад, ацетилсаліцилова кислота (аспірин) краще всмоктується в шлунку (рН 1 – 3) (ліки кислотної природи), а анілін краще всмоктується в кишечнику (рН 7 – 8) (ліки основної природи).
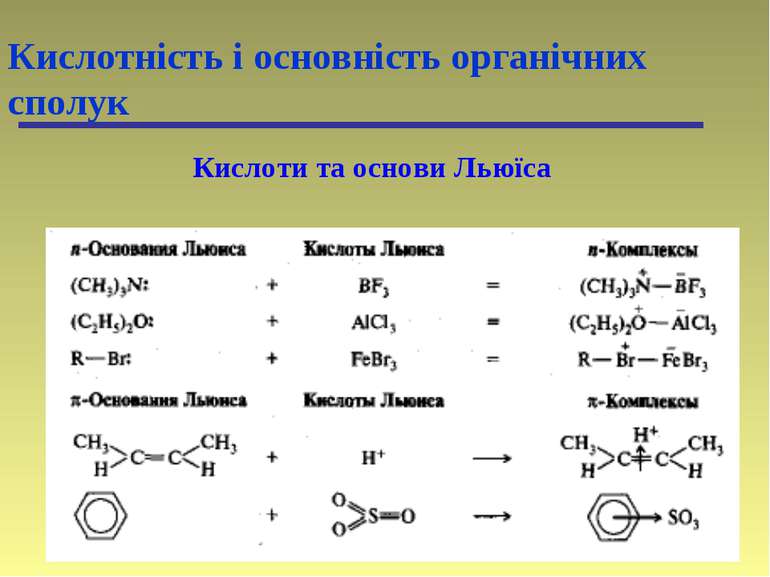
Кислоти та основи по Бренстеду-Лоурі Кислотність і основність органічних сполук Типи кислот: -SH > -OH > -NH > -CH Типи основ: амонієві основи > оксонієві основи > сульфонієві основи > -основи
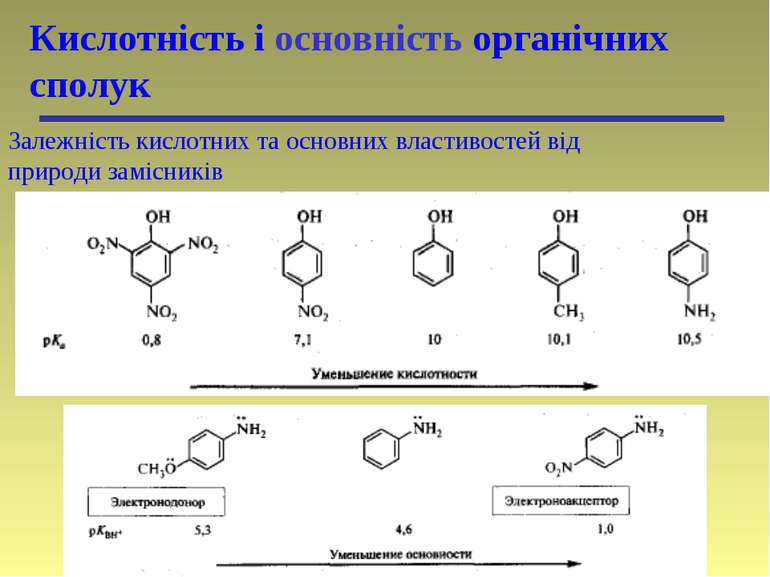
Кислотність і основність органічних сполук Залежність кислотних та основних властивостей від природи замісників
Кислотність і основність органічних сполук Ефективність дії багатьох лікарських засобів обумовлюється їх здатністю проникати до рецептора. Для речовин, здатних до іонізації, біологічна активність може визначатися часткою неіонізованих молекул, або Наприклад, фенол і ацетатна кислота припиняють ріст різних плісеневих грибів; їх біологічна дія обумовлена неіонізованими молекулами, і тому найбільша ефективність ацетатної кислоти проявляється при рН нижче 4, а для фенолу – при рН нижче 9. Також тільки неіонізований теофілін стимулює діяльність серця черепахи, а не його аніон. В той же час антибактеріальна дія сульфаніламідних препаратів обумовлена аніонами. Оптимальне значення рКа сульфаніламідів знаходиться в інтервалі 6–8. Або антибактеріальна (бактеріостатична) дія аміноакридинів проявляється тільки в катіонній формі цих сполук і зростає при підвищенні ступеня їх катіонної іонізації.
Гомолітичним, або вільнорадикальним називають механізм, в якому при розриві зв'язків у реагуючих молекул у кожного з фрагментів, що утворюються, залишається по одному електрону. Такі частинки називають радикалами (R) A · ¦ · B A· + B · Гетеролітичним, або йонним називають механізм, в якому при розриві зв'язків у реагуючих молекул обидва електрони залишаються на одному з фрагментів, що утворюються. Такі частинки називають йонами A :¦ B A- + B+ Типи механізмів органічних реакцій
1) йони, що несуть повний негативний заряд (аніони): OH-, CN-, RO-, NO2-, R-COO-, Hal- тощо; 2) нейтральні молекули, які містять одну або декілька неподільних електронних пар електронів: 3) молекули, які мають центри з підвищеною електронною густиною (алкени, алкадієни, алкіни, арени): Типові нуклеофільні реагенти
1) йони, що несуть позитивний заряд (катіони): протон (Н+), катіони металів, арилдіазоній-катіон (Ar-N2+), нітроній-катіон (NO2+), нітрозил-катіон (NO+), протонований сульфур (VI) оксид (HSO3+); 2) нейтральні молекули, які мають вакантну орбіталь: SO3, кислоти Льюїса (AlCl3, FeBr3, SnCl4, BF3) 3) молекули, які мають центри зі зниженою електронною густиною: галогенпохідні вуглеводнів, сполуки з карбонільною групою, а також галогени Типові електрофільні реагенти
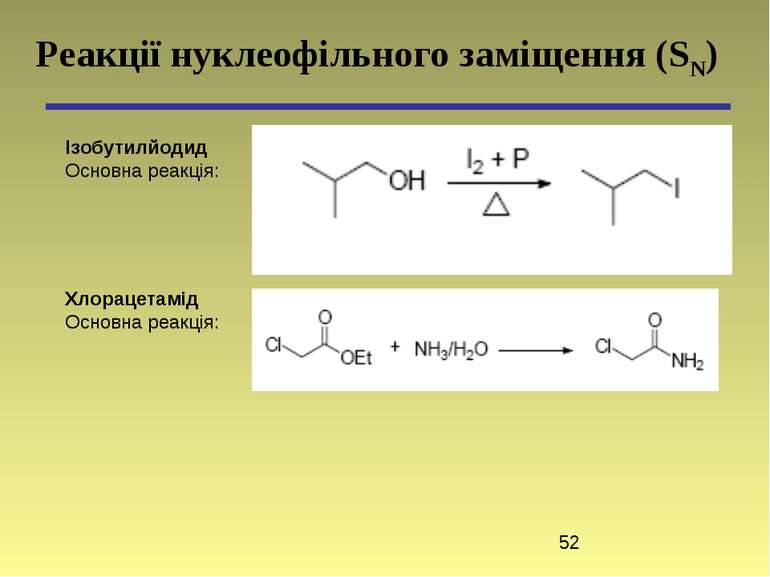
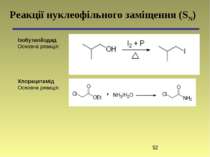
Реакції нуклеофільного заміщення (SN) Ізобутилйодид Основна реакція: Хлорацетамід Основна реакція:
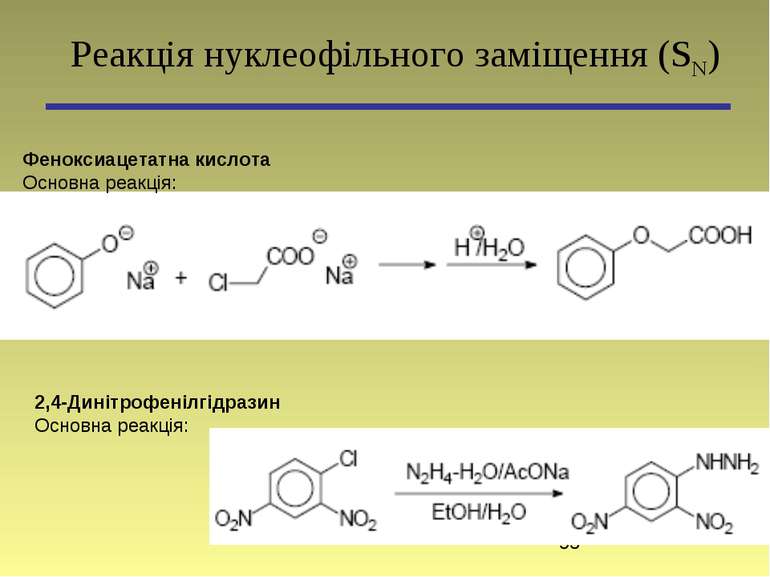
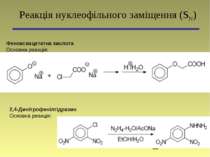
Феноксиацетатна кислота Основна реакція: Реакція нуклеофільного заміщення (SN) 2,4-Динітрофенілгідразин Основна реакція:
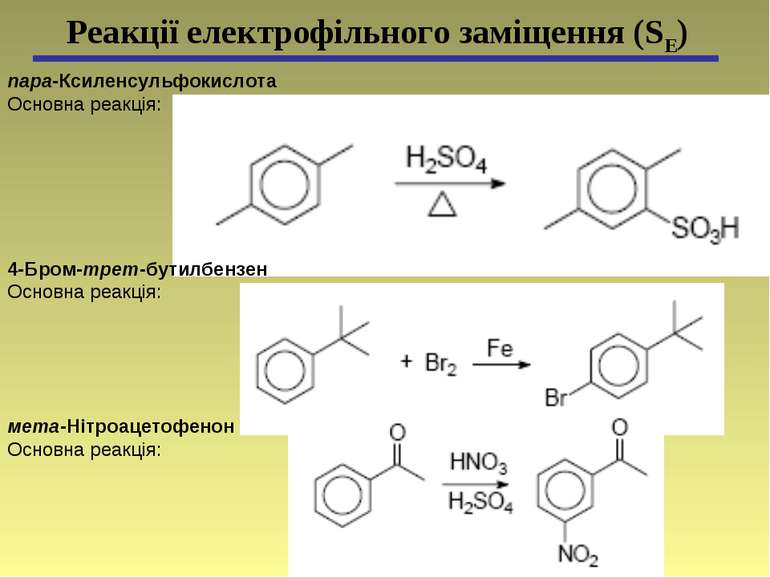
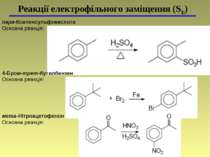
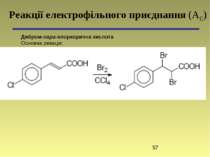
пара-Ксиленсульфокислота Основна реакція: Реакції електрофільного заміщення (SЕ) 4-Бром-трет-бутилбензен Основна реакція: мета-Нітроацетофенон Основна реакція:
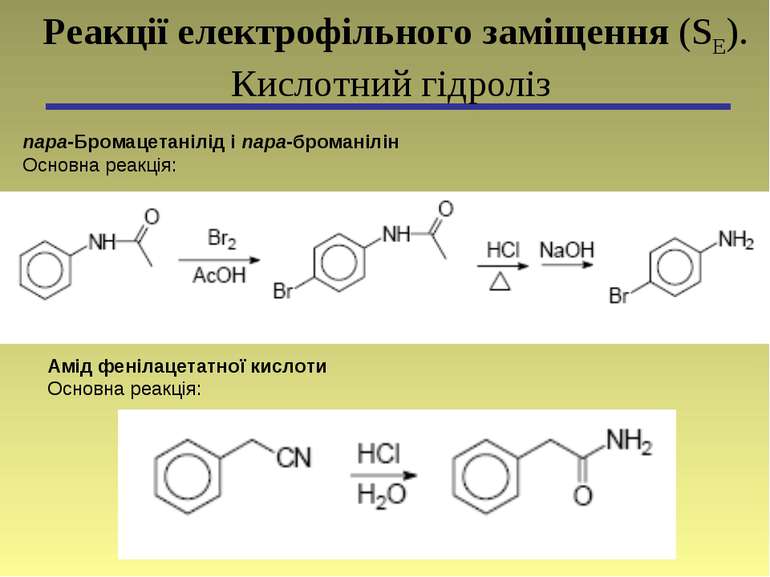
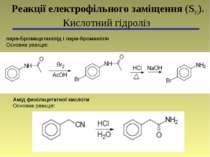
пара-Бромацетанілід і пара-броманілін Основна реакція: Реакції електрофільного заміщення (SЕ). Кислотний гідроліз Амід фенілацетатної кислоти Основна реакція:
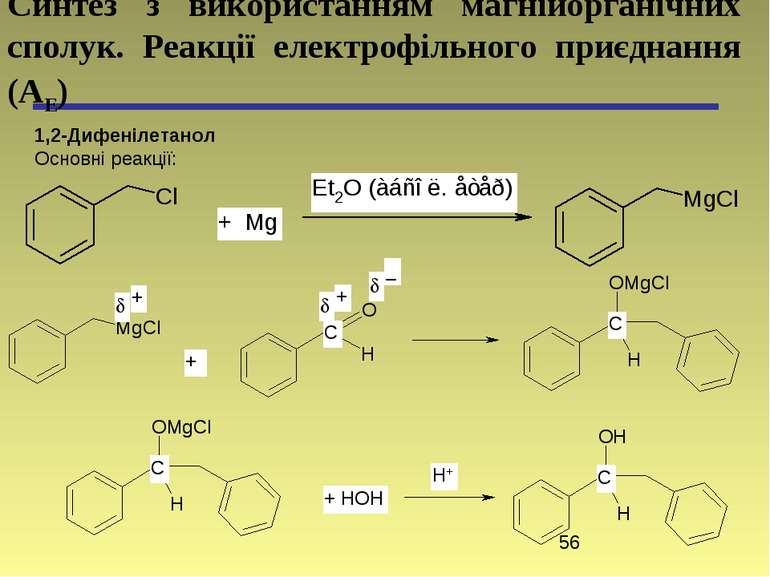
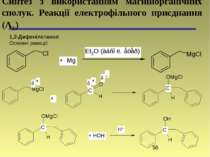
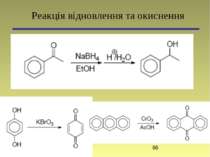
1,2-Дифенілетанол Основні реакції: Синтез з використанням магнійорганічних сполук. Реакції електрофільного приєднання (АЕ)
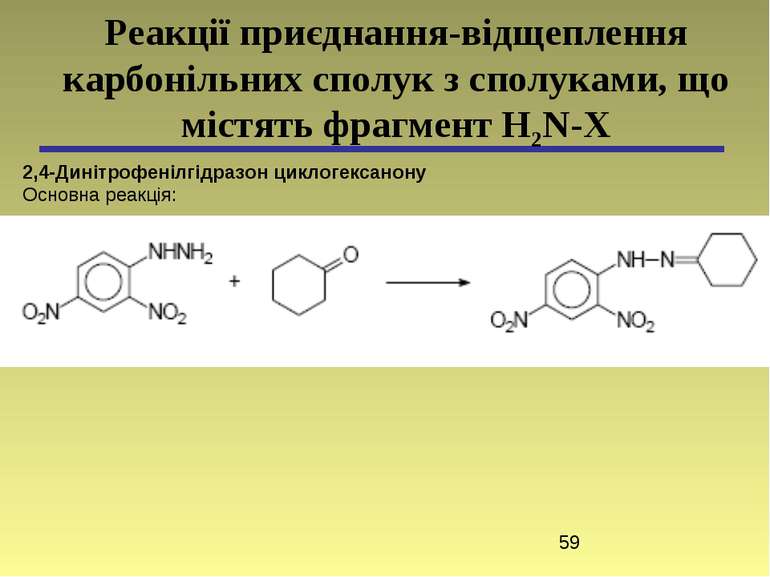
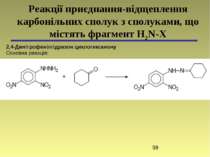
2,4-Динітрофенілгідразон циклогексанону Основна реакція: Реакції приєднання-відщеплення карбонільних сполук з сполуками, що містять фрагмент H2N-X
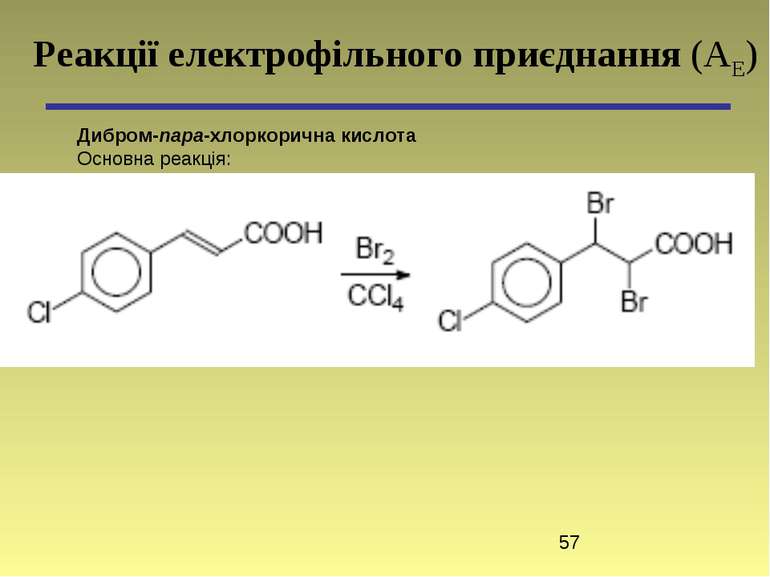
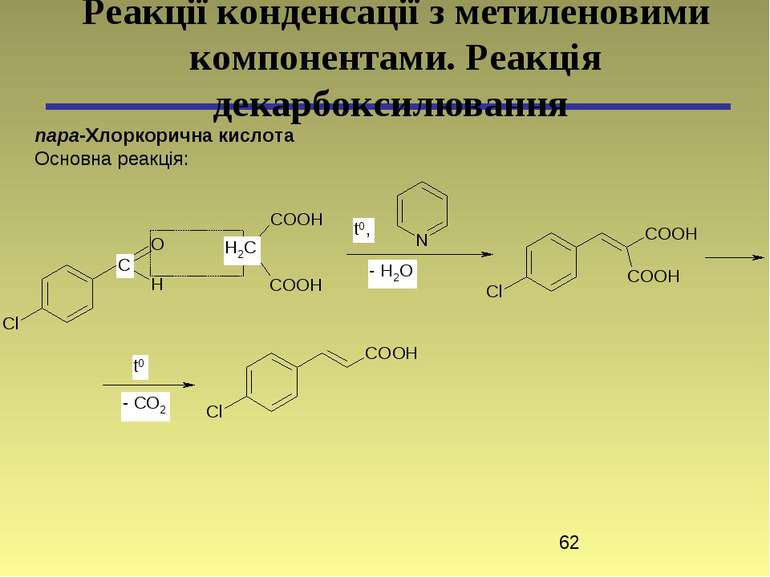
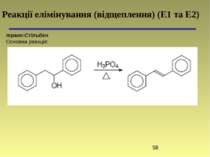
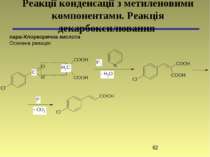
пара-Хлоркорична кислота Основна реакція: Реакції конденсації з метиленовими компонентами. Реакція декарбоксилювання
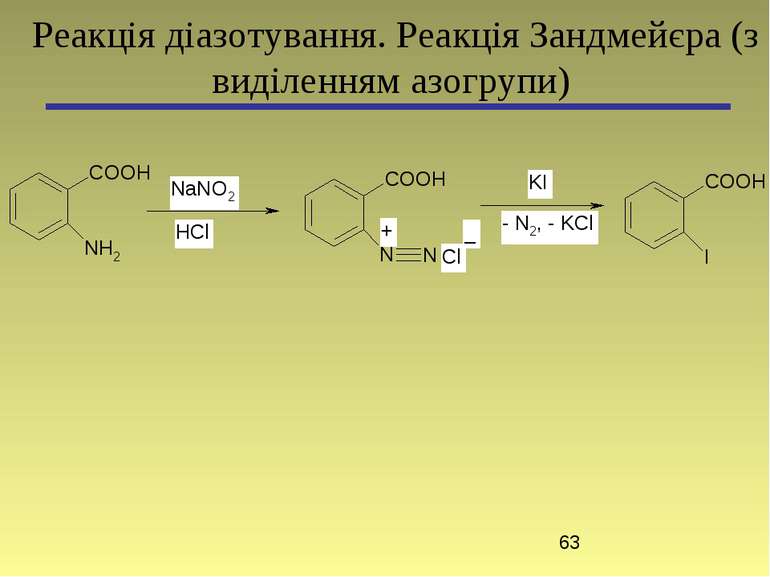
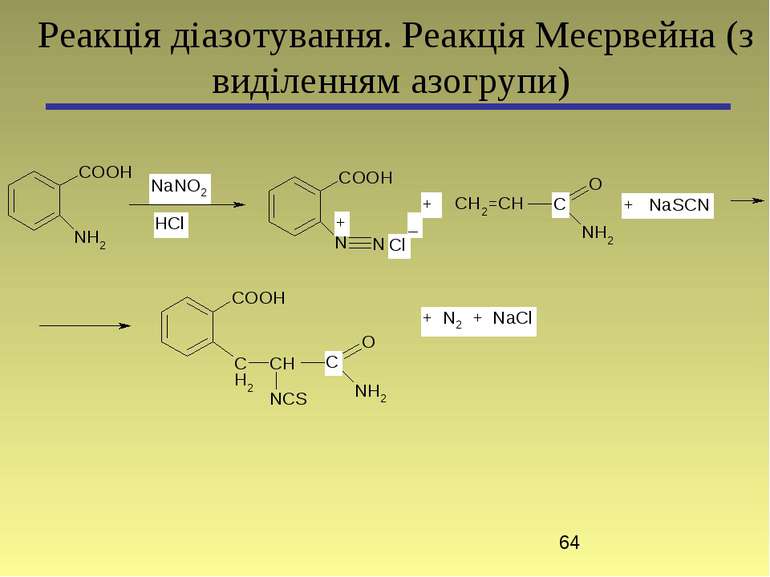
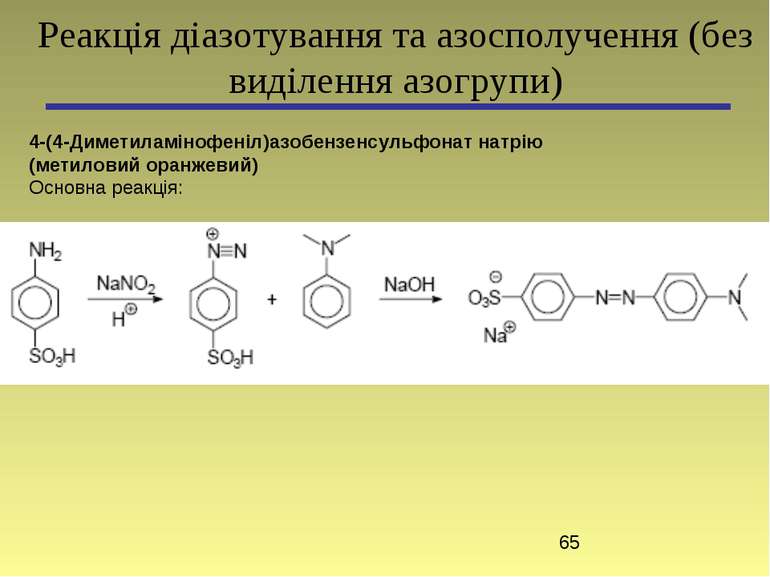
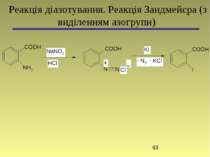
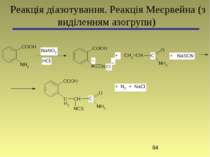
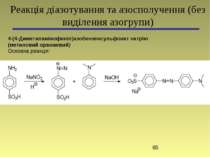
4-(4-Диметиламінофеніл)азобензенсульфонат натрію (метиловий оранжевий) Основна реакція: Реакція діазотування та азосполучення (без виділення азогрупи)
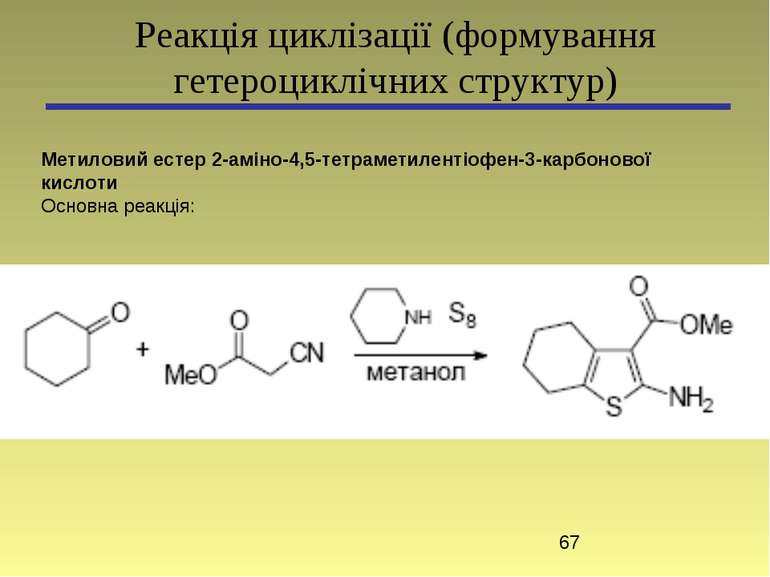
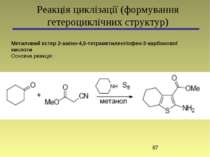
Реакція циклізації (формування гетероциклічних структур) Метиловий естер 2-аміно-4,5-тетраметилентіофен-3-карбонової кислоти Основна реакція:
Схожі презентації
Категорії