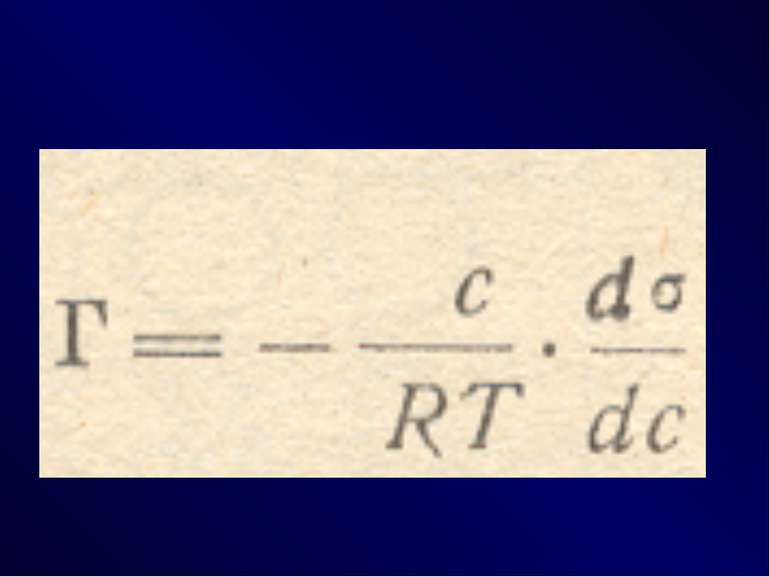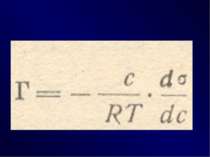Презентація на тему:
ФІЗИКО-ХІМІЯ ПОВЕРХНЕВИХ ЯВИЩ
Завантажити презентацію
ФІЗИКО-ХІМІЯ ПОВЕРХНЕВИХ ЯВИЩ
Завантажити презентаціюПрезентація по слайдам:
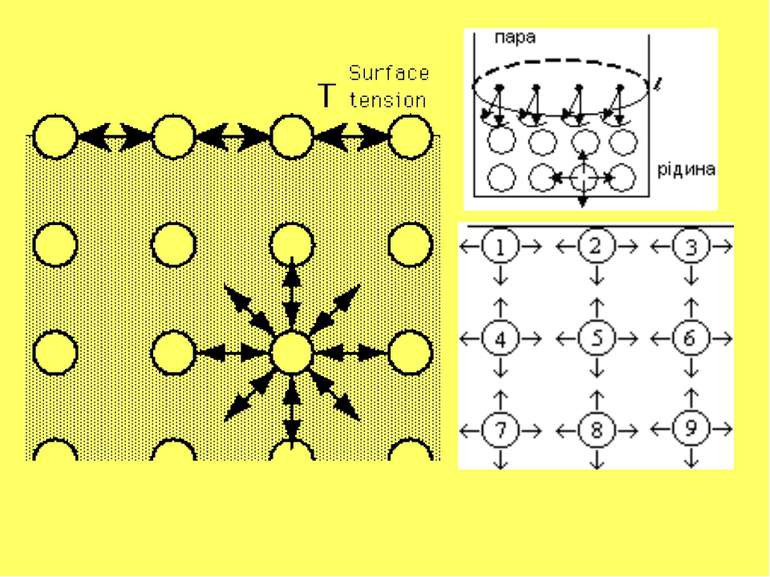
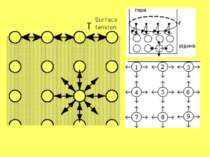
Поверхневий натяг - запас поверхневої енергії даної системи. Відношення надлишку вільної поверхневої енергії до одиниці поверхні S називається поверхневим натягом : G S =-------- S Величина поверхневого натягу дорівнює вільній енергії, що припадає на одиницю площі поверхні поділу фаз. Поверхневий натяг можна визначити як роботу при оборотному ізотермічному процесі, яку треба виконати для збільшення поверхні поділу фаз на 1 м2. Поверхневий натях вимірюється або в одиницях сили на одиницю площі (Н/м), або величиною енергії на одиницю поверхні (Дж/м2).
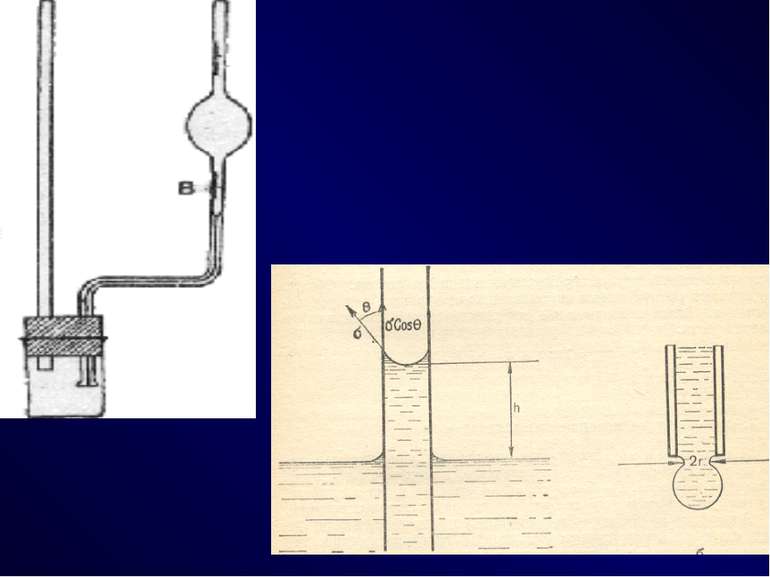
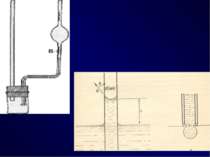
Методи визначення поверхневого натягу Метод капілярного підняття рівня рідини; Максимального тиску бульбашок газу на рідину (метод Рібендера); Підрахунку краплин (сталагмометричний метод); Відриву кільця; Втягування пластинки (метод Вільгельмі).
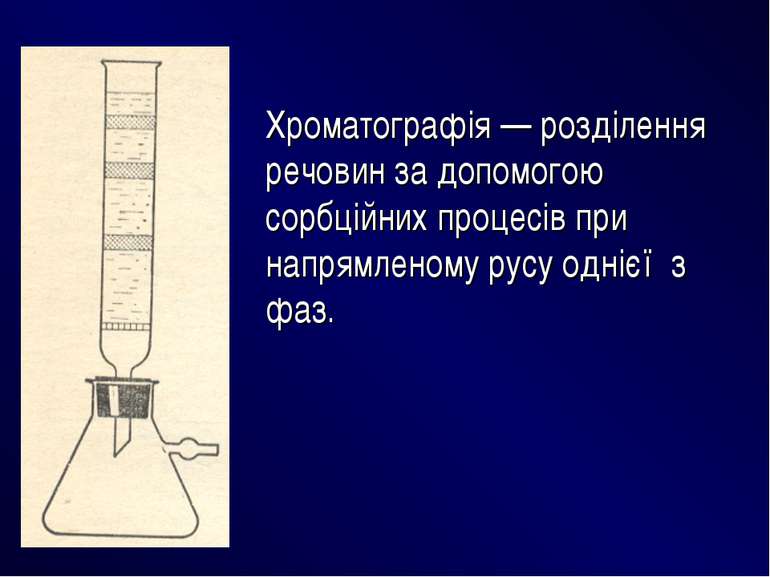
Визначення сталагмометричним методом ґрунтується на підрахунку числа крапель еталонної рідини (nо), що витікають з резервуара сталагмометра, поверхневий натяг її відомий рівний о , а потім число крапель розчину (nх) з невідомим поверхневим натягом ( х). Крапля, відривається від поверхні сталагмометра з силою, яка чисельно дорівнює величині поверхневого натягу рідини. Сталагмометр являє собою пряму трубку, яка має розширення (резервуар),вище і нижче якого нанесе мітки (А, В). Нижній кінець трубки - капіляр з горизонтальною добре відшліфованою поверхнею. При вимірюванні слід пам’ятати: вимірювання починають з розчину з меншою концентрацією до розчину з більшою концентрацією.
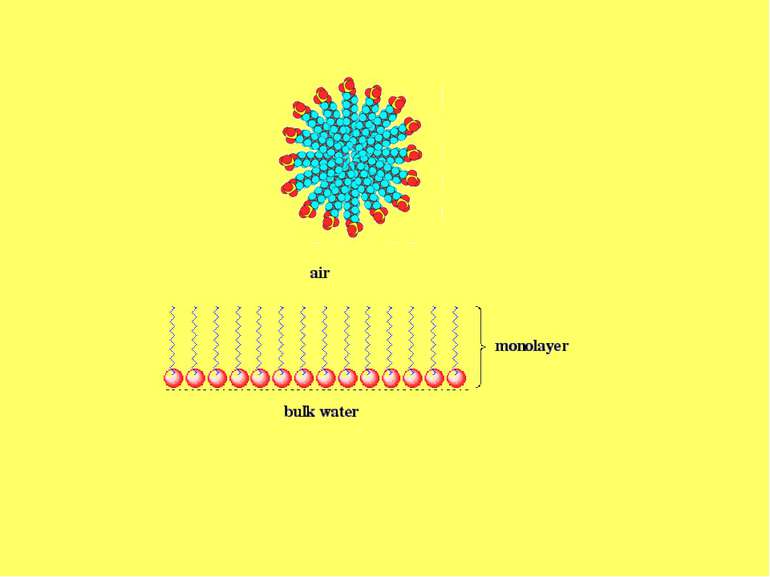
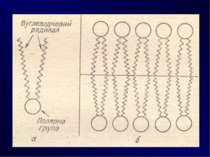
Схематично поверхневі явища можна поділити на дві групи Значення поверхневого натягу – величина постійна, а зменшення поверхневої енергії ΔGs обумовлено зменшенням поверхні поділу фаз ΔS. адгезія, змочування, когензія. Зменшення величина поверхневого натягу: адсорбція. Адсорбція – довільна зміна концентрації компонентів у поверхневому шарі сs, в стані рівноваги порівняно з концентрацією в об’ємній фазі сυ на межі поділу фаз розчин – газ, розчин – розчин.
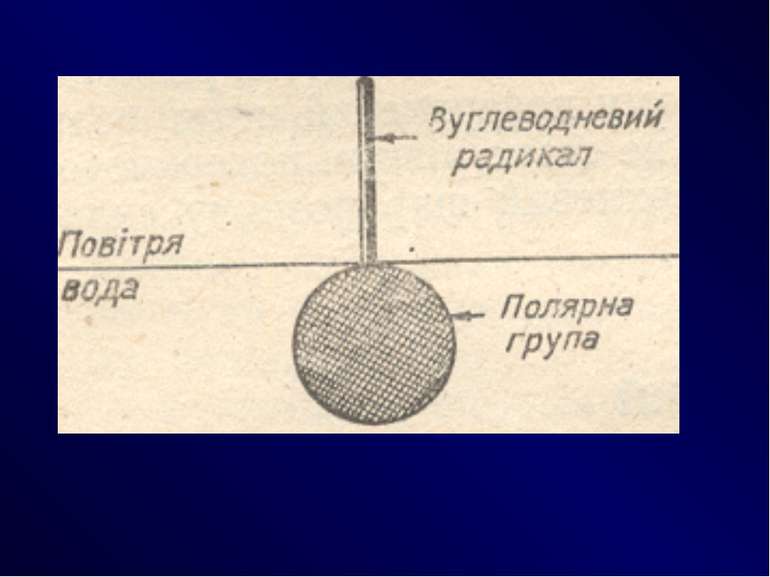
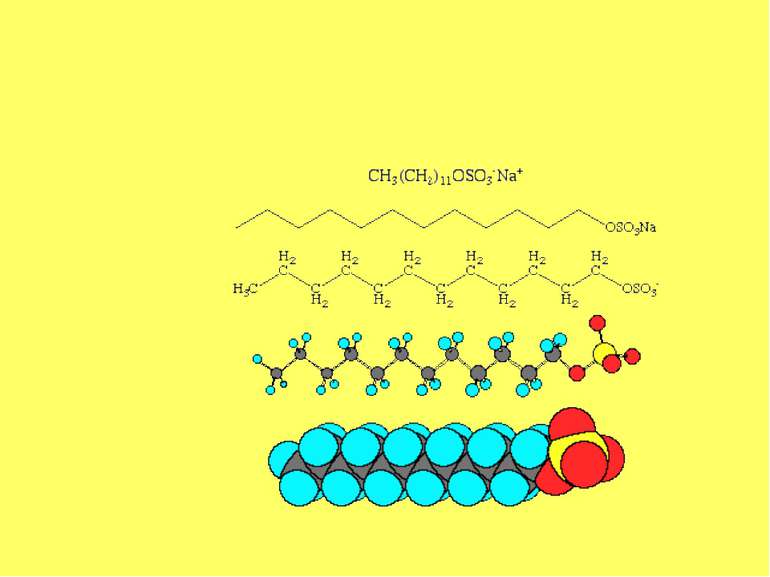
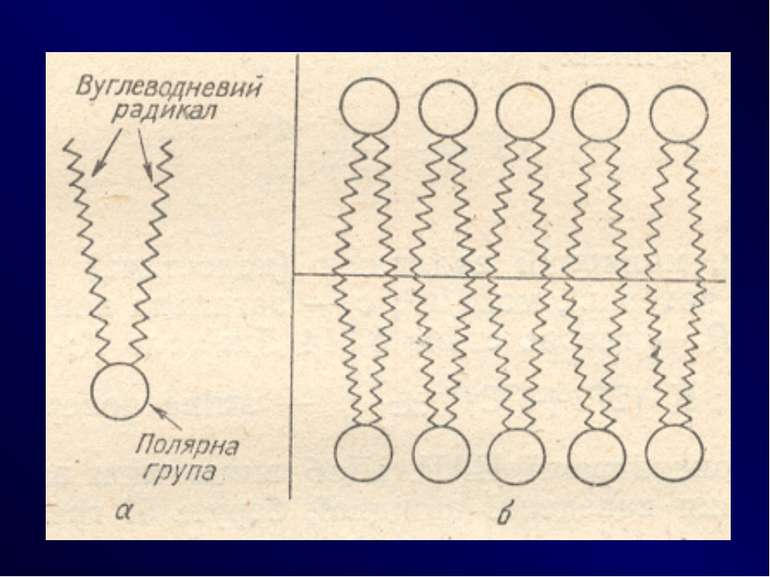
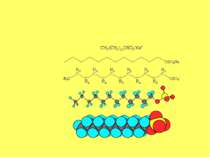
Поверхнево-активні – це речовини, які адсорбуються на поверхні поділу фаз та знижують міжфазову вільну поверхневу енергію (поверхневий натяг), ПАР поділяють на аніонні, катіонні, неіонні, амфолітні: Приклад таких ПАР — солі жирних кислот, аміни та їх похідні, ефіри, брілки. Поверхнево-інактивними називають речовини, які збільшують або залишають незмінним поверхневий натяг води. До поверхнево-інактивних речовин належать неорганічні кислоти, основи та їх солі.
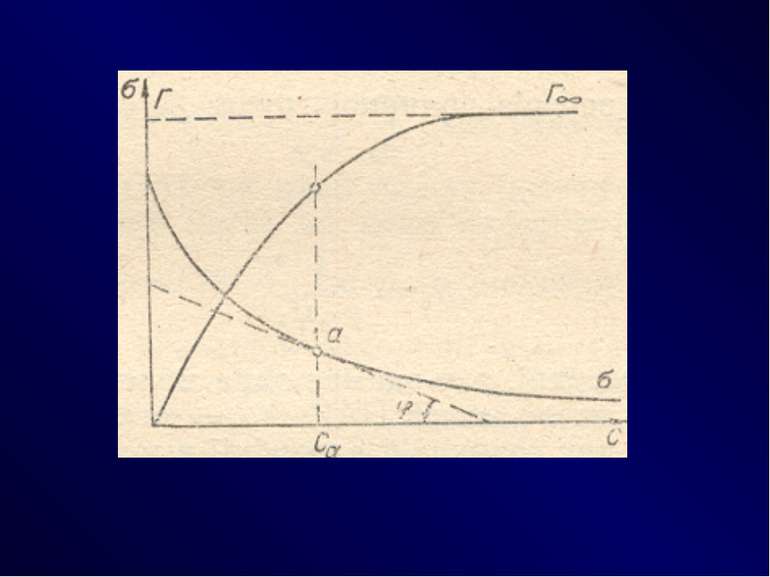
Правило Дюкло – Траубе поверхнева активність жирних кислот, спиртів та інших дифільних сполук у водних розчинах однакової концентрації збільшується у 3 — 3,5 рази зі збільшенням довжини вуглеводневого радикала на одну –СН2-групу, площа, яка припадає на одну молекулу максимально насиченого ПАР адсорбційного шару, залишається сталою в межах цього гомологічного ряду. Наприклад, для спиртів вона становить 0,25 нм2 , для кислот - 0,205 нм2
Поглинання газів i парів твердими тілами називають сорбцию. Якщо процес сорбції відбувається тільки на поверхні, то його називають адсорбціею. Якщо речовина, яка поглинається поверхнею, дифундує у середину поглинаючої речовини i розподіляється по об’єму, то таке явище називають абсорбцию. Тверде тіло, на поверхні якого відбувається адсорбція називати адсорбентом, а речовина яка адсорбується – адсорбтивом. Величину адсорбції визначається за допомогою співвідношення числа молекул n адсорбату, яке припадає на одиницю площу поверхні адсорбенту S м2, або маси m адсорбенту, (кг): Г= n/S, моль/м2, Г= n/m, (моль/кг). Процес, протилежний адсорбції, називають десорбцию. Десорбция – це відокремлення адсорбованах молекул a поверхні адсорбенту.
Правило Ребіндера: вирівнювання полярності: процес адсорбції відбувається в бік вирівнювання полярностей фаз, причому чим більша різниця полярностей, тим швидше відбувається цей процес. Міра полярності речовини діелектрична проникність е. Висновки з правила: 1 Полярні адсорбтиви краще адсорбуються на полярних адсорбентах – з неполярних розчинників. 2. Неполярні адсорбтиви краще адсорбуються на неполярних.адсорбентах із полярних розчинників. 3. Чим краще речовина розчиняється у розчиннику, тим гірше вона адсорбується.
Адсорбція іонів вибіркова адсорбція іонів на кристалах; еквівалентна або іонообмінна адсорбція. Вибіркова адсорбція визначається вибірковістю адсорбції катіона або аніона. Правила вибіркової адсорбції – Панета-Фаянса. Перше правило. Кристалічну гратку адсорбенту добудовують ті іони, що входять до її складу, ізоморфні з и іонами, утворюють з іонами цієї гратки – важкорозчинні сполуки. Друге правило. На твердій поверхні адсорбенту адсорбуються тільки ті іони, знак заряду яких протилежний знаку заряду поверхні адсорбенту.
Іонообмінна адсорбція - процес обману іонів, який відбувається в строго еквівалентних співвідношеннях i ложе бути описаний стехсометричним рівнянням. Адсорбенти, на яких відбувається процес еквівалентного обміну іонів називаються іонітами. Іоніти класифікують за різними ознаками: а) за походженням — на природні та синтетичні; б) за складом — на неорганічні та органічні; в) за знаком заряду обмінюваних іонів -на катіоніти, аніоніти та амфоліти.
Хроматографія — розділення речовин за допомогою сорбційних процесів при напрямленому русу однієї з фаз.
Схожі презентації
Категорії