Презентація на тему:
Органічна хімія
Завантажити презентацію
Органічна хімія
Завантажити презентаціюПрезентація по слайдам:
Зміст Спільні й відмінні ознаки органічних і неорганічних речовин. Причини багатоманітності сполук Карбону. Перші синтези органічних речовин. Основні положення теорії Бутлерова Номенклатура. Класифікація. Вуглеводні - найпростіші органічні сполуки. Вихід
Органічна хімія – хімія сполук Карбону. C, H, O, N – хімічні елементи з яких переважно утворюються органічні речовини, мають назву ЕЛЕМЕНТИ – ОРГАНОГЕНИ. Для неорганічних і органічних сполук Характерні ознаки спільними ознаками є: Утворення і реакції органічних речовин відбуваються за тими ж самими законами що й для неорганічних. Вони можуть взаємно перетворюва-тися. Органічні речовини є розчинні і є термостійкі.
Зміст Органічні сполуки об′єднують характерні ознаки, обумовлені елементарним складом, особливостями зв'язку між атомами та їх взаєморозташуванням у просторі:
Причини багатоманітності сполук Карбону Сполуки Карбону вивчаються у курсі органічної хімії. Тільки невелика кількість із сполук Карбону вважається неорганічними. Проте такий розподіл умовний і спирається більше на традиції, ніж на особливості будови і властивості сполук Карбону. Крім простих речовин, що утворює цей хімічний елемент (алмаз, графіт, карбін, букибол…), а також карбідів, оксидів карбону (ІІ) і (ІV), карбонілів металів ( наприклад Fe(CO)5 ), карбонатної кислоти і карбонатів, сірковуглецю, ціанідної ( HCN ), ціанатної ( HOCN ), тіоціанатної ( HSOCN ) кислот та їх солей, Карбон ( С* 1s2 2s1 2p3 ), виявляючи валентність – ІV ( >•< ) і ковалентно зв'язуючись з невеликим числом інших хімічних елементів (H, O, S, N, P, Hal, та де-які Me), утворює ще >30 млн.сполук, число яких постійно збільшується так як щорічно вилучають із природної сировини або синтезують ≈ 300 тис. нових речовин. Число сполук Карбону більш ніж в 50 раз перевищує число відомих сполук всіх інших хімічних елементів. Чому ?
1. Атоми Карбону здатні взаємодіяти між собою, утворюючи ланцюги \/\/\/\/\/\ \/\/\/\/\/\/\/\/\/\/\/\/\/\/\/ CH3-CH2-CH3 CH3- ( -CH2- )n -CH3 _ і кільця (цикли), / \ /_\ \__/ що різняться числом структурних одиниць – гомологи, приєднувати інші атоми або їх групи •- Cl /\_Br \_/\_OH 2. Існують ізомери – речовини, що мають одинаків хімічний склад, але різну будову і тому різні властивості. Наприклад: C2H6O H3C – O – CH3 H3C –CH2 – O-H Явища гомології та ізомерії є найголовнішими причинами численності органічних сполук
Особливості сполук Карбону вирізняють їх в окрему галузь хімічних знань. ХІМІЯ СПОЛУК КАРБОНУ почала розвиватись лише із середини ХІХ –го століття. Поняття «ОРГАНІЧНА ХІМІЯ» ввів в 1807році швед Йєнс Якоб БЕРЦЕЛІУС , як розділ науки, що вивчає СПОЛУКИ ВИЛУЧЕНІ ІЗ ОРГАНІЗМІВ, та 1824 року, його учень Фрідріх ВЕЛЕР (Німеччина), одержав штучним шляхом щавлеву кислоту – речовину рослинного походження, а в 1828 році, нагріваючи водний розчин амоній ціанату ( NH4OCN ) одержав сечовину – продукт життєдіяльності тваринних організмів: H2N NH2 NH3 + HOCN → \ / карбамід ( сечовина ) C = O Для загального визнання цього важливого відкриття знадобилося ще 20 років. Згодом було проведено ще ряд синтезів, які остаточно зруйнували тогочасне уявлення про вирішальну роль vis vitalis – особливу «життєву силу», як причину утворення органічних речовин. 1842 рік. Микола Миколайович Зінін, відновлюючи нітробензол, одержав анілін, який раніше вилучали лише із природних барвників: NO2 NH2 / 6 [ H ] \ H5C6 ---------------- → C6H5 1845 рік. Адольф Вільгельм Герман КОЛЬБЕ (німецький хімік) синтезував із неорганічних речовин оцтову кислоту: Cl Cl \ / C → CS2 → CCl4 → C = C → C Cl3 COOH → CH3 COOK → CH3 COOH / \ Етанова ( оцтова ) Cl Cl кисота 1854 рік. П′єр Ежен Марселен БЕРТЛО (Франція) синтезував жир: Гліцерин + Карбонова ---→ ЖИР кислота ( тригліцерид ) 1861 рік. Олександр Михайлович БУТЛЕРОВ (Росія) здійснив синтез цукристої речовини: H Н \ / 6 O = C ------------ → C6H12O6 Формальдегід Моносахарид 1882 рік. Іван Якович ГОРБАЧЕВСЬКИЙ (Україна) синтезував сечову кислоту: C5H4N4O3 В середині ХІХ –го століття, було визначено (Л.Гмелін, Г.Кольбе, Ф.Кекуле): ОРГАНІЧНА ХІМІЯ – ХІМІЯ СПОЛУК КАРБОНУ. Проте факти, що накопичувалися в тогочасній хімічній науці не мали чіткого пояснення з боку існувавших теорій (20-30р. ХІХст. – теорія «радикалів» - Берцеліус, Гей-Люссак, Велер; 40-50р. ХІХст. – теорія «типів» - Жерар).
ВЛАСТИВОСТІ РЕЧОВИН - ФУНКЦІЯ ЇХ СКЛАДУ І БУДОВИ. Центральне положення теорії є ЗАКОНОМ БУТЛЕРОВА і визначається як один із основних законів природознавства: 3. Атоми або групи атомів, що утворили молекулу, взаємно впливають один на одного, від цього залежить реакційна здатність молекули. 2. Властивості речовин залежать не лише від того які атоми і в якій кількості входять до складу молекул, а й від того, в якому порядку вони сполучені між собою, тобто від хімічної будови молекул. 1. В молекулах атоми сполучені один з одним в певній послідовності, відповідно до їх валентності. Такий порядок сполучення атомів в молекулах називають ХІМІЧНОЮ БУДОВОЮ. В 60-х роках ХІХ століття російський вчений БУТЛЕРОВ запропонував теорію, яка навела лад в органічній хімії і не втратила свого значення по цей час. Сутність основних положень цієї теорії зводиться до наступного: Нашчас
В наш час розвиток теорії відбувається за напрямками: _______________________ 1 ТЕОРІЯ БУДОВИ -----------------------→ Просторова будова _______________________ Форма і розмір молекул ║ \ 2 Хімічна будова \ ________ → Електронна будова Склад молекул, Розподіл електронної густини в молекулах порядок сполучення атомів в них
Н о м е н к л а т у р а ( лат. Nomenclatura – список імен або назв ) Називаючи органічні речовини, в наш час використовують: тривіальні назви (лат. trivialis – звичайний) – назви, що історично закріпилися за речовинами, широковживані назви; виробничі – для зручності користування на підприємствах або у випадках коли склад і будова речовин не можуть бути загальновідомими із вимог безпеки; для обчислювальної техніки – склад і будову речовин позначено числами та символами складені на основі номенклатур, що вийшли з користування (раціональна, женевська), що зустрічаються в літературі старих видань. Загальноприйнятими є назви на основі міжнародної систематичної номенклатури IUPAC ( International Union of Pure and Applied Chemistri ) - І Ю П А К. 1979 року. Назви будуються на основі назв насичених вуглеводнів ряду метану. Тому назви і формули вуглеводнів, а також, назви відповідних вуглеводневих радикалів ( найпростіших ), необхідно знати напам'ять. Назад
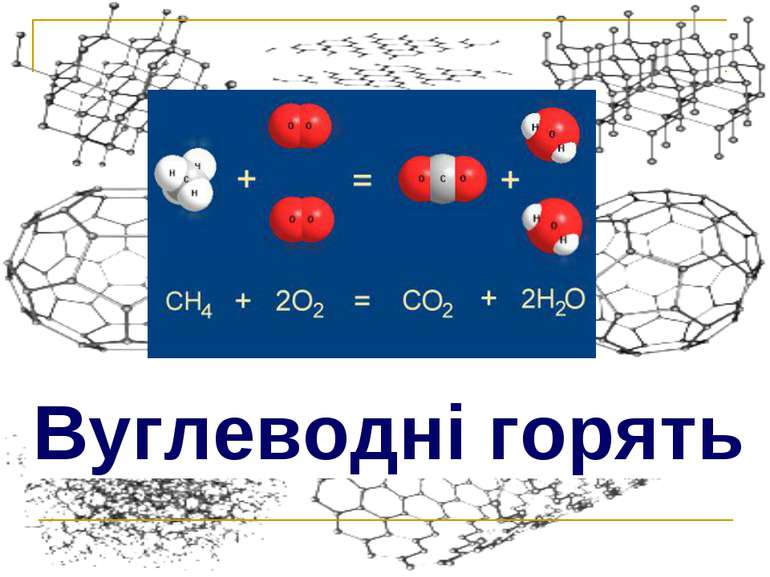
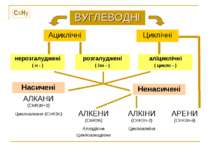
Вуглеводні - найпростіші органічні сполуки, до складу яких входять лише Карбон і Гідроген ( хімічні елементи, яким відповідають прості речовини вуглець і водень ). Вуглеводні, в молекулах яких атоми Карбону зв′язані простим ( одинарним ) зв'язком, а інші їх валентності насичені атомами Гідрогену, називають насичені. Алкани - насичені вуглеводні з відкритим ( незамкненим ) ланцюгом. Найпростіша органічна сполука - МЕТАН. СН4 – молекулярна (емпірична) формула. Газ. Без кольору. Без запаху. Без смаку. Погано розчинний у воді. « Рудничний газ » - утворюється в кам'яновугільних пластах. « Болотний газ » - виділяється при бактеріальному гнитті целюлози (деревини). Міститься в атмосфері Юпітеру, Сатурну… . Найважливіший компонент природного газу (80-98%), побіжний нафтовий газ містить 30-40% метану. Вміст метану в коксовому газі – 25% (об.) Межі вибухової суміші з О2 : 6-12%. Паливо для мартенівських, доменних, скловарних печей, побутових потреб. Сировина для отримання ацетилену, водню, сажі, галогенопохідних, синтез-газу … . Назад
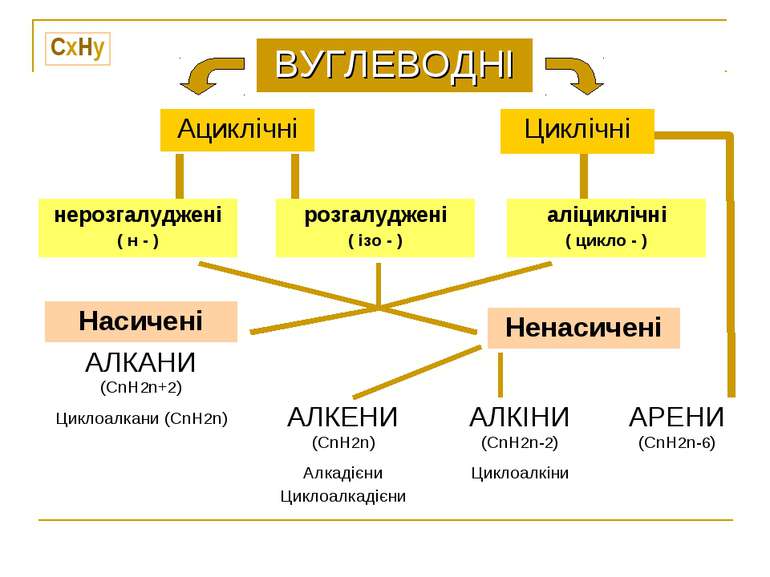
CxHy ВУГЛЕВОДНІ Ациклічні Циклічні нерозгалуджені ( н - ) розгалуджені ( ізо - ) аліциклічні ( цикло - ) Насичені АЛКАНИ (CnH2n+2) Циклоалкани (CnH2n) Ненасичені АЛКЕНИ (CnH2n) Алкадієни Циклоалкадієни АЛКІНИ (CnH2n-2) Циклоалкіни АРЕНИ (CnH2n-6)
Титул Джерела 1.Алексинский В.Н. Занимательные опыты по химии. М.: Просвещение, 1980. 2.Чернобельская Г.М.,Чертков И.Н. Химия. М.:Медицина, 1985. 3.Хомченко Г.П.Пособие по химии для поступающих в ВУЗы. М.:Новая Волна, 2002. 4.Николаев Л.А. Неорганическая химия. М.: Просвещение, 1982. 5.Глинка Н.Л. Общая химия. Л.: Химия, 1983. 6.Добрынина Н.А. Биологическая роль некоторых химических элементов. //Химия в школе. 1991. №2. С.6 - 13. 7.Химия: 8 - 11 кл.: Справочные материалы / Сост. В.В.Еремин, Е.А.Еремина. - М. : Дрофа, 1995. - 104 с. 8.Фадеев Г.Н. Пятая вертикаль. М. : Просвещение, 1973. 9. Химия. Приложение к газете "Первое сентября". 2001, № 44; 1997, № 6,8; 2003, № 14; 2000, № 19, № 20. 10.http://www.alhimik.ru/teleclass/pril/berzelius.shtml 11.http://www.litera.ru/stixiya/authors/lomonosov.html 12.http://www.sever.ru/~kominter/element/elem02.htm 13.http://www.prazdniki.ru/person/1/386/ 14.http://www.peoples.ru/science/chemistry/lavoisier/ 15.http://www.peoples.ru/science/chemistry/agricola
Схожі презентації
Категорії