Презентація на тему:
ОРГАНIЗАЦIЯ ОПТОВОЇ РЕАЛIЗАЦIЇ ЛIКАРСЬКИХ ЗАСОБIВ
Завантажити презентацію
ОРГАНIЗАЦIЯ ОПТОВОЇ РЕАЛIЗАЦIЇ ЛIКАРСЬКИХ ЗАСОБIВ
Завантажити презентаціюПрезентація по слайдам:
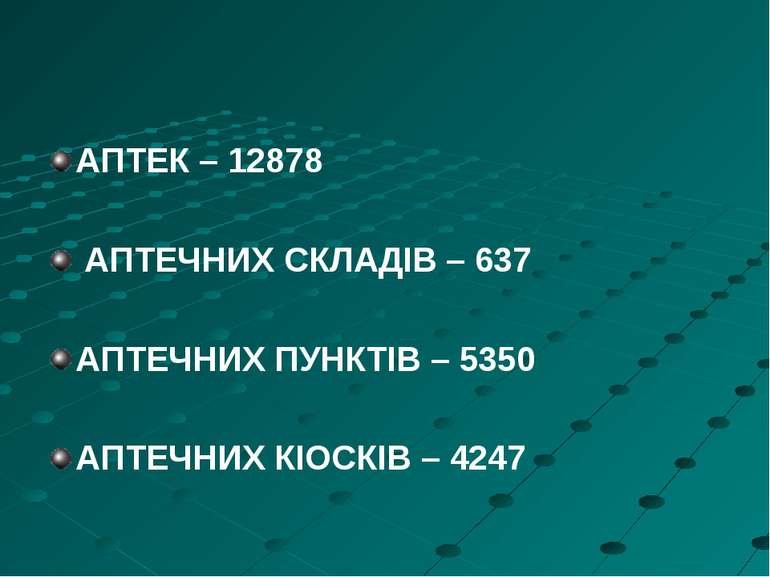
Оптова торгівля лікарськими засобами (дистрибуцiя) - діяльність з придбання лікарських засобів у виробників лікарських засобів або інших суб'єктів господарювання, зберігання та продажу лікарських засобів з аптечних складів (баз) іншим суб'єктам оптової або роздрібної торгівлі лікарськими засобами, які отримали на це відповідні ліцензії, та безпосередньо лікувально-профілактичним закладам і виробникам лікарських засобів. Оптова торгівля лікарськими засобами здійснюється лише через аптечні бази (склади). Аптечні склади (бази) - заклади охорони здоров'я, основне завдання яких полягає в забезпеченні лікарськими засобами інших суб'єктів оптової або роздрібної торгівлі, закладів охорони здоров'я та виробників лікарських засобів шляхом здійснення ними оптової торгівлі.
Суб'єкт господарювання, який провадить діяльність з оптової торгівлі лікарськими засобами, повинен вирiшувати наступнi завдання: мати приміщення, устатковання та обладнання для забезпечення належного зберігання лікарських засобів, у тому числі під час транспортування і торгівлі ними; мати достатню кількість кваліфікованих працівників, але не менше двох спеціалістів з вищою фармацевтичною освітою; забезпечувати дотримання визначених МОЗ загальних та специфічних умов зберігання лікарських засобів відповідно до їх складу, фізико-хімічних властивостей, впливу навколишнього середовища та інших факторів; забезпечити обов'язковий мінімальний асортимент лікарських засобів, що визначається МОЗ; мати план термінових дій для відкликання у разі потреби лікарських засобів з продажу; забезпечити належну схоронність лікарських засобів; зберігати протягом не менше трьох років документи, що засвідчують факт купівлі або продажу із зазначенням дати, назви, кількості та серії отриманого та поставленого лікарського засобу, інформації про покупця (постачальника) та реквізитів його ліцензії; визначити уповноважену особу; забезпечувати справність усіх засобів вимірювання шляхом проведення їх калібрування та регулярної метрологічної повірки; мати паспорт аптечного складу (бази );
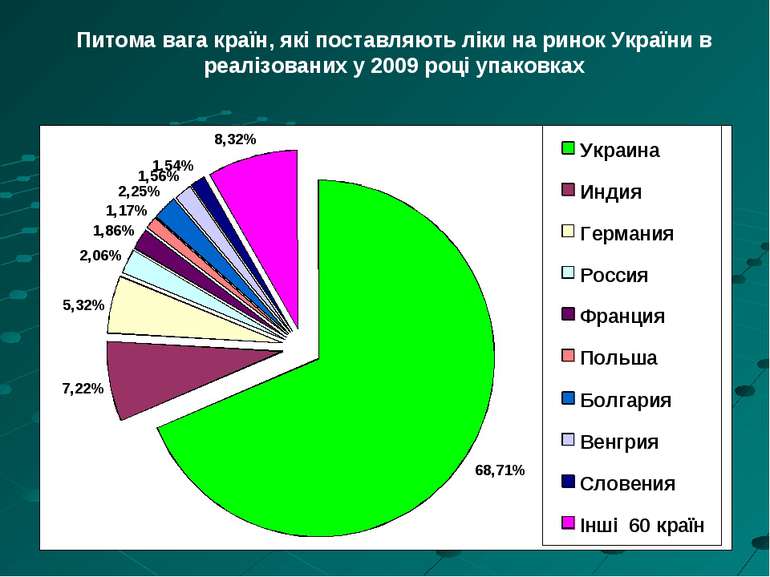
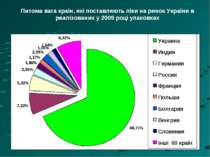
Питома вага країн, які поставляють ліки на ринок України в реалізованих у 2009 році упаковках
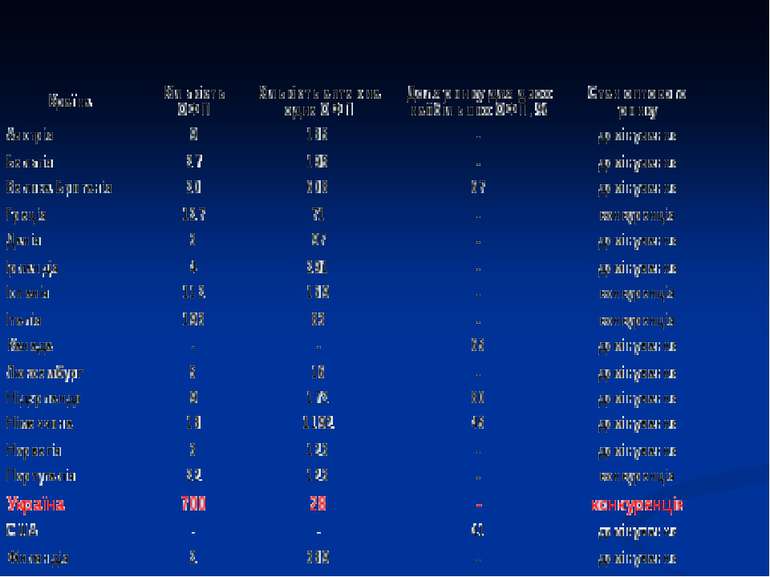
* 13 892 (за кількістю реєстраційних посвідчень станом на 01.09.2010р.) 3020 вітчизняні 971 In bulk 1165 субстанції 403 Фасовані з In bulk 11353 ГЛЗ 8333 іноземні 850 іноземні 961 іноземні 101 іноземні 121 вітчизняні 204 вітчизняні 302 вітчизняні
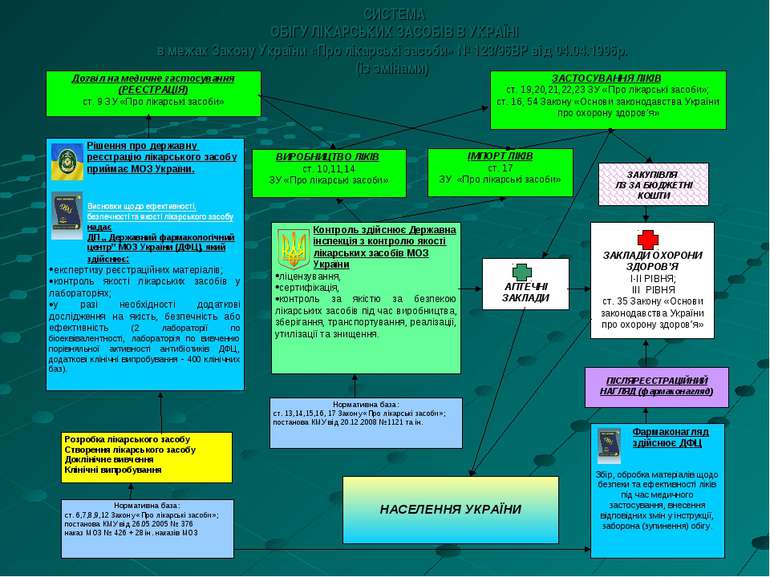
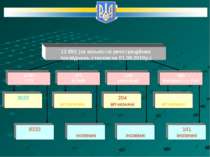
СИСТЕМА ОБІГУ ЛІКАРСЬКИХ ЗАСОБІВ В УКРАЇНІ в межах Закону України «Про лікарські засоби» № 123/96ВР від 04.04.1996р. (із змінами) Дозвіл на медичне застосування (РЕЄСТРАЦІЯ) ст. 9 ЗУ «Про лікарські засоби» Нормативна база: ст. 6,7,8,9,12 Закону «Про лікарські засоби»; постанова КМУ від 26.05.2005 № 376 наказ МОЗ № 426 + 28 ін. наказів МОЗ ВИРОБНИЦТВО ЛІКІВ ст. 10,11,14 ЗУ «Про лікарські засоби» Контроль здійснює Державна інспекція з контролю якості лікарських засобів МОЗ України ліцензування, сертифікація, контроль за якістю за безпекою лікарських засобів під час виробництва, зберігання, транспортування, реалізації, утилізації та знищення. Нормативна база: ст. 13,14,15,16, 17 Закону «Про лікарські засоби»; постанова КМУ від 20.12.2008 №1121 та ін. ЗАСТОСУВАННЯ ЛІКІВ ст. 19,20,21,22,23 ЗУ «Про лікарські засоби»; ст. 16, 54 Закону «Основи законодавства України про охорону здоров’я» \\ АПТЕЧНІ ЗАКЛАДИ ЗАКЛАДИ ОХОРОНИ ЗДОРОВ’Я І-ІІ РІВНЯ; ІІІ РІВНЯ ст. 35 Закону «Основи законодавства України про охорону здоров’я» ЗАКУПІВЛЯ ЛЗ ЗА БЮДЖЕТНІ КОШТИ Фармаконагляд здійснює ДФЦ Збір, обробка матеріалів щодо безпеки та ефективності ліків під час медичного застосування, внесення відповідних змін у інструкції, заборона (зупинення) обігу. Розробка лікарського засобу Створення лікарського засобу Доклінічне вивчення Клінічні випробування ІМПОРТ ЛІКІВ ст. 17 ЗУ «Про лікарські засоби» НАСЕЛЕННЯ УКРАЇНИ ПІСЛЯРЕЄСТРАЦІЙНИЙ НАГЛЯД (фармаконагляд) Рішення про державну реєстрацію лікарського засобу приймає МОЗ України. Висновки щодо ефективності, безпечності та якості лікарського засобу надає ДП „ Державний фармакологічний центр” МОЗ України (ДФЦ), який здійснює: експертизу реєстраційних матеріалів; контроль якості лікарських засобів у лабораторіях; у разі необхідності додаткові дослідження на якість, безпечність або ефективність (2 лабораторії по біоеквівалентності, лабораторія по вивченню порівняльної активності антибіотиків ДФЦ, додаткові клінічні випробування - 400 клінічних баз).
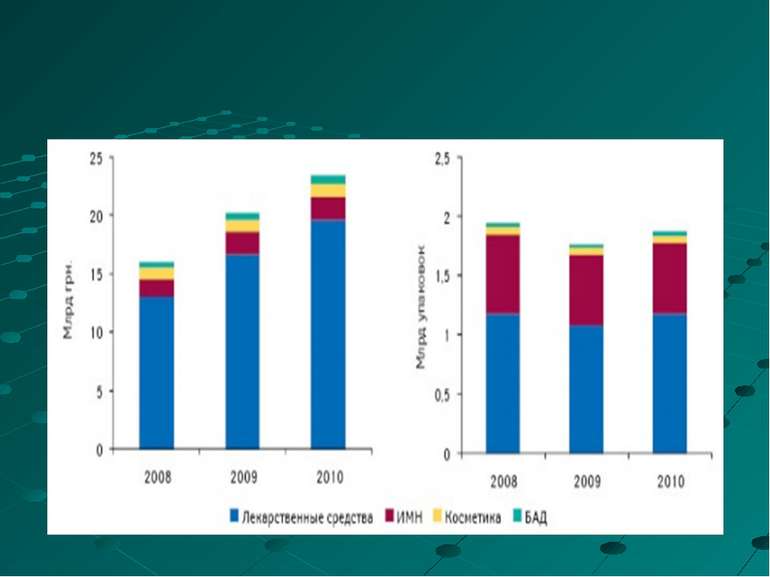
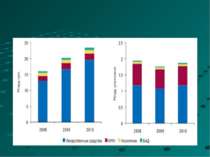
2010 р. обсяг ринку аптечних продаж препаратів збільшився в порівнянні з 2009 р. майже на 18% в грошовому і на 9% в натуральному виразі і склав 19,7 млрд грн. за 1,2 млрд упаковок. В доларовому еквіваленті цей показник узбільшився майже на 16% і досяг 2,5 млрд дол.
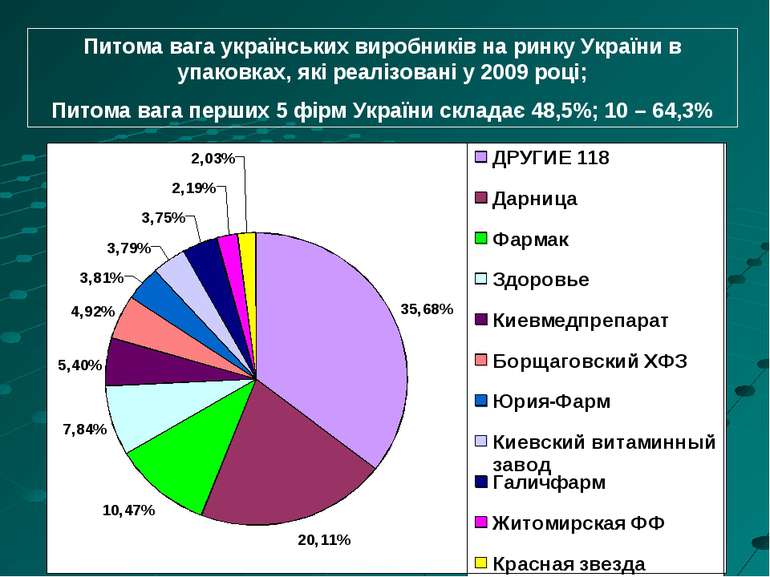
Питома вага українських виробників на ринку України в упаковках, які реалізовані у 2009 році; Питома вага перших 5 фірм України складає 48,5%; 10 – 64,3%
Топ-5 дистрибуторів ЛЗ 1БаДМ (Дніпропетровськ) 2Оптима-Фарм (Київ) 3Альба Україна (Бориспіль) 4Вента (Дніпропетровськ) 5Фра-М (Донецьк)
Аптечні склади (бази) повинні мати у своєму складі: виробничі приміщення: окремі приміщення, площі або зони для приймання і зберігання лікарських засобів та їх відпуску /відвантаження, допоміжних матеріалів і тари загальною площею не менше ніж 250 кв.м. До виробничих належать приміщення (зони), в яких приймаються, зберігаються лікарські засоби, приміщення (зони) комплектації та відпуску/відвантаження лікарських засобів (експедиційна), приміщення (зони) зберігання допоміжних матеріалів і тари, контролю якості лікарських засобів, зберігання карантинної продукції.
Аптечні склади (бази) розміщуються: в окремо розташованих спеціально улаштованих будинках в ізольованих приміщеннях у громадських будинках В допоміжних будинках промислових підприємств на будь-якому поверсі за умови влаштування вантажно-розвантажувальної площадки для під'їзду машин (рампа з навісом тощо) поза фронтом вікон приміщень з постійним перебуванням людей. Аптечні склади (бази) повинні мати у своєму складі: виробничі приміщення: площі (зони) для приймання і зберігання лікарських засобів та їх відпуску, допоміжних матеріалів і тари загальною площею не менше ніж 250 кв.м. мінімальний набір побутових і допоміжних приміщень: кімнату персоналу (0,75 кв.м на одного працівника, але не менше 8 кв.м), вбиральню (за розрахунком, але не менше 2 кв.м) приміщення для зберігання предметів прибирання (4 кв.м) або шафу залежно від потужності закладу
У письмових стандартних робочих методиках (стандартних операційних процедурах) повинні бути описані будь-які роботи, що можуть вплинути на якість лікарських засобів або якість дистриб'юторської діяльності: отримання і перевірка поставок, зберігання лікарських засобів, очищення і обслуговування приміщень (включаючи боротьбу з шкідливими комахами і тваринами), реєстрація умов зберігання, безпечне зберігання як запасів на складі, так і транзитних консигнаційних поставок, які взято із призначеного для продажу запасу, ведення і зберігання документації, у тому числі документів щодо замовлень лікарських засобів іншими суб'єктами господарювання, повернення лікарських засобів, плани відкликання.
Склад, розташування виробничих приміщень (зон) та їх площа повинні забезпечувати послідовність технологічного процесу (приймання, контроль якості, зберігання, комплектація та відпуск лікарських засобів); обладнані окремі площі (зони) або приміщення для зберігання лікарських засобів, які потребують особливих умов зберігання (сильнодіючі, отруйні, наркотичні, психотропні, імунобіологічні, термолабільні, вогненебезпечні, легкозаймисті, вибухонебезпечні препарати, лікарська рослинна та інша сировина).
Лікарські засоби у виробничих складських приміщеннях повинні зберігатися на стелажах, піддонах підтоварниках у шафах холодильному іншому спеціальному обладнанні для забезпечення умов зберігання лікарських засобів відповідно до діючих вимог
Закупівля лікарських засобів може здійснюватись лише у суб'єктів господарювання, що мають ліцензію на виробництво лікарських засобів у суб'єктів господарювання, що мають ліцензію на оптову торгівлю лікарськими засобами. у документах мають бути відображені всі акти купівлі і продажу із зазначенням дати купівлі або постачання, назви і кількості отриманого або поставленого лікарського засобу, назви і адреси постачальника або одержувача вантажу. Складські приміщення повинні бути забезпечені засобами вимірювальної техніки температури та відносної вологості для кожного виробничого приміщення повинні бути забезпечені реєстрація та контроль температури і відносної вологості справність усіх засобів вимірювальної техніки та проведення їх регулярної метрологічної повірки.
Спеціальні вимоги до складських приміщень Складські приміщення для зберігання вогненебезпечних та вибухонебезпечних речовин повинні бути ізольовані, захищені від світла прямих сонячних променів, атмосферних опадів та ґрунтових вод. Розміщення таких приміщень у підвалах, напівпідвалах та в цокольних поверхах не допускається. Зони (приміщення) приймання лікарських засобів та відпуску мають бути відокремлені від зон зберігання і забезпечувати належний захист поставлених лікарських засобів від негоди під час вантажних робіт Лікарські засоби, які потребують особливих умов зберігання, повинні бути негайно ідентифіковані і розміщені у відповідних приміщеннях (зонах) зберігання згідно з вимогами чинного законодавства. За наявності на аптечній базі (складі) імунобіологічних препаратів загальний об'єм холодильного обладнання повинен забезпечувати відповідно до діючих вимог зберігання всієї кількості зазначених ліків, що містяться на базі (складі).
Вимоги до санітарного режиму складу (бази) матеріали для покриття стін, стелі, підлоги виробничих приміщень аптечної бази (складу) повинні допускати вологе прибирання з використанням дезінфікувальних засобів. поверхня виробничого устаткування як ззовні, так і всередині повинна бути гладкою, виготовленою із матеріалів, стійких до дії лікарських засобів, витримувати обробку дезінфікувальними розчинами. устаткування виробничих приміщень повинно розташуватися таким чином, щоб не залишалися місця, недоступні для прибирання. Приміщення та устаткування підлягає прибиранню згідно з письмовими інструкціями, затвердженими суб'єктом господарювання. Для прибирання різних приміщень (виробничі, службово-побутові приміщення, вбиральня) повинен бути виділений окремий інвентар (відра, тази, щітки, ганчір'я), який маркується. Зберігання його здійснюється в спеціально визначеному місці (кімната, шафа) окремо за призначенням. Інвентар для прибирання вбиральні зберігається окремо. Приміщення та устаткування кімнати персоналу аптечної бази (складу) повинні забезпечити утримання та схоронність особистого та спеціального одягу відповідно до вимог санітарно-епідемічного режиму, а також можливість уживання їжі та відпочинку (обладнані шафами для одягу, холодильником, меблями).
Ліцензіат повинен забезпечити: закупівлю та реалізацію лише лікарських засобів, які зареєстровані згідно із законодавством України; додержання визначених виробником умов зберігання лікарських засобів (в т.ч. під час транспортування) та схоронність лікарських засобів; виключення можливості контамінації лікарських засобів; функціонування системи виявлення будь-якої продукції, що не відповідає встановленим вимогам (технологічної документації, аналітично-нормативної документації, діючих стандартів якості), та ефективної процедури відкликання.
Система якості ліцензіата, що здійснює оптову реалізацію ліків, повинна забезпечувати: постачання замовнику лікарських засобів у строк, погоджений між постачальником і замовником. належний рівень якості лікарських засобів без будь-яких змін їх властивостей до роздрібної торгівлі. система простежуваності якості лікарських засобів, створена ліцензіатом, повинна гарантувати виявлення будь-якої неякісної та фальсифікованої продукції. ліцензіат повинен мати достатню (залежно від потужності закладу) кількість кваліфікованих працівників. призначення принаймні однієї Уповноваженої особи, яка має відповідні повноваження і несе відповідальність за створення, впровадження та функціонування системи якості. Уповноважена особа повинна особисто виконувати свої обов'язки, мати вищу фармацевтичну освіту та стаж роботи за спеціальністю не менше двох років. підвищення кваліфікації персоналу, діяльність якого може вплинути на якість продукції, факти підвищення кваліфікації необхідно протоколювати.
Відпуск (реалізація) лікарських засобів зі складу може проводитись: суб'єктам господарювання, що мають ліцензії на оптову торгівлю лікарськими засобами; суб'єктам господарювання, що мають ліцензії на виробництво лікарських засобів (для використання у виробництві); суб'єктам господарювання, що мають ліцензії на роздрібну торгівлю лікарськими засобами; безпосередньо закладам охорони здоров'я.
Під час транспортування лікарських засобів повинен забезпечити умови зберігання лікарських засобів відповідно до вимог, встановлених виробником. транспортний засіб для перевезення лікарських засобів повинен забезпечувати дотримання визначених виробником умов зберігання ліків і дозволяти проведення систематичного вологого прибирання з використанням дезінфікуючих засобів. забороняється транспортування лікарських засобів громадським транспортом, рейсовими автобусами міжміського сполучення, залізничним транспортом для пасажирських перевезень, у поштових відправленнях.
В системі аптечних продаж вітчизняні лікарські засоби складають біля 28% за номенклатурою та біля 20% в грошах. В Україні налічується 141 фармацевтичні підприємства. Намітилась тенденція до створення спільних з іноземними партнерами підприємств («Максвел»). Підприємства виготовляють лікарські засоби, вироби медичного призначення, лікарські субстанції та продукцію in balk. Система управління та організації роботи оптових фармацевтичних підприємств повинна гарантувати, що ними: - закувовуються і реалізуються лікарські засоби, зареєстровані згідно з чинним законодавством України; - постійно дотримуються умови зберігання ліків, включаючи період транспортування; -виключення контамінації лікарських засобів іншими ліками і навпаки; - здійснюється відповідна оборотність складованих лікарських засобів; - ліки зберігаються в належних умовах та у приміщеннях, що охороняються.
Міжнародні стандарти "Належна практика дистрибуції" (GDP). В Європейському Союзi була прийнята Директива Ради ЄС вiд 31 березня 1992 р. «Про правила оптової реалiзацiї лiкарських препаратiв»(92/95). Ця директива визначає порядок оптової реалізації в державах ЄС лікарських препаратів для людини.
Належна практика зберігання фармацевтичної продукції. Керівництво GSP Керівництво включає ряд вимог до: Персоналу; Приміщень та обладнання; Зберігання; Поверненню; Відправці; Транспортуванні продукції; Відкликанню продукції.
Цінова політика оптових фармацевтичних підприємств Поправки на умови платежів (отримання авансу, надання кредиту, прискорення платежів, розрахунки готівкою) Знижки за кількість товару, який купують Функціональні знижки Бонусні знижки Сезонні знижки Спеціальні знижки
Пристосування ціни передбачаєурахування змін у мікро- і макросередовищі маркетингу, за якими керівництво фірми повинно ретельно стежити і шукати відповіді на багато запитань: • Чи змінюють ціни конкуренти? • Чи може це суттєво вплинути на обсяги збуту продукції фірми? • Як фірмі слід реагувати на ініціативні зміни цін конкурентами? • Чому падає попит на товар? • Чи зможе деяке зниження ціни виправити становище? • Як урахувати в ціновій політиці вплив інфляційних процесів, особливо при укладанні довготермінових угод на поставки? • Які зміни відбулися у державній політиці регулювання цін?
При закупiвлi лiкiв необхiдно приймати до уваги наступнi показники: Ознайомленнiсть (iнформацi) лiкарiв i хворих про лiки Оптова (митна) цiна на лiки Рiвень торгових нацiнок оптового ланцюга або торгового посередника Умови постачання, транспортнi витрати Умови та термiни оплати за поставленi лiки Керує складом спеціаліст із вищою фармацевтичною освітою.Вiн виконує наступнi обов’язки: організовує ефективну діяльність закладу; створює необхідні умови для зберігання медикаментів, інших медичних виробів відповідно до їх властивостей і вимог Державної фармакопеї; забезпечує лікарськими засобами та іншими товарами медичного призначення аптечні заклади, лікувально-профілактичні установи, інших оптових покупців; проводить експертно-імпортні операції за міжнародними правилами торгівлі медичними товарами; організовує роботу з добору, розтановки і використання фармацевтичних кадрів, своєчасне проходження медичного огляду працівниками бази, забезпечує своєчасне підвищення їх кваліфікації; створює належні виробничі умови, забезпечує додержання співробітниками правил внутрішнього трудового розпорядку, охорони праці складських робіт та протипожежного захисту; аналізує показники роботи закладу, вживає заходів щодо їх оптимації, видає відповідні директивні документи з цього питання.
Усі поставки лікарських засобів обов'язково супроводжуються документами, за якими можливо встановити дату їх продажу і придбання, дату їх продажу і придбання, назву та лікарську форму серію і кількість лікарських засобів назву та адресу виробника, покупця і продавця лікарських засобів із зазначенням реквізитів ліцензій перед початком прийому необхідно звернути увагу на термін придатності (ЛЗ).
В залежності від меж термінів придатності продукція поділяється на ту, що: скоро псується (від 6 до 96 год.) зберігається короткочасно (від 12 год. до 30 діб) зберігається довго: з обмеженим терміном придатності (обмеженим вважається термін придатності до 2 років); зберігається довго: без обмеження терміну придатності ( може зберігати придатні властивості на протязі кількох років). умовами надходження обмежені терміни придатності, що зменшилися, у відповідності з якими (ЛЗ) повинні відвантажуватися виробником з таким розрахунком, щоб до моменту їх відвантажування залишилось не менше 80% терміну придатності, зазначеного на етикетці, для бактеріальних препаратів не менше 50% терміну придатності. При відвантажуванні вказаної продукції із складу в роздрібній сітці і (ЛПУ) термін придатності, що залишився, повинен бути не менше 60%, а для бактеріальних препаратів – не менше 40% терміну придатності, вказаного на етикетці. Медична продукція із терміном зберігання більше двох років може відвантажуватися покупцю, якщо термін придатності, що залишився, складає не менше 18 міс. Надходження продукції з меншим терміном придатності може проводитися через дозвіл покупця, що обмежений договірними умовами.
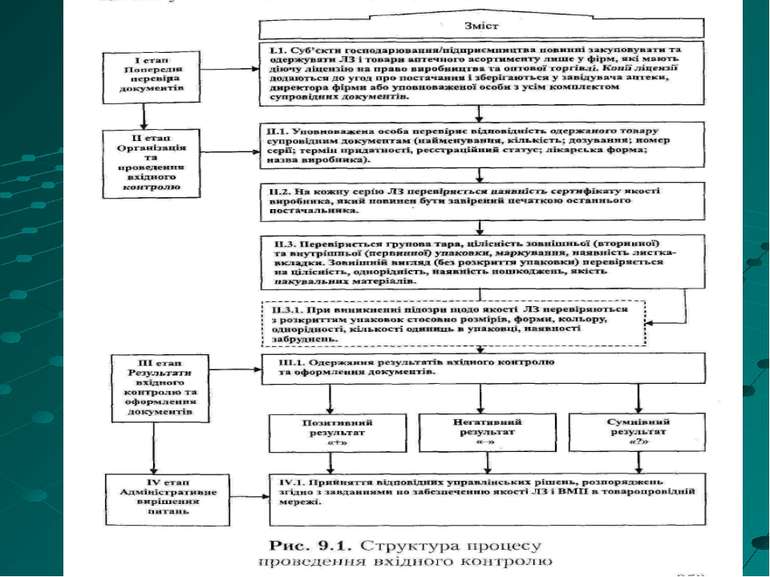
Головними обов'язками вповноваженої особи на аптечному складi (базi) є: перевірка лікарських засобів, які надходять до суб'єкта, і супровідних документів - накладних (з обов'язковим зазначенням найменування, дозування, лікарської форми, номера серії, кількості, назви виробника); сертифікатів якості, що видані виробниками; відомостей про державну реєстрацію лікарського засобу; оформлення висновку вхідного контролю якості лікарських засобів.; ведення реєстру лікарських засобів, які надійшли до суб'єкта господарської діяльності, щоб мати змогу відстежити джерело одержання кожної неякісної або фальсифікованої партії лікарських засобів; ведення реєстру лікарських засобів, які реалізуються суб'єктом господарської діяльності, щоб мати змогу відкликати виявлені партії фальсифікованих або неякісних лікарських засобів; перевірка наявності на складі неякісних та фальсифікованих серій лікарських засобів згідно з інформацією територіальної інспекції; надання територіальній інспекції відомостей про виявлені неякісні та фальсифіковані лікарські засоби або про які є підозра щодо їх якості. Зупинення торгівлі та поміщення у карантин таких лікарських засобів.
, , , . . Уповноважена особа перевіряє відповідність одержаних лікарських засобів супровідним документам щодо кількості дозування номерів серій термінів придатності реєстраційного статусу найменування лікарської форми виробника Обов'язковій лабораторній перевірці на відповідність їх якості показникам АНД, чинної в Україні, підлягають такі групи лікарських засобів: Субстанції, що використовуються в аптеках для виготовлення парентеральних лікарських форм і ліків, що застосовуються в очній практиці (за всіма показниками АНД). Наркотичні лікарські засоби, психотропні речовини і прекурсори, які належать до відповідної категорії згідно з Переліком наркотичних засобів, психотропних речовин і прекурсорів, і підлягають спеціальному контролю відповідно до чинного законодавства України. Лікарські засоби, що використовуються для наркозу, у тому числі інгаляційного (за винятком кисню і закису азоту). Рентгеноконтрастні, у тому числі барію сульфат. Протитуберкульозні (у тому числі комбіновані), що містять рифампіцин, ізоніазид, етамбутол, піразинамід.
Групова тара, зовнішня (вторинна) та внутрішня (первинна) упаковки, маркування, листок-вкладка, зовнішній вигляд без розкриття упаковки перевіряються на цілісність однорідність наявність пошкоджень якість пакувальних матеріалів при потребі лікарські засоби перевіряються з розкриттям упаковок щодо розмірів, форми, кольору, однорідності, кількості одиниць в упаковці, наявності забруднень
Дії уповноваженої особи після проведення вхідного контролю: При позитивному результаті вхідного контролю уповноважена особа передає на реалізацію партії лікарських засобів. При негативному результаті вповноважена особа складає акт про виявлені дефекти, який є підставою для повернення серії постачальнику. Копія акта подається в територіальну інспекцію, яка після проведення додаткової перевірки та вибіркового аналізу вживає заходів щодо інформування інших суб'єктів про виявлені неякісні або фальсифіковані лікарські засоби та контролює дії постачальника щодо знищення, утилізації або повернення (у разі неякісних лікарських засобів) виробнику. У разі виникнення сумніву щодо якості уповноважена особа відбирає зразки сумнівних лікарських засобів та направляє їх у територіальну інспекцію для проходження лабораторних досліджень. На час проведення таких досліджень, до остаточного вирішення питання про їх якість, партії сумнівних лікарських засобів перебувають у карантині ізольовано від інших лікарських засобів з позначенням "Торгівля заборонена до окремого розпорядження".
Адміністративні і побутові приміщення складiв включають: кабінет завідуючого аптечним складом; приміщення оперативного облiку; туалет; гардеробну. Виробничi примiщення включають: примiщення прийому товару; примiщення вхiдного контролю товару, вiдбору проб; карантинне примiщення; примiщення зберiгання товару; примiщення комплектацiї товару.
Керує складом спеціаліст із вищою фармацевтичною освітою.Вiн виконує наступнi обов’язки: організовує ефективну діяльність закладу; створює необхідні умови для зберігання медикаментів, інших медичних виробів відповідно до їх властивостей і вимог Державної фармакопеї; забезпечує лікарськими засобами та іншими товарами медичного призначення аптечні заклади, лікувально-профілактичні установи, інших оптових покупців; проводить експертно-імпортні операції за міжнародними правилами торгівлі медичними товарами; організовує роботу з добору, розтановки і використання фармацевтичних кадрів, своєчасне проходження медичного огляду працівниками бази, забезпечує своєчасне підвищення їх кваліфікації; створює належні виробничі умови, забезпечує додержання співробітниками правил внутрішнього трудового розпорядку, охорони праці складських робіт та протипожежного захисту; аналізує показники роботи закладу, вживає заходів щодо їх оптимації, видає відповідні директивні документи з цього питання.
Схожі презентації
Категорії