Презентація на тему:
"Загальна характеристика оксидів"
Завантажити презентацію
"Загальна характеристика оксидів"
Завантажити презентаціюПрезентація по слайдам:
8 клас: Тема”Загальна характеристика оксидів.” Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна
Мета. На прикладі найпростіших за складом і будовою хімічних сполук почати вивчення основних класів неорганічних сполук. Закріпити навички складання формул оксидів та називати їх. Поглибити знання про реакції сполучення, їх роль в утворенні оксидів.Розібрати властивості та роль оксидів в природі та нашому житті
Цілі: Склад оксидів та назви Знаходження в природі Фізичні властивості Хімічні властивості Застосування Значення для життєдіяльності
Амфотерність Амфотерність –здатність елементів виявляти подвійні властивості. Be Al Fe Zn Приклади Al2O3 Fe2O3 ZnO
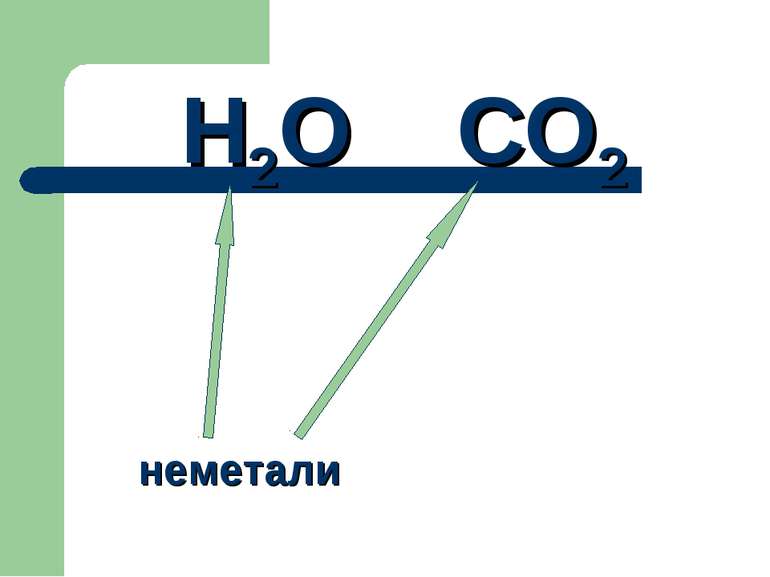
Фізичні властивості кислотних оксидів. Можуть бути: Твердими( SiO2,P2 O5) Рідкими (H2O) Газоподібні (СO2, SO2,NO)
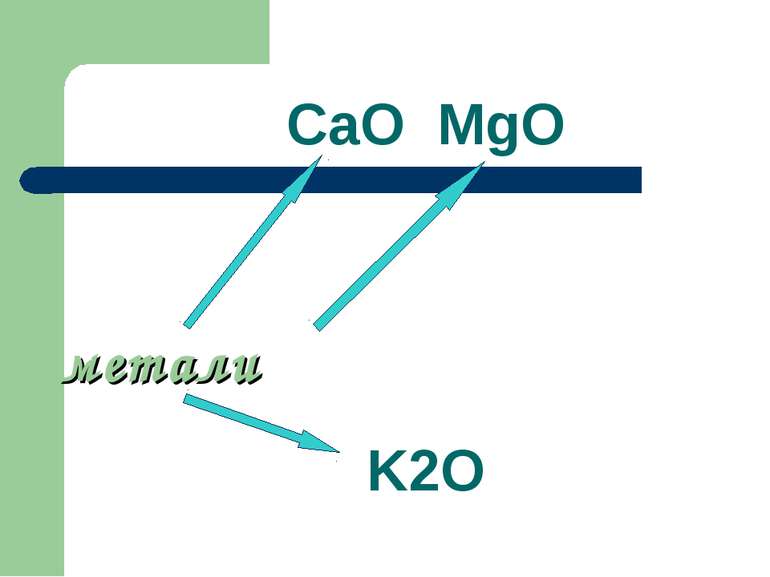
Хімічні властивості основних оксидів Взаємодіють з водою з утворенням основ CaO+H2O=Ca(OH)2 Na2O+H2O=2 NaOH
Хімічні властивості кислотних оксидів Взаємодіють з водою з утворенням кислот СO2+H2O=H2CO3 SO3+H2O=H2SO4
Основні оксиди взаємодіють з кислотами СaO+ 2HCl=CaCl2+H2O Na2O+H2SO4=Na2SO4+H2O Утворюється сіль та вода
Кислотні оксиди взаємодіють з основами СO2+2KOH=K2CO3+H2O SO3+2NaOH=Na2SO4+H2O Утворюється сіль та вода
«Первое начало и сущность всего – …» Фалес из Милета (VI в. до н.э.) Вгадай що знаходиться в першій шкатулці,?
Вода Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті. Вода – джерело життя на Землі, сировина для промисловості, джерело енергії, чинник, що визначає погоду, клімат Землі. Три чверті земної поверхні вкрито водою, що утворює океани, моря, ріки та озера.
Вуглекислий газ До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об’ємна частка якого в повітрі становить 0,3 %.
«…На рукомойнике моем позеленела медь, Но так играет луч на нем, что весело глядеть…» А. Ахматова А що в останій шкатулці ?
Складіть формули оксидів елементів Магнію Калію Алюмінію Фосфору(V) Хлору (VII ) Заліза (III) карбону (IV) сульфуру (VI) Випишіть в два стовбчика оксиди металів і неметалів.
Розрахуйте: 1.Массу 1літру вуглекислого газау(н.у.). 2.Об’єм 3,4г амміаку.(н.у.)(NH3) 3.Скільки міститься молекул в 2 г хлороводню?(HCl)
Схожі презентації
Категорії