Презентація на тему:
Сполуки неметалічних елементів з Гідрогеном. Склад і фізичні властивості хлороводню, добування в лабораторії, взаємодія з водою. Якісна реакція на хлорид-іон.
Завантажити презентацію
Сполуки неметалічних елементів з Гідрогеном. Склад і фізичні властивості хлороводню, добування в лабораторії, взаємодія з водою. Якісна реакція на хлорид-іон.
Завантажити презентаціюПрезентація по слайдам:
Сполуки неметалічних елементів з Гідрогеном. Склад і фізичні властивості хлороводню, добування в лабораторії, взаємодія з водою. Якісна реакція на хлорид-іон.
Мета. Ознайомити з фізичними та хімічними властивостями хлороводню та хлоридної кислоти, з якісною реакцією на хлоридну кислоту та її солі. З’ясувати галузі застосування хлоридної кислоти. Демонстрація № 1. Якісна реакція на хлорид-іон. Лабораторний дослід № 2. Виявлення хлорид-іонів у розчині.
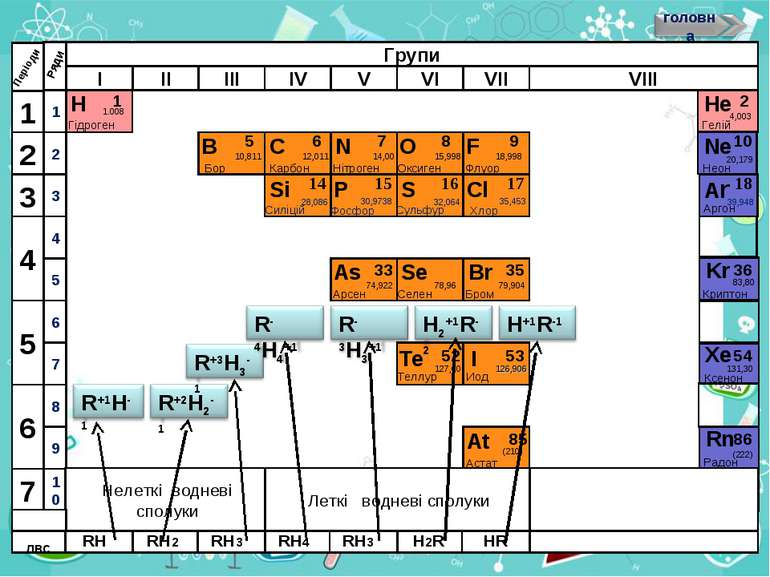
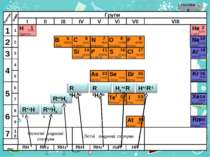
Н Гідроген 1 1.008 Періоди B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Карбон Нітроген Арсен Селен Теллур Флуор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 Нелеткі водневі сполуки Леткі водневі сполуки ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелій Неон RH4 RH3 H2R HR RH RH2 RH3
Леткі водневі сполуки — це бінарні сполуки Гідрогену з неметалічними елементами. Атоми в їх молекулах сполучені ковалентними зв’язками.
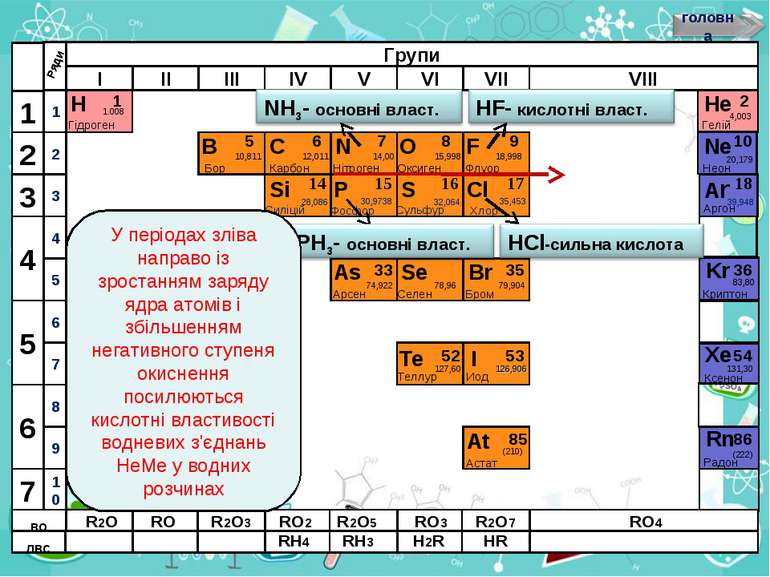
Н Гідроген 1 1.008 B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Карбон Нітроген Арсен Селен Теллур Флуор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелій Неон RH4 RH3 H2R HR ВО R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 У періодах зліва направо із зростанням заряду ядра атомів і збільшенням негативного ступеня окиснення посилюються кислотні властивості водневих з'єднань НеМе у водних розчинах
Н О Н + Н F Н Н O Н + F [ ] -2 -1 -1 : : : : : : : : : : : : : : : : чи скорочено Н2О-2 + НF-1 Н3О+ + F-1 +
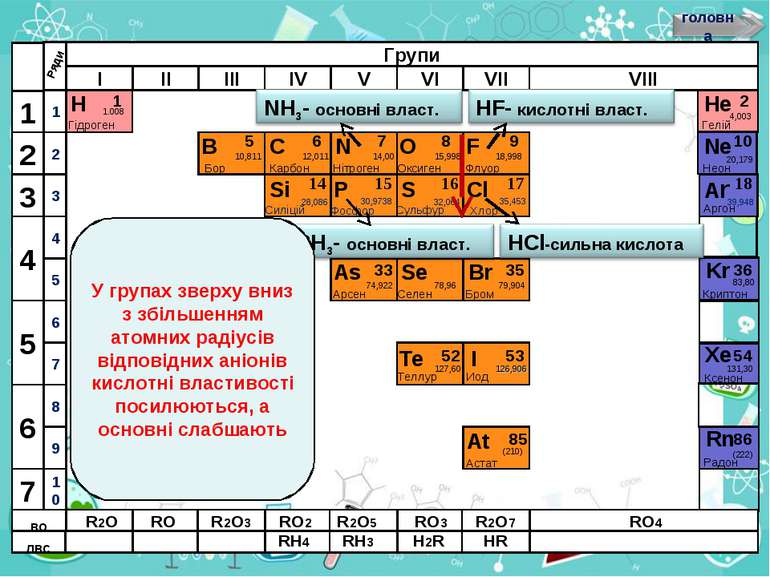
Н Гідроген 1 1.008 B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Карбон Нітроген Арсен Селен Теллур Флуор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелій Неон RH4 RH3 H2R HR ВО R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 У групах зверху вниз з збільшенням атомних радіусів відповідних аніонів кислотні властивості посилюються, а основні слабшають
Н О Н + Н N Н Н N Н + [ ] -2 -3 : : : : : : : : : : : : : : : : чи скорочено Н2О-2 + Н3N-3 NН4+ + OH- + Н Н [ ] - Н Н О
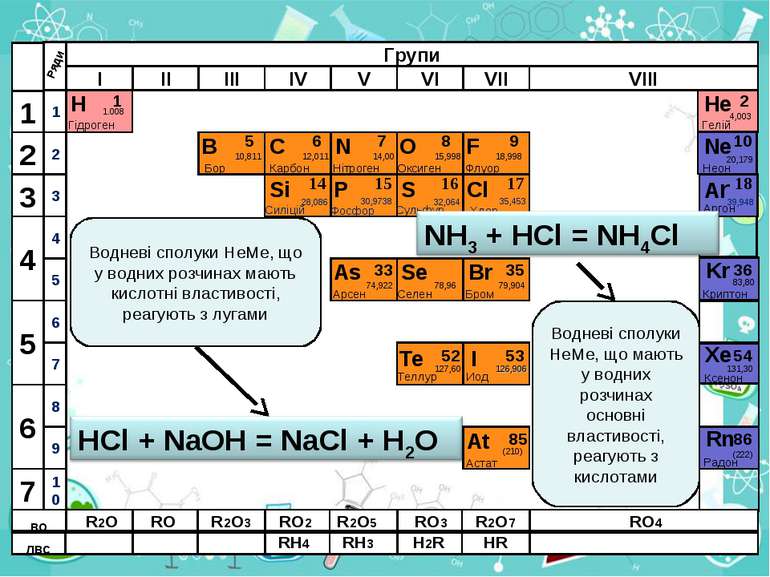
Н Гідроген 1 1.008 B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Карбон Нітроген Арсен Селен Теллур Флуор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелій Неон RH4 RH3 H2R HR RH RH2 RH3 Водневі сполуки НеМе, що у водних розчинах мають кислотні властивості, реагують з лугами ЛВС RH4 RH3 H2R HR ВО ВО R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 Водневі сполуки НеМе, що мають у водних розчинах основні властивості, реагують з кислотами
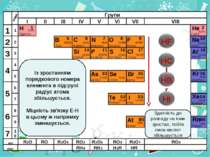
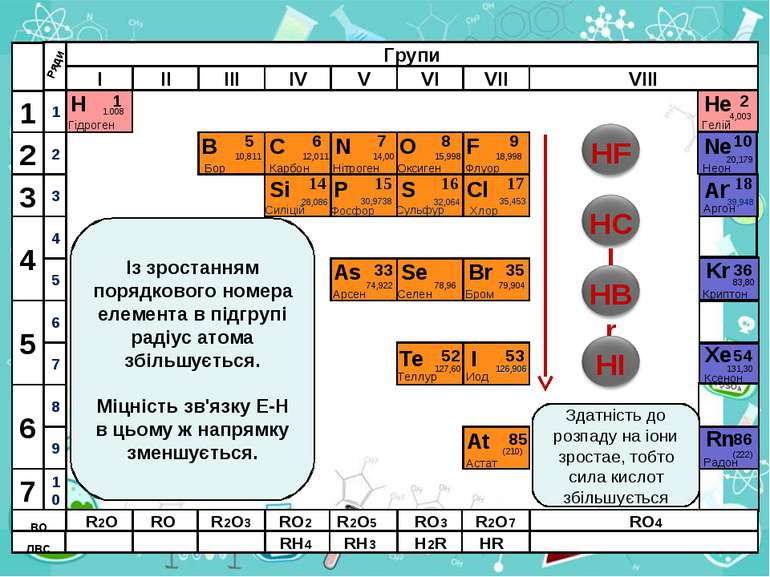
Н Гідроген 1 1.008 B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Карбон Нітроген Арсен Селен Теллур Флуор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелій Неон RH4 RH3 H2R HR RH RH2 RH3 Здатність до розпаду на іони зростае, тобто сила кислот збільшується ВО ЛВС R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Із зростанням порядкового номера елемента в підгрупі радіус атома збільшується. Міцність зв'язку Е-Н в цьому ж напрямку зменшується.
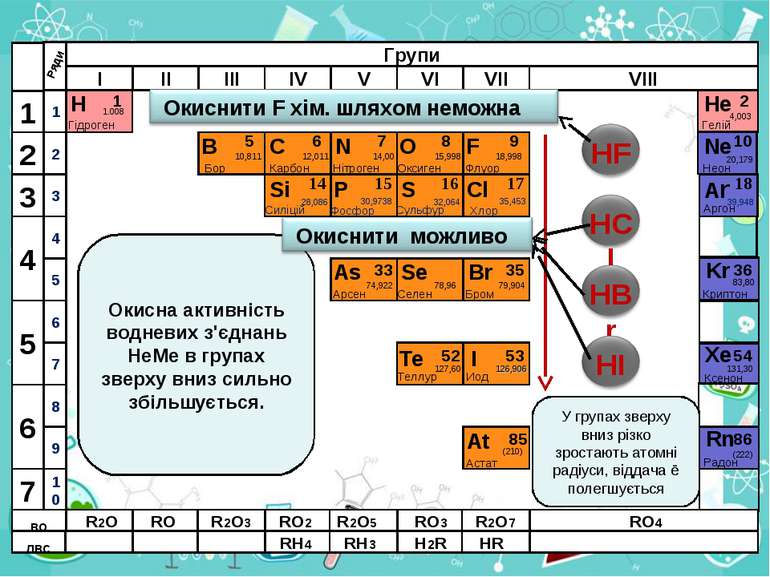
Н Гідроген 1 1.008 B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Карбон Нітроген Арсен Селен Теллур Флуор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелій Неон RH4 RH3 H2R HR RH RH2 RH3 ВО ЛВС R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Окисна активність водневих з'єднань НеМе в групах зверху вниз сильно збільшується. У групах зверху вниз різко зростають атомні радіуси, віддача ē полегшується
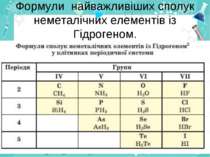
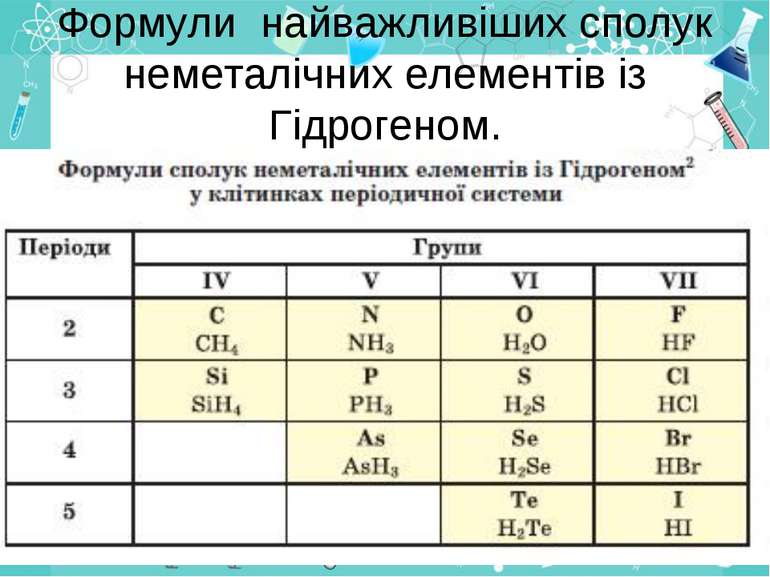
Загальна формула сполук елементів із Гідрогеном має два варіанти написання НnЕ і ЕНn. Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену СН4 SiH4 , а символи елементів інших груп — перед ним. H2O H2S HF
Склад і назви сполук. Сполуки з Гідрогеном відомі для більшості неметалічних елементів; їх не утворюють лише інертні елементи. Скласти формулу сполуки неметалічного елемента з Гідрогеном досить легко. Щоб з'ясувати значення валентності елемента в такій сполуці, потрібно від числа 8 відняти номер групи періодичної системи, в якій міститься елемент.
Загальна формула сполук елементів із Гідрогеном має два варіанти написання — НnЕ і ЕНn. Послідовність запису елементів у формулах цих сполук зумовлена традицією: символи елементів VI і VII груп розміщують після символу Гідрогену, а символи елементів інших груп — перед ним. Загальні формули сполук неметалічних елементів кожної групи з Гідрогеном указують у деяких варіантах періодичної системи в окремому рядку
Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви амоніак, метан, вода, хлороводень, сірководень та ін.), іноді — хімічні гідроген хлорид, гідроген сульфід тощо.
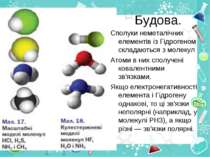
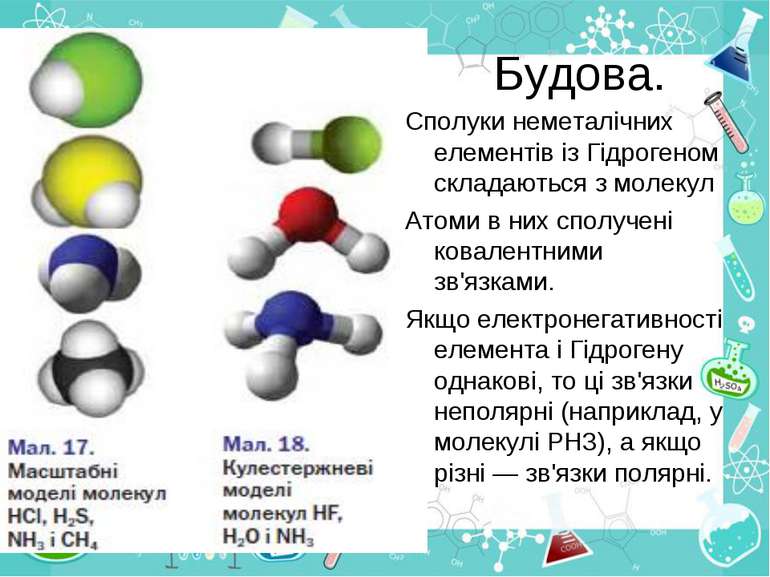
Будова. Сполуки неметалічних елементів із Гідрогеном складаються з молекул Атоми в них сполучені ковалентними зв'язками. Якщо електронегативності елемента і Гідрогену однакові, то ці зв'язки неполярні (наприклад, у молекулі РН3), а якщо різні — зв'язки полярні.
Якщо позитивні й негативні заряди, що виникли на атомах унаслідок зміщення спільних електронних пар, рівномірно розподілені в молекулі, то вона є неполярною (наприклад, молекула СН4). В іншому разі в одній частині молекули зосереджується невеликий негативний заряд, а в протилежній — позитивний заряд. Така молекула полярна; вона має два електричні полюси і називається диполем. Полярними є молекули НF, Н2О, NН3 - +
Фізичні властивості. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид НF (за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їх можна виявити за характерним запахом — неприємним, іноді різким. Температури плавлення і кипіння сполук із Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зі збільшенням відносних молекулярних мас. Проте сполуки елементів 2-го періоду — вода, амоніак і фтороводень — «випадають» із цієї залежності Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв'язків між молекулами
Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води за нормального тиску розчиняється 534 л газу бромоводню НВг (за 25 °С) або 702 л газу амоніаку КН3 (за 20 °С). Це пояснюється утворенням водневих зв'язків між молекулами води і галогеноводню або амоніаку, а також дисоціацією молекул НВг у водному розчині. Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв'язків і нездатність до дисоціації. Розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном у воді виявляють властивості кислот. Водні розчини НСL, НВг і НІ поводяться як сильні одноосновні кислоти, НF — як кислота середньої сили, а Н2S — як слабка двохосновна кислота.
Метан СН4 інертний щодо води (за звичайних умов). Водний розчин амоніаку NН3, на відміну від розчинів інших сполук неметалічних елементів із Гідрогеном, має лужну реакцію Вам відомо, що вода є слабким електролітом. Мізерна частка її молекул дисоціює з утворенням йонів Н+ і ОН~: Отже, воду можна вважати дуже слабкою кислотою і водночас дуже слабкою основою. Водні розчини сполук галогенів із Гідрогеном і Сульфуру з Гідрогеном виявляють властивості кислот.
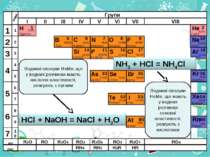
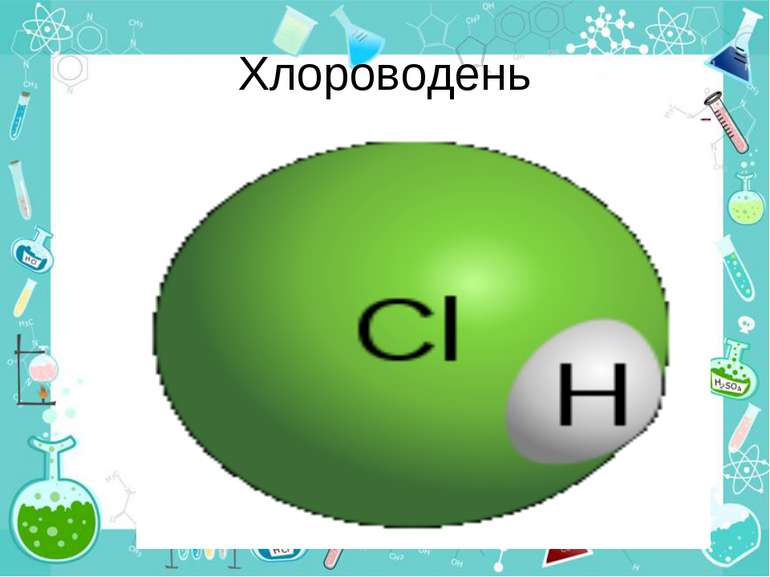
Хлороводень (HCl) — безбарвний задушливий газ з різким запахом. Температура розплавлення: −115 °C (158 K), температура кипіння: −85 °C (188 K), молекулярна маса — 70,9 а. о. м У лабораторних умовах хлороводень одержують при дії концентрованої сульфатної кислоти на хлорид натрію при сильному нагріванні:2NaCl + Н2SO4 = Na2SO4 + 2HCl ↑ У промисловості його добувають звичайно спалюванням водню в атмосфері хлору у спеціальних пальниках: H2 + Cl2 = 2HCl
Розчин хлороводню у воді називають хлоридною, або соляною, кислотою. Поява кислотних властивостей хлороводню в розчині обумовлюється тим, що полярна будова молекул HCl під впливом дуже полярних молекул води переходить в іонну, внаслідок чого молекули хлориду водню у розчині дисоціюють:
Хімічні властивості. Хлоридна кислота реагує: • з металами з виділенням водню • з основними й амфотерними оксидами • з основами й амфотерними гідроксидами • із більшістю солей
Добування гідроген хлориду і хлоридної кислоти. У промисловості гідроген хлорид добувають спалюванням водню в атмосфері хлору
Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою: Таким способом раніше добували хлороводень і в промисловості.
Складіть рівняння таких реакцій: HCl + Ca → HCl + Cr(OH)3→ HCl + MgCO3→ HCl + ZnO → HCl + Na2S → AlCl3 + Pb(NO3)2→
Схожі презентації
Категорії




![Н О Н + Н F Н Н O Н + F [ ] -2 -1 -1 : : : : : : : : : : : : : : : : чи скоро... Н О Н + Н F Н Н O Н + F [ ] -2 -1 -1 : : : : : : : : : : : : : : : : чи скоро...](https://svitppt.com.ua/images/7/6771/770/img6.jpg)
![Н О Н + Н N Н Н N Н + [ ] -2 -3 : : : : : : : : : : : : : : : : чи скорочено ... Н О Н + Н N Н Н N Н + [ ] -2 -3 : : : : : : : : : : : : : : : : чи скорочено ...](https://svitppt.com.ua/images/7/6771/770/img8.jpg)




















![Н О Н + Н F Н Н O Н + F [ ] -2 -1 -1 : : : : : : : : : : : : : : : : чи скоро... Н О Н + Н F Н Н O Н + F [ ] -2 -1 -1 : : : : : : : : : : : : : : : : чи скоро...](https://svitppt.com.ua/images/7/6771/210/img6.jpg)

![Н О Н + Н N Н Н N Н + [ ] -2 -3 : : : : : : : : : : : : : : : : чи скорочено ... Н О Н + Н N Н Н N Н + [ ] -2 -3 : : : : : : : : : : : : : : : : чи скорочено ...](https://svitppt.com.ua/images/7/6771/210/img8.jpg)