Презентація на тему:
Складання найпростіших окисно-відновних реакцій, підбір коефіцієнтів
Завантажити презентацію
Складання найпростіших окисно-відновних реакцій, підбір коефіцієнтів
Завантажити презентаціюПрезентація по слайдам:
Завдання 1 Розставте коефіцієнти в рівняннях реакцій методом електронного балансу, укажіть окисники й відновники: Co + HNO3 → Co(NO3)2 + N2 +H2O P + HNO3 +H2O → H 3 PO4 +NO S + HNO3 → H2SO4 + NO2 +H2O Mg + HNO3 → Mg(NO3)2 + N2 O +H2O
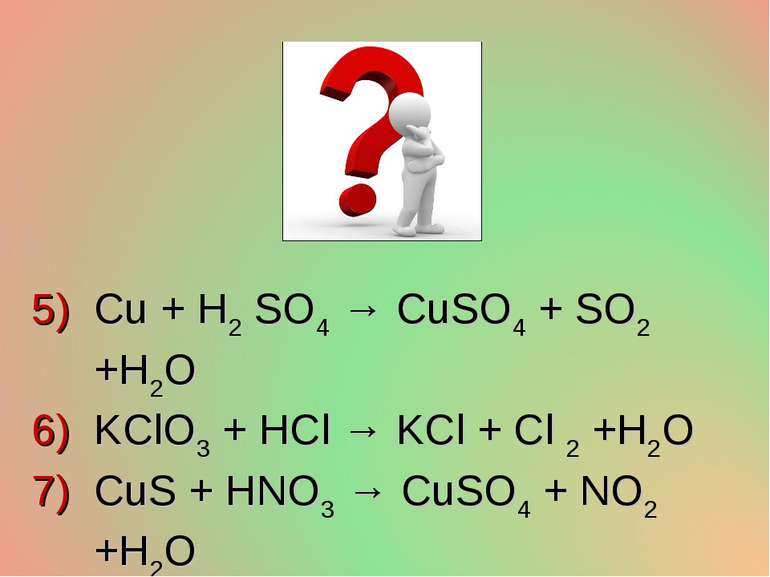
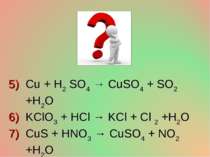
Cu + H2 SO4 → CuSO4 + SO2 +H2O KClO3 + HCl → KCl + Cl 2 +H2O CuS + HNO3 → CuSO4 + NO2 +H2O NH3 + O 2 → NO +H2O Au + HNO3 +HCl → AuCl3 +NO +H2O
Завдання 2 Запишіть у йонній формі рівняння ОВР, записані на дошці. Для виконання наступного завдання учні об’єднуються в малі групи.
Завдання 3 Запишіть рівняння реакцій для здійснення перетворень, укажіть серед них рівняння ОВР. Запишіть для них електронний баланс, укажіть окисник і відновник. Запишіть рівняння 2 і 3 в йонній формі.
Завдання 4 Обчисліть об’єм водню, що виділиться в результаті взаємодії: а) 8,6 г натрію з водою; б) 0,48 моль алюмінію із сульфатною кислотою; в) 20 г сплаву цинку зі сріблом із хлоридною кислотою (масова частка срібла в сплаві — 12 %).
Завдання 5* Обчисліть масу розчинів нітратної та хлоридної кислот, яку необхідно взяти для розчинення 10 г золота. Масова частка концентрованої нітратної кислоти — 63 %, хлоридної кислоти — 35 %.
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Творче завдання. Підготувати розповідь про значення окисно-відновних реакцій у життєдіяльності людини.
Схожі презентації
Категорії