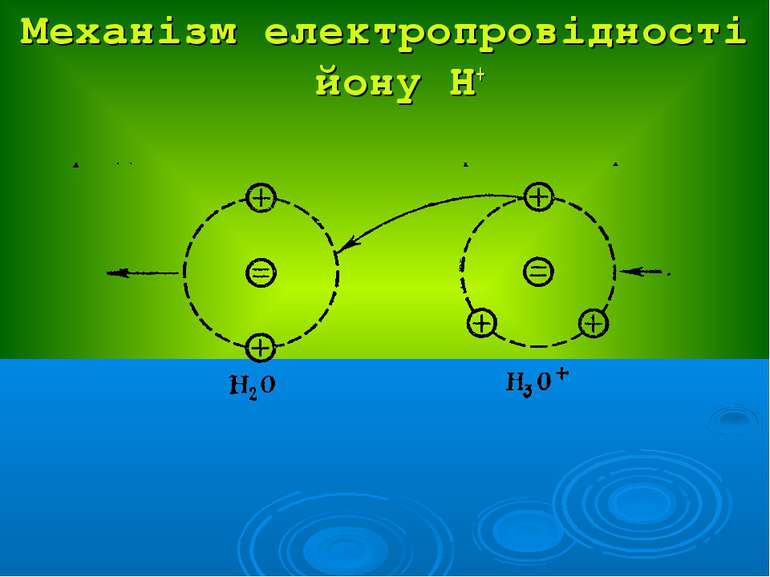
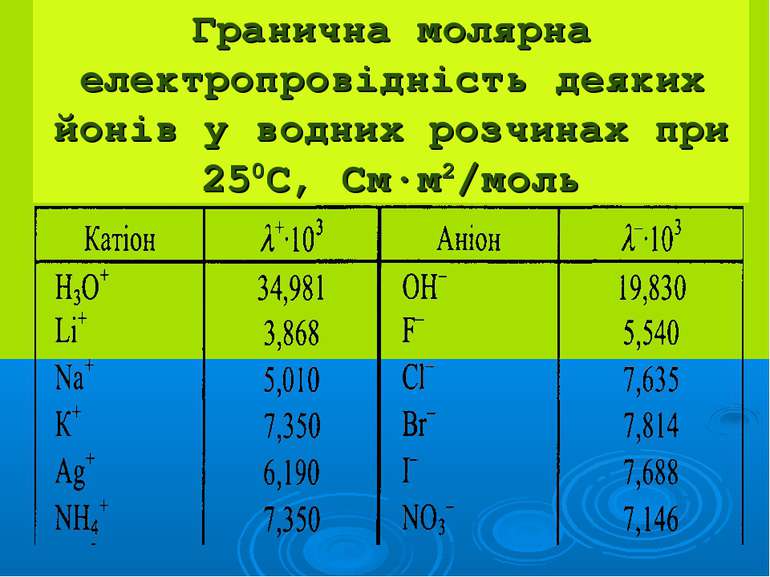
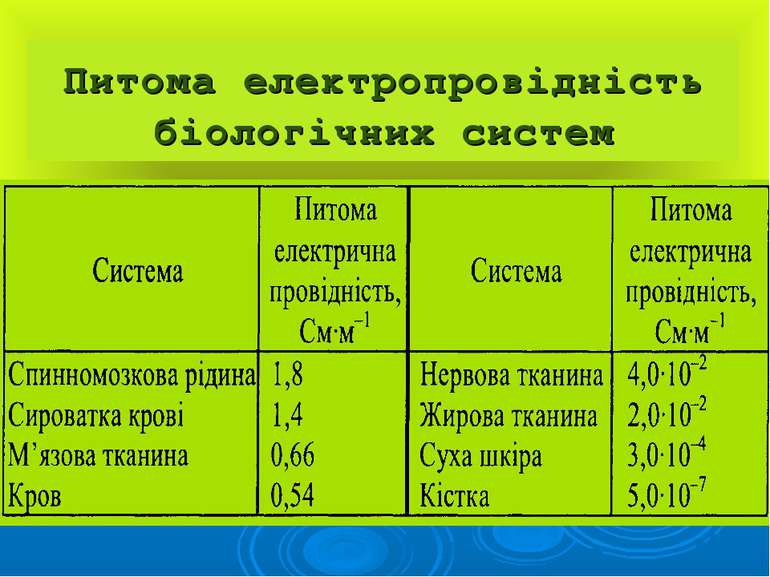
Презентація на тему:
Розчини електролітів. електропровідність розчинів
Завантажити презентацію
Розчини електролітів. електропровідність розчинів
Завантажити презентаціюПрезентація по слайдам:
Розчини електролітів. Електроліти в організмі людини План Слабкі електроліти Сильні електроліти Електропровідність розчинів електролітів Кондуктометрія Підготувала: асист. Бурмас Н. І.
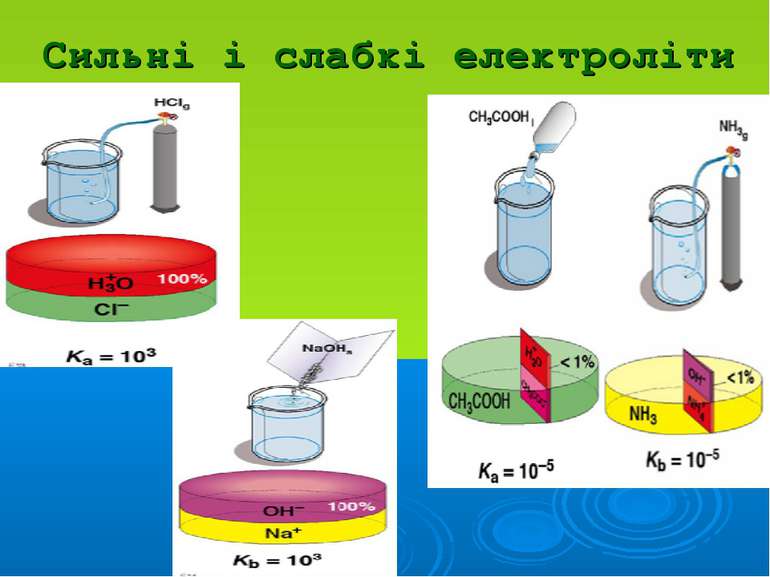
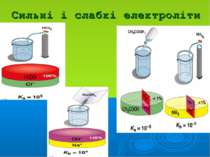
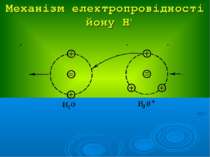
Розчини слабких електролітів характеризуються: ступенем дисоціації α: константою дисоціації Кд: Положення теорії електролітичної дисоціації Арреніуса: 1. При розчиненні молекули дисоціюють на йони 2. Цей процес оборотній 3. Частинки в розчині між собою не взаємодіють
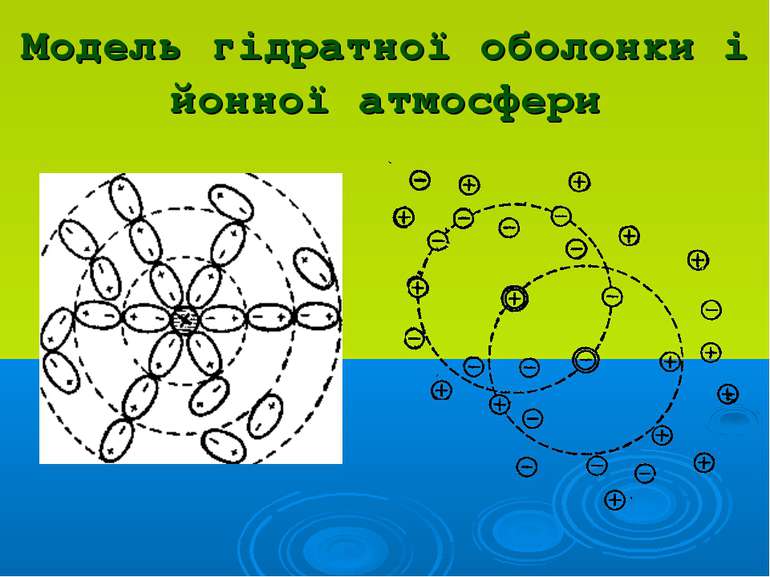
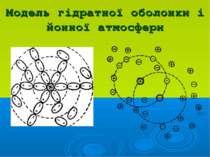
Положення теорії сильних електролітів Дебая-Гюккеля: Йони електроліту взаємодіють між собою за законами електростатики На взаємодію йонів впливає природа розчинника (діелектрична проникність) Навколо центрального йону утворюється йонна атмосфера 4. Розміром центрального йона можна нехтувати і вважати його точковим зарядом
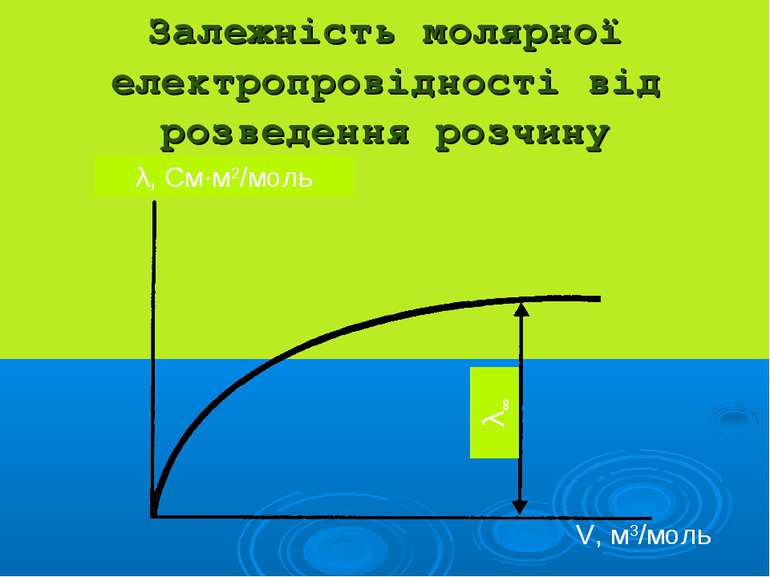
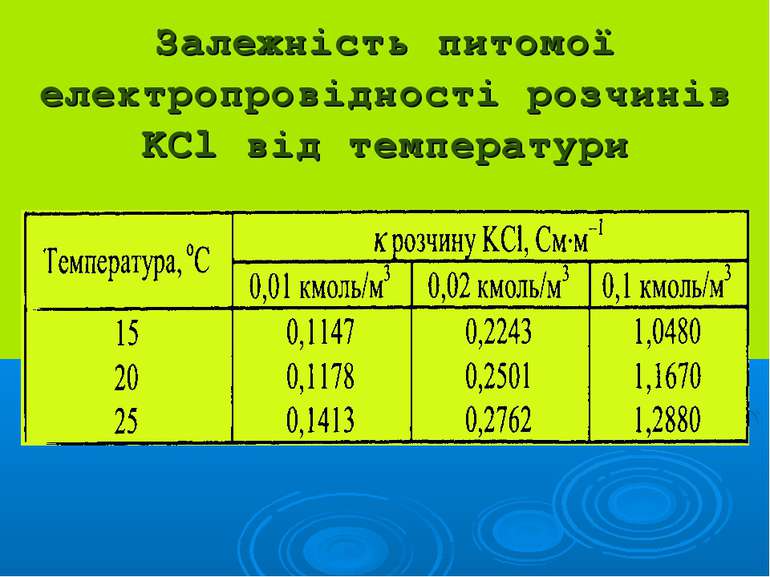
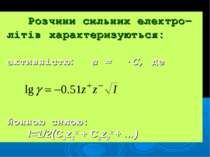
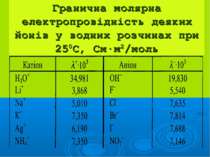
Розчини сильних електро- літів характеризуються: активністю: а = γ·С, де йонною силою: I=1/2(C1z12 + C2z22 + …)
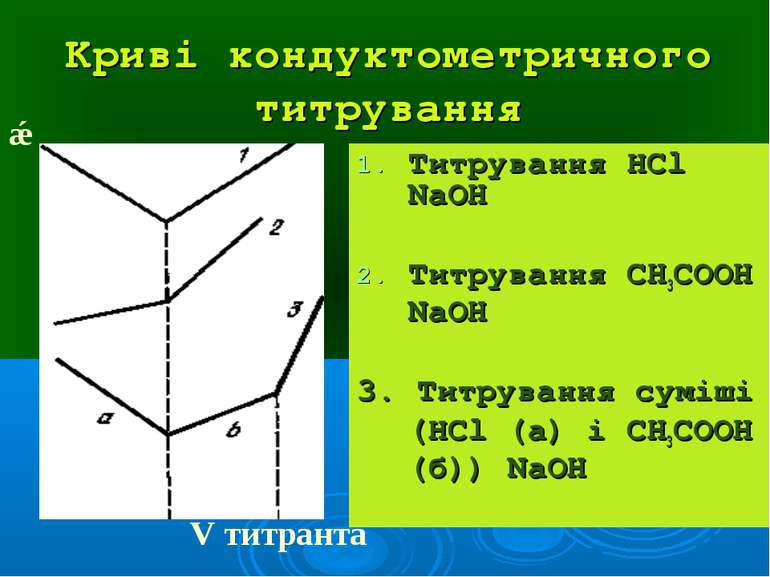
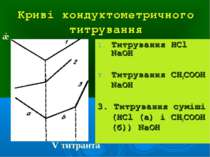
Криві кондуктометричного титрування Титрування НCl NaOH Титрування CH3COOH NaOH 3. Титрування суміші (НCl (а) і CH3COOH (б)) NaOH ǽ V титранта
Схожі презентації
Категорії