Презентація на тему:
Реакційна здатність алканів, алкенів, аренів, спиртів, фенолів, амінів.
Завантажити презентацію
Реакційна здатність алканів, алкенів, аренів, спиртів, фенолів, амінів.
Завантажити презентаціюПрезентація по слайдам:
Насиченими вуглеводнями називаються сполуки Карбону і водню, у яких всі атоми Карбону знаходяться в sp3-гібридизації, або в І валентному стані. Загальна формула – СnH2n+2. Гомологічний ряд – це ряд сполук, в яких кожний наступний член відрізняється від попереднього на гомологічну різницю СН2. Радикал одновалентний – це група атомів, що відрізняється від насичених вуглеводнів на один атом Гідрогену.
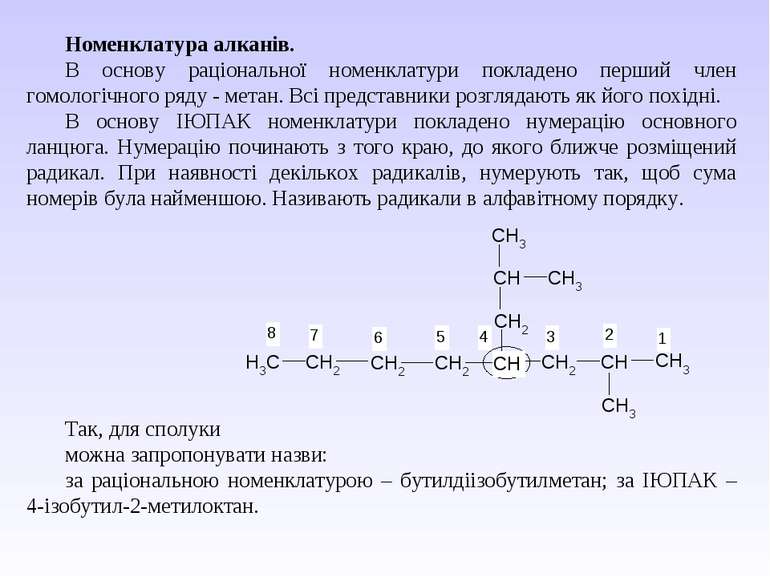
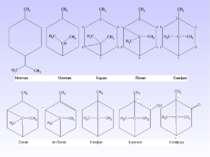
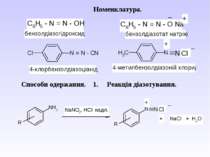
Номенклатура алканів. В основу раціональної номенклатури покладено перший член гомологічного ряду - метан. Всі представники розглядають як його похідні. В основу ІЮПАК номенклатури покладено нумерацію основного ланцюга. Нумерацію починають з того краю, до якого ближче розміщений радикал. При наявності декількох радикалів, нумерують так, щоб сума номерів була найменшою. Називають радикали в алфавітному порядку. Так, для сполуки можна запропонувати назви: за раціональною номенклатурою – бутилдіізобутилметан; за ІЮПАК – 4-ізобутил-2-метилоктан.
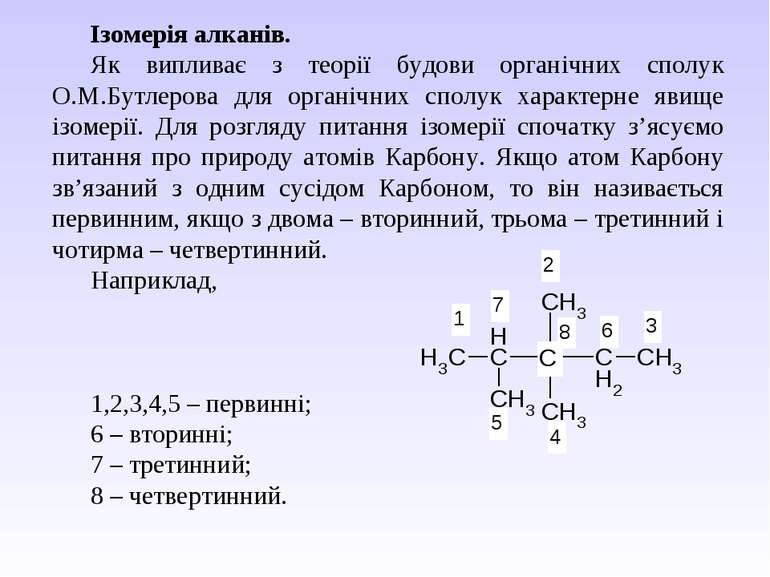
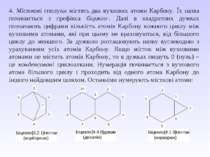
Ізомерія алканів. Як випливає з теорії будови органічних сполук О.М.Бутлерова для органічних сполук характерне явище ізомерії. Для розгляду питання ізомерії спочатку з’ясуємо питання про природу атомів Карбону. Якщо атом Карбону зв’язаний з одним сусідом Карбоном, то він називається первинним, якщо з двома – вторинний, трьома – третинний і чотирма – четвертинний. Наприклад, 1,2,3,4,5 – первинні; 6 – вторинні; 7 – третинний; 8 – четвертинний.
Для радикалу важливим є те, який атом Карбону за природою утворює радикал. Наприклад, у пропану СН3 – СН2 – СН3 є два атоми Карбону по природі – первинний і вторинний, тому у пропану є два радикали: СН3–СН2–СН2– пропіл; СН3–СН–СН3 ізопропіл │ ІІзомерія насичених вуглеводнів є двох видів: структурна і просторова. З структурної ізомерії насичені вуглеводні характеризуються типом: ізомерія вуглецевого скелету. Для виведення ізомерів існує правило: 1. У першого ізомеру всі атоми Карбону розміщені в основному ланцюгу. 2. Другий ізомер містить в основному ланцюгу на один Карбон менше, а радикал розміщується біля нерівноцінних атомів Карбону. Біля першого і останнього атомів Карбону радикали не розміщувати. Рівноцінні атоми Карбону – це атоми, що знаходяться на однаковій відстані від початку і кінця ланцюга. 3. Наступний ізомер містить в основному ланцюгу ще на один Карбон менше і т.д.
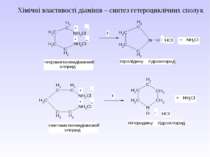
Методи одержання алканів Промислові: (самостійно) Лабораторні: 1. Лужне плавлення (синтез Дюма) RCOONa + NaOH R–H + Na2CO3 Наприклад, для одержання бутану потрібно взяти: СН3-СН2-СН2-СН2-СООNa + NaOH СН3-СН2-СН2-СН2–H + Na2CO3 2. Гідроліз магнійорганічних сполук: R-Mg-Hal + HOH → R–H + Mg(OH)Hal Наприклад, для одержання бутану потрібно взяти: СН3-СН2-СН2-СН2-Mg-Hal + HOH → СН3-СН2-СН2-СН2–H + Mg(OH)Hal
3. Реакція В’юрца–Шоригіна R–Hal + 2Na + Hal–R 2NaHal + R–R Механізм: R–Hal + 2Na R–Na + NaHal RNa + Hal–R NaHal + R–R Наприклад, для одержання гексану потрібно взяти: СН3-СН2-СН2–Сl + 2Na + Сl–СН2-СН2-СН3 2NaСl + СН3-СН2-СН2–СН2-СН2-СН3
4. Реакція Кольбе (електроліз) RCOONa RCOO– + Na+ RCOO– – 1е R + СО2 R + R R – R Наприклад, для одержання гексану потрібно взяти: СН3-СН2-СН2-COONa СН3-СН2-СН2-COO– + Na+ СН3- СН2-СН2-COO– – 1е СН3-СН2-СН2 + СО2 СН3- СН2-СН2 + СН3-СН2-СН2 СН3-СН2-СН2–СН2-СН2-СН3
5. Гідрування алкенів та алкінів: СН3–С≡С–СН3 + Н2 СН3–СН=СН–СН3 + Н2 СН3–СН2–СН2–СН3 6. Крекінг алканів – одержання алкенів та алканів: C20H42 C10H20 + C10H22 7. Одержання метану: Al4C3 + 12HCl 4AlCl3 + 3CH4
Фізичні властивості алканів Простеживши за зміною фізичних властивостей алканів, ми можемо відмітити, що при переході від одного гомолога до другого змінюється агрегатний стан (С1-С4 – гази, С5-С15 – рідини; С15 і – тверді речовини). Стрибкоподібно змінюється температура плавлення і кипіння. Проводячи кількісні зміни (–СН2–), ми спостерігаємо якісні прояви цих змін. Тут проявляється дія закону переходу кількісних змін в якісні. Цей закон виступає в гомологічних рядах і в іншій формі. Якщо атомів в молекулах досягає певної величини, то з’являється можливість для прояву нової якості сполуки – здатності утворювати ізомери. Таке явище, як ізомерія, є наслідком накопичення нової якості на основі кількісних змін. С1, С2, С3 – 1 ізомер; С4 – 2 ізомери; С5 – 3 ізомери; С7 – 9 ізомерів; С10 – 75 ізомерів; С20 – 366317 ізомерів.
Будова молекули метану. Природа хімічного зв’язку Атом Карбону в основному стані має таку електронну формулу: 1s22s22p2. Проте метан СН4 – перший представник алканів – має 4 еквівалентних зв’язки. Атом Карбону в метані знаходиться в збудженому стані – 1s22s12p3. Відбувається процес гібридизації між одною s- і трьома р-орбіталями, внаслідок чого відбувається вирівнювання електронних орбіталей. Таким чином, гібридизація – це процес перерозподілу електронної густини, при якому утворюються рівноцінні орбіталі з геометрією молекули, яка обумовлена відштовхуванням електронних пар оболонок. Такою геометрією для насичених вуглеводнів є тетраедр, з валентним кутом 109 28´.
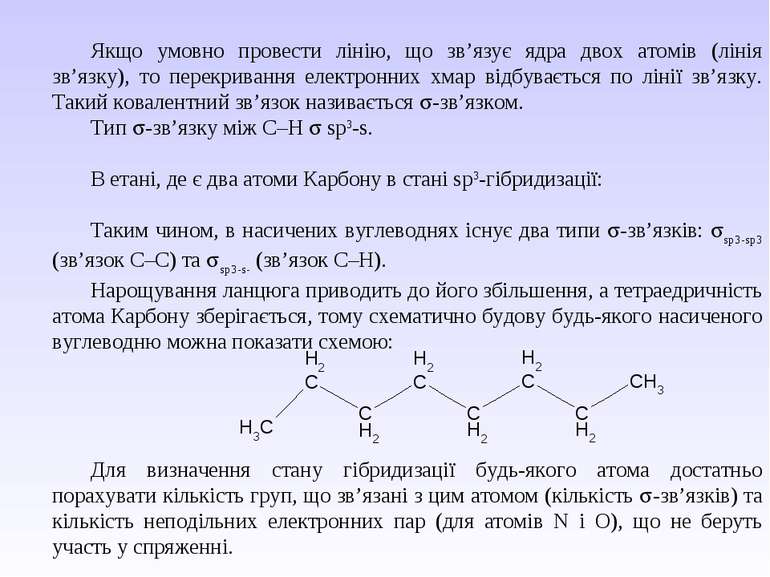
Якщо умовно провести лінію, що зв’язує ядра двох атомів (лінія зв’язку), то перекривання електронних хмар відбувається по лінії зв’язку. Такий ковалентний зв’язок називається -зв’язком. Тип -зв’язку між С–Н sp3-s. В етані, де є два атоми Карбону в стані sp3-гібридизації: Таким чином, в насичених вуглеводнях існує два типи -зв’язків: sp3-sp3 (зв’язок С–С) та sp3-s- (зв’язок С–Н). Нарощування ланцюга приводить до його збільшення, а тетраедричність атома Карбону зберігається, тому схематично будову будь-якого насиченого вуглеводню можна показати схемою: Для визначення стану гібридизації будь-якого атома достатньо порахувати кількість груп, що зв’язані з цим атомом (кількість -зв’язків) та кількість неподільних електронних пар (для атомів N і O), що не беруть участь у спряженні.
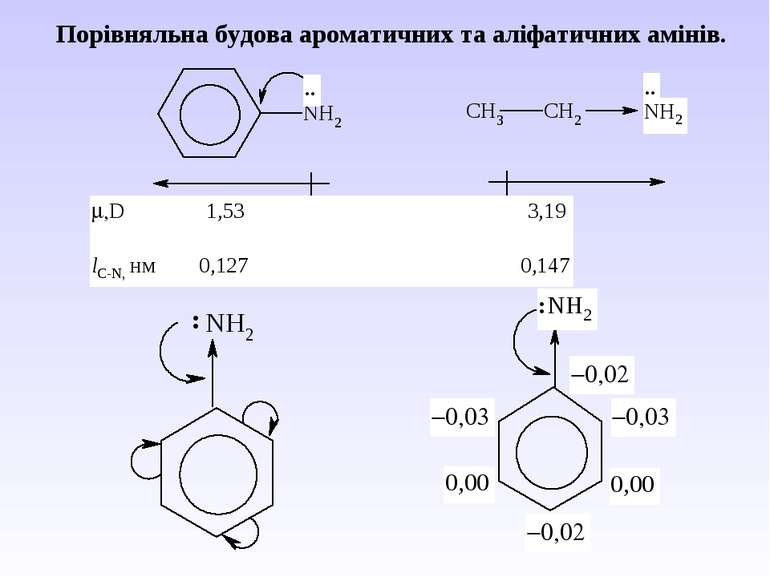
Відповіді на поставлені питання: 1. а) гібридизовані орбіталі концентрують хвильові функції в напрямку зв’язку і тому володіють кращими характеристиками перекривання sp3-орбіталей, які мають одну велику долю, яка утворює міцний хімічний зв’язок. б) гібридизація дає 4 еквівалентні орбіталі, під кутом 109 28’. 2,3. Енергія зв’язку С–С 350,28 кДж/моль. Енергія зв’язку С–Н 413,97 кДж/моль. Довжина зв’язку С–С 0,154 нм. Довжина зв’язку С–Н 0,109 нм. Так як довжина С–С зв’язку більша, він повинен легше розриватися, а важче буде відбуватись розрив sp3-s-зв’язку. Тому для насичених характерні реакції розщеплення і заміщення. Але внаслідок стеричних перешкод реакції заміщення відбуваються легше. 4. Розрив зв’язку легше йде по гомолітичному типу, оскільки атоми Карбону однакові по своїй електронегативності, а відмінність в електронегативності між Карбоном і Гідрогеном незначна (2,5 і 2,1).
Хімічні властивості Виходячи з стану гібридизації атома Карбону – sp3-гібридизація, можна зробити висновок, що основним типом реакції будуть реакції заміщення. Основні типи реакцій, характерні для алканів: 1. Реакції заміщення (S). 2. Реакції розщеплення С–С-зв’язку. 3. Реакції окиснення. Типи розриву хімічного ковалентного зв’язку Якщо при розриві зв’язку електрони рівномірно розподіляються між атомами, то цей тип розриву називається гомолітичним. При цьому утворюються радикали. Основний механізм реакції – радикальний. Отже, для алканів найхарактернішою є реакція радикального заміщення – SR. При наявності більше трьох атомів Карбону має значення природа атомів Карбону. Найлегше заміщення проходить біля третинного атома Карбону, потім – біля вторинного, потім – біля первинного.
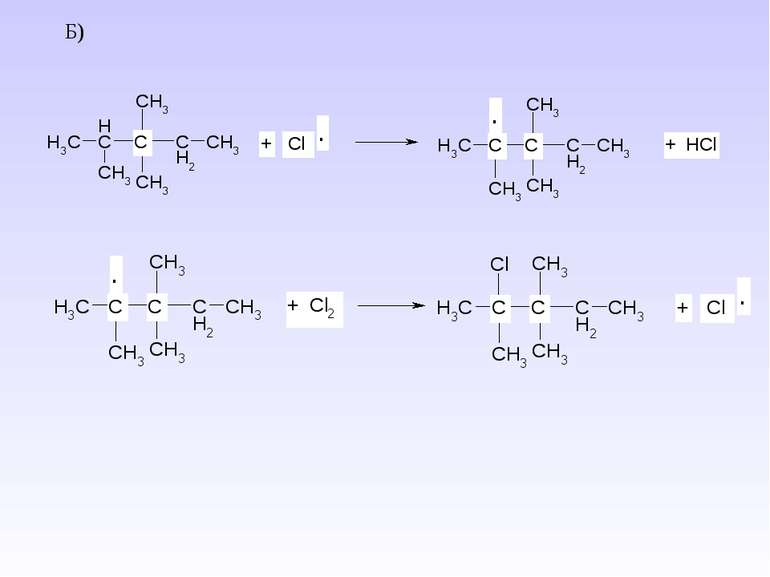
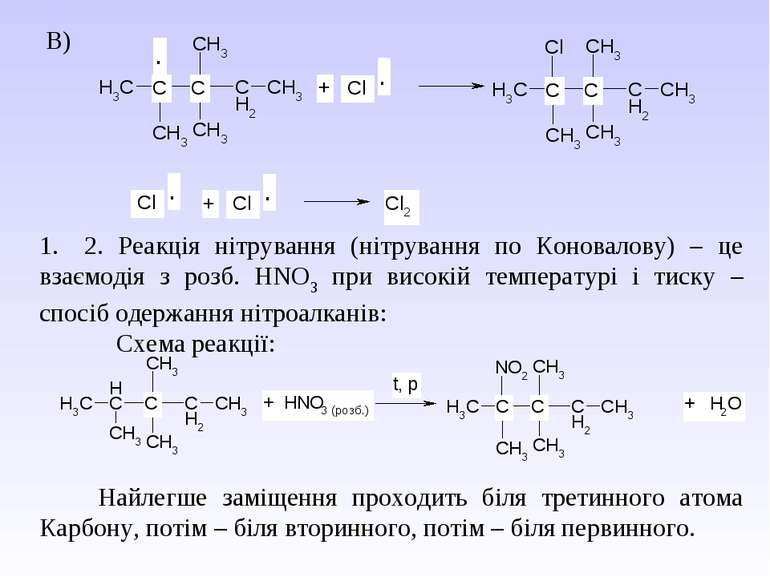
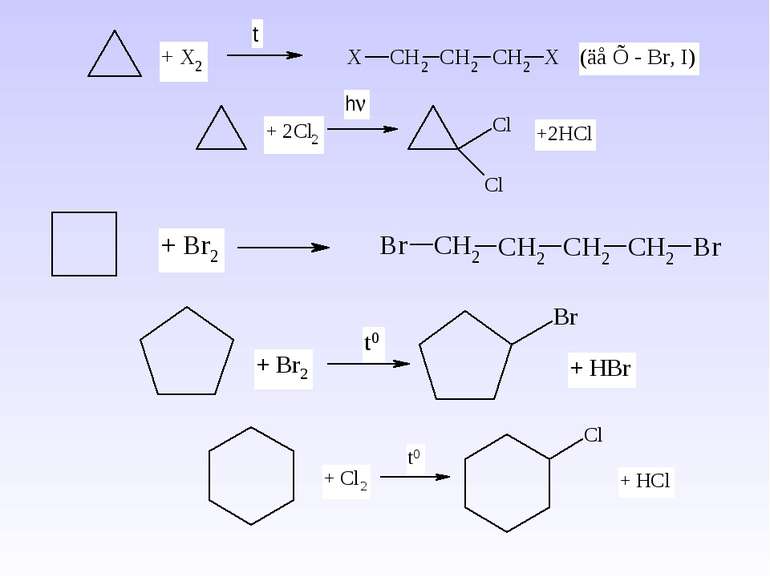
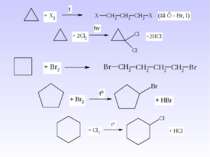
1. Реакція хлорування та бромування – одержання галогеналканів – це взаємодія з Cl2 (або Br2) при дії кванту світла (h ). Схема реакції: Механізм реакції радикального заміщення – SR. А)
В) 1. 2. Реакція нітрування (нітрування по Коновалову) – це взаємодія з розб. НNO3 при високій температурі і тиску – спосіб одержання нітроалканів: Схема реакції: Найлегше заміщення проходить біля третинного атома Карбону, потім – біля вторинного, потім – біля первинного.
1. Реакція сульфохлорування – це взаємодія з SO2+Cl2 при дії кванту світла (h ) – спосіб одержання первинних та вторинних алкансульфохлоридів, які є вихідною сировиною для одержання мила. 1. Крекінг алканів – це процес розщеплення вищих алканів при дії високої температури (термічний крекінг) або каталізатора (каталітичний крекінг) 2 СН4 С2Н2 + 3Н2 C20H42 C10H20 + C10H22 5. Окиснення алканів – повне (або згоряння) та неповне (самостійно).
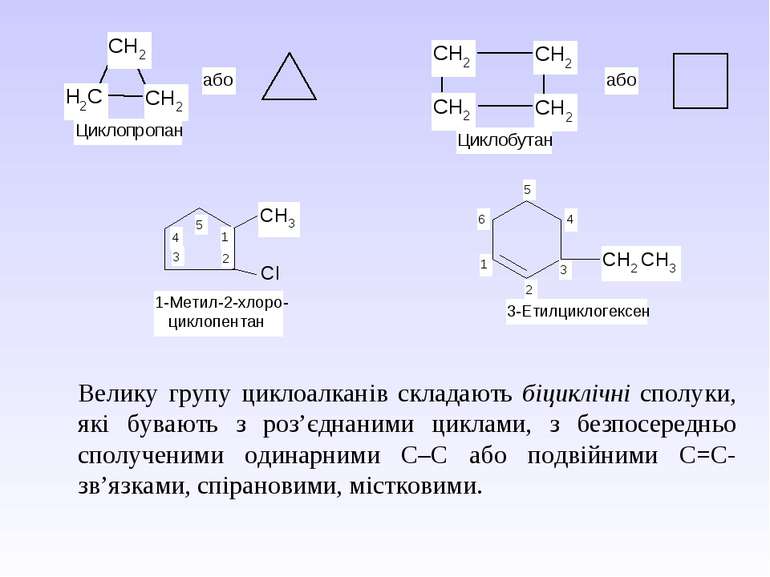
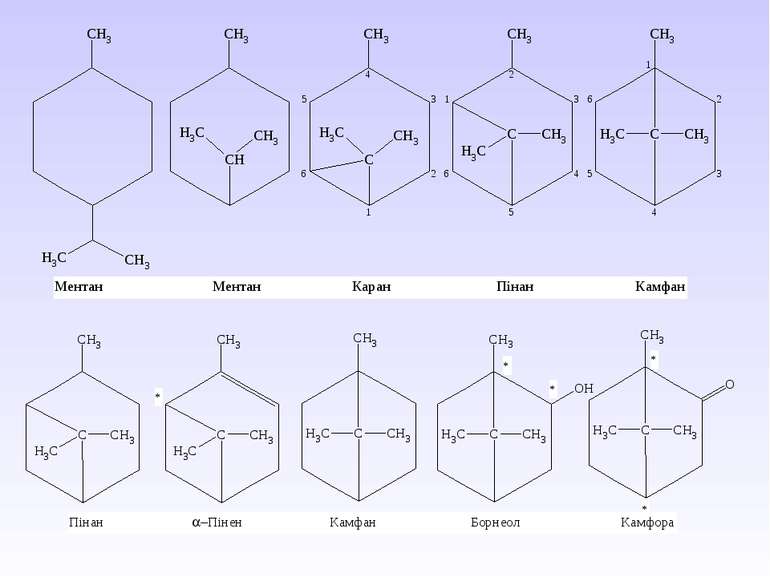
Циклоалканами називають насичені вуглеводні, що мають замкнутий ланцюг атомів Карбону. І. Циклоалкани класифікують за декількома структурними ознаками: – за кількістю атомів Карбону в циклі; – за числом циклів в молекулі; – за способом з’єднання циклів, якщо їх в молекулі декілька. Моноциклічні вуглеводні в залежності від розміру циклу поділяють на малі цикли (С3 і С4), звичайні (С5–С7), середні (С8–С11) і макроцикли (С12 і більше атомів карбону). Загальна формула ряду циклоалканів СnH2n. У зображенні структури циклоалканів у вигляді багатокутників атоми Карбону циклу і приєднанні до них атоми Гідрогену зазвичай опускаються:
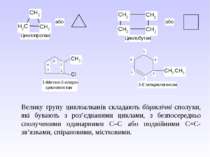
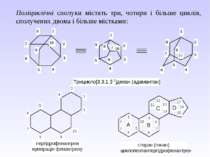
Велику групу циклоалканів складають біциклічні сполуки, які бувають з роз’єднаними циклами, з безпосередньо сполученими одинарними С–С або подвійними С=С-зв’язками, спірановими, містковими.
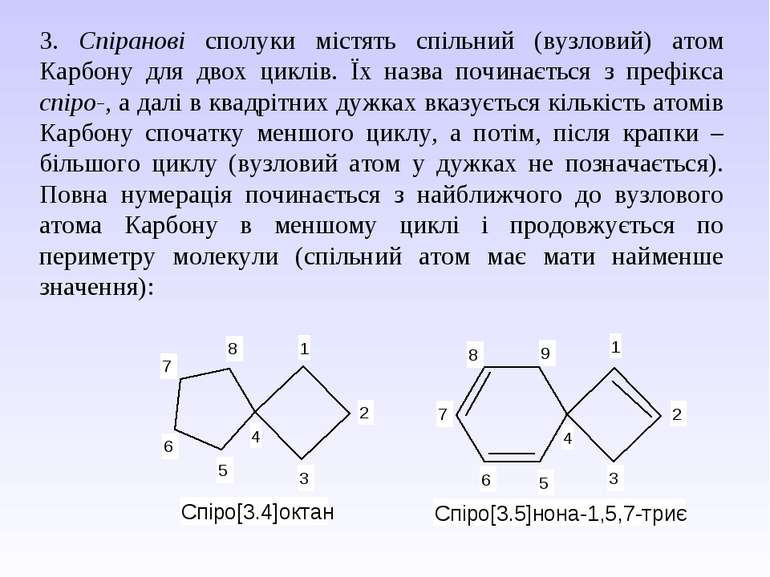
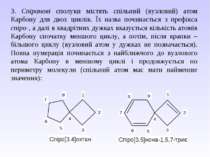
3. Спіранові сполуки містять спільний (вузловий) атом Карбону для двох циклів. Їх назва починається з префікса спіро-, а далі в квадрітних дужках вказується кількість атомів Карбону спочатку меншого циклу, а потім, після крапки – більшого циклу (вузловий атом у дужках не позначається). Повна нумерація починається з найближчого до вузлового атома Карбону в меншому циклі і продовжується по периметру молекули (спільний атом має мати найменше значення):
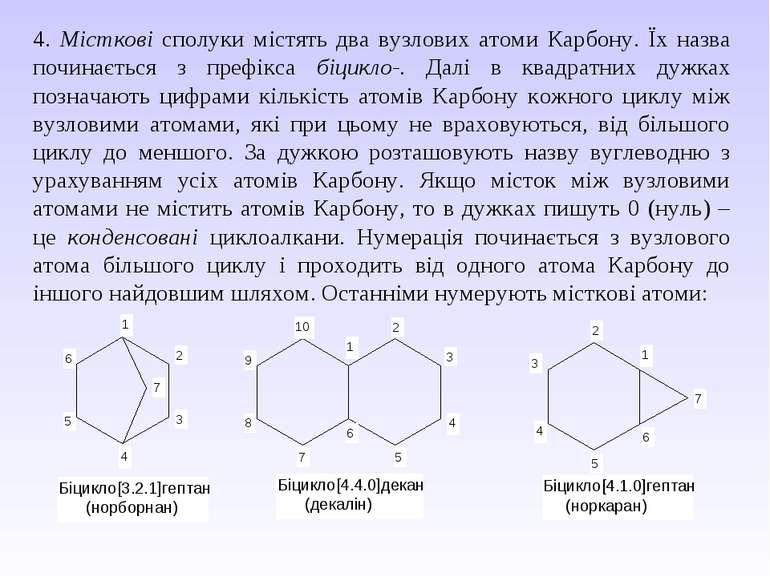
4. Місткові сполуки містять два вузлових атоми Карбону. Їх назва починається з префікса біцикло-. Далі в квадратних дужках позначають цифрами кількість атомів Карбону кожного циклу між вузловими атомами, які при цьому не враховуються, від більшого циклу до меншого. За дужкою розташовують назву вуглеводню з урахуванням усіх атомів Карбону. Якщо місток між вузловими атомами не містить атомів Карбону, то в дужках пишуть 0 (нуль) – це конденсовані циклоалкани. Нумерація починається з вузлового атома більшого циклу і проходить від одного атома Карбону до іншого найдовшим шляхом. Останніми нумерують місткові атоми:
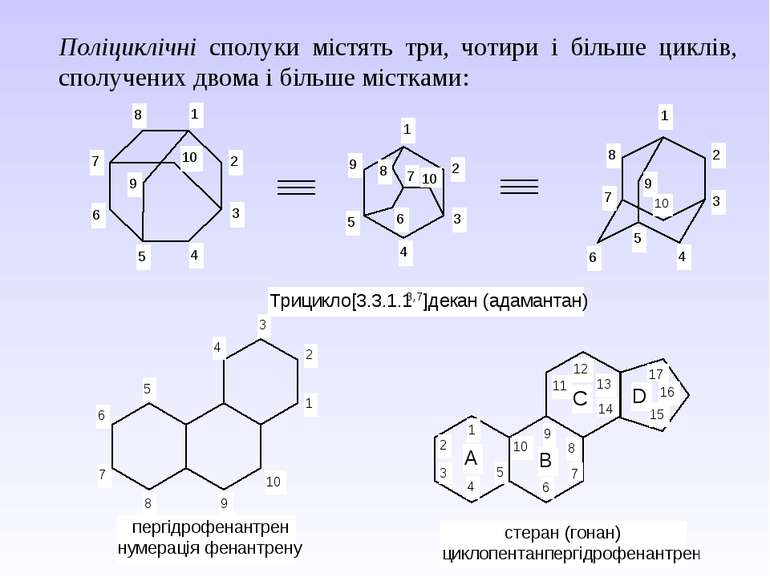
Поліциклічні сполуки містять три, чотири і більше циклів, сполучених двома і більше містками:
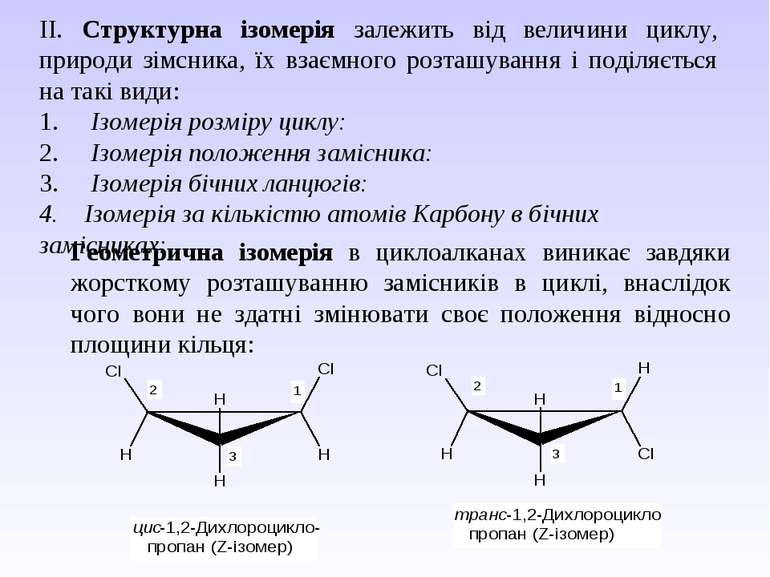
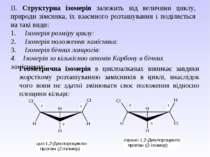
ІІ. Структурна ізомерія залежить від величини циклу, природи зімсника, їх взаємного розташування і поділяється на такі види: 1. Ізомерія розміру циклу: 2. Ізомерія положення замісника: 3. Ізомерія бічних ланцюгів: 4. Ізомерія за кількістю атомів Карбону в бічних замісниках: Геометрична ізомерія в циклоалканах виникає завдяки жорсткому розташуванню замісників в циклі, внаслідок чого вони не здатні змінювати своє положення відносно площини кільця:
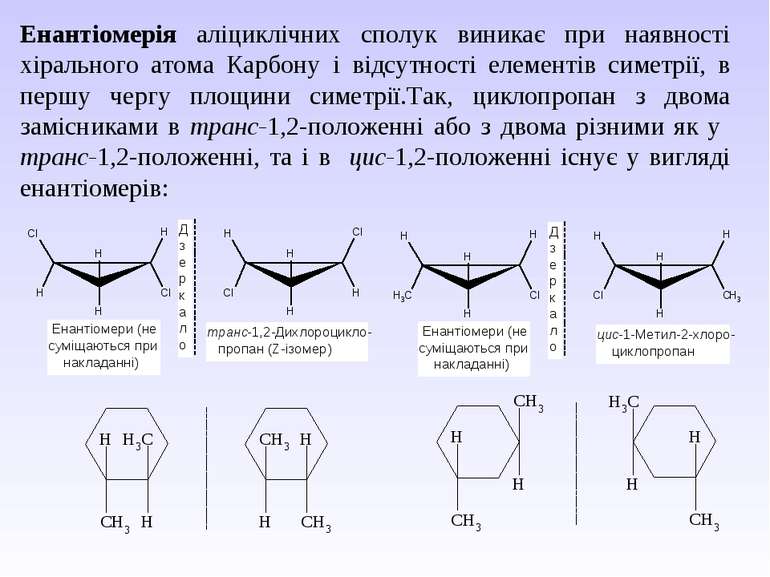
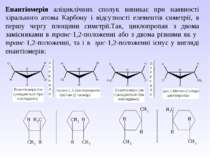
Енантіомерія аліциклічних сполук виникає при наявності хірального атома Карбону і відсутності елементів симетрії, в першу чергу площини симетрії.Так, циклопропан з двома замісниками в транс-1,2-положенні або з двома різними як у транс-1,2-положенні, та і в цис-1,2-положенні існує у вигляді енантіомерів:
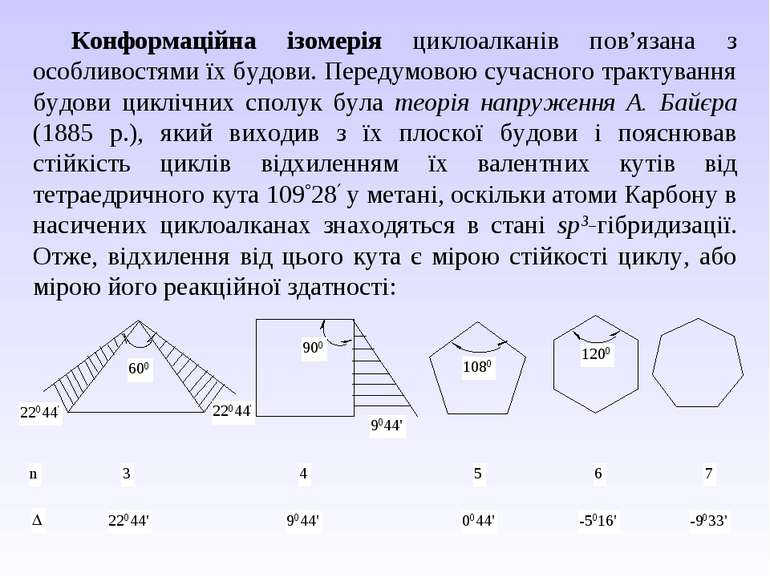
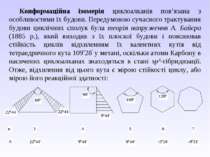
Конформаційна ізомерія циклоалканів пов’язана з особливостями їх будови. Передумовою сучасного трактування будови циклічних сполук була теорія напруження А. Байєра (1885 р.), який виходив з їх плоскої будови і пояснював стійкість циклів відхиленням їх валентних кутів від тетраедричного кута 109 28 у метані, оскільки атоми Карбону в насичених циклоалканах знаходяться в стані sp3-гібридизації. Отже, відхилення від цього кута є мірою стійкості циклу, або мірою його реакційної здатності:
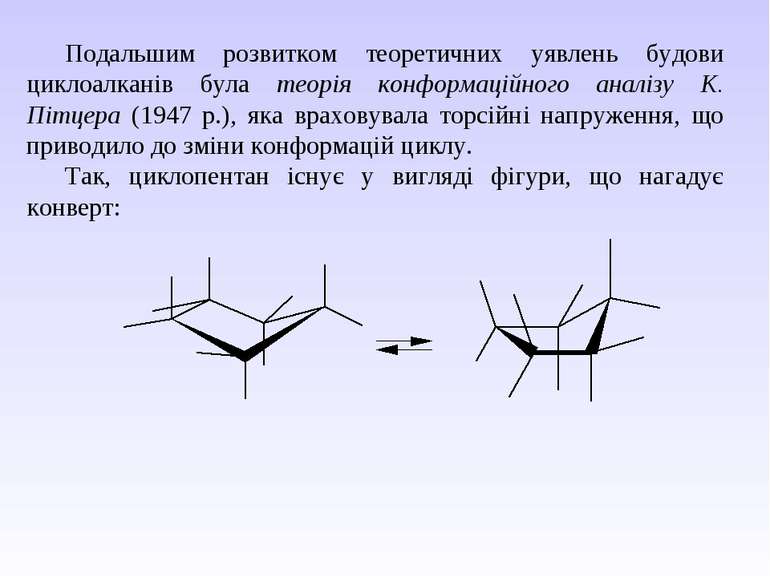
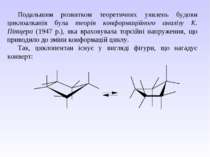
Подальшим розвитком теоретичних уявлень будови циклоалканів була теорія конформаційного аналізу К. Пітцера (1947 р.), яка враховувала торсійні напруження, що приводило до зміни конформацій циклу. Так, циклопентан існує у вигляді фігури, що нагадує конверт:
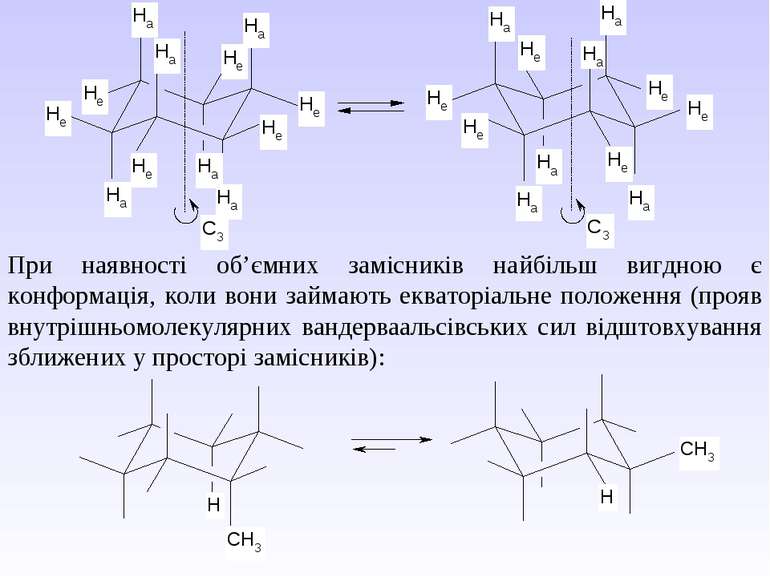
Циклогексан існує в декількох конформаціях, які швидко переходять одна водну в процесі інверсії циклу. Найбільш стійкою є конформація крісла та твіст-конформація. Конформація ванни є перехідною між ними. Конформація крісла найбільш симетрична, кожний атом Карбону має по два нееквівалентних зв’язки С–Н. Зв’язки, що розміщені паралельно вертикальній осі симетрії третього порядку, називають аксіальними (а), а зв’язки, що орієнтовані під кутом 109,5 відносно цієї осі, називають екваторіальними (е). В процесі конформаційних перетворень аксіальні замісники стають екваторіальними і відповідно екваторіальні – аксіальними. З цієї точки зору конформаційні переходи циклогексану називають інверсією.
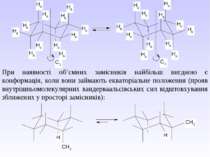
При наявності об’ємних замісників найбільш вигдною є конформація, коли вони займають екваторіальне положення (прояв внутрішньомолекулярних вандерваальсівських сил відштовхування зближених у просторі замісників):
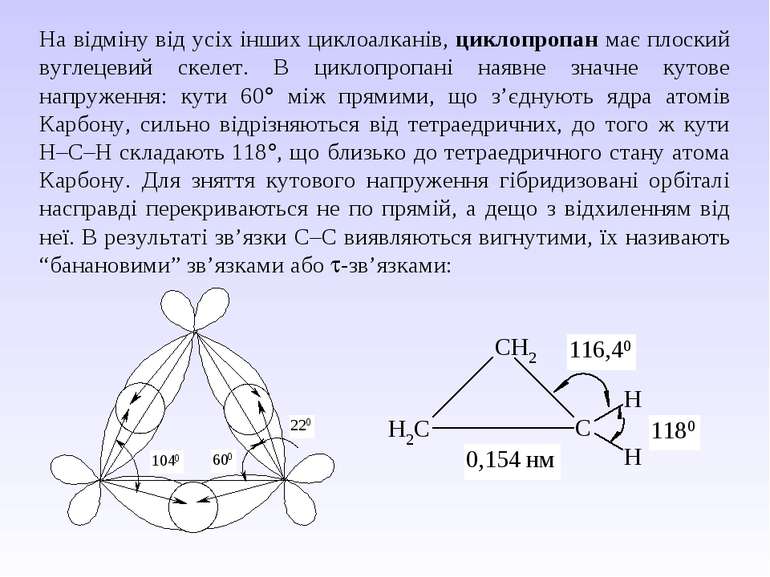
На відміну від усіх інших циклоалканів, циклопропан має плоский вуглецевий скелет. В циклопропані наявне значне кутове напруження: кути 60 між прямими, що з’єднують ядра атомів Карбону, сильно відрізняються від тетраедричних, до того ж кути Н–С–Н складають 118 , що близько до тетраедричного стану атома Карбону. Для зняття кутового напруження гібридизовані орбіталі насправді перекриваються не по прямій, а дещо з відхиленням від неї. В результаті зв’язки С–С виявляються вигнутими, їх називають “банановими” зв’язками або -зв’язками:
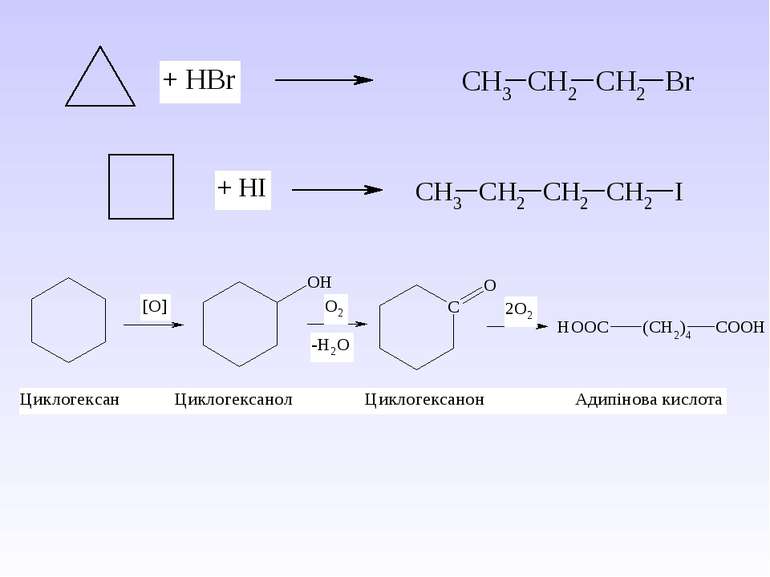
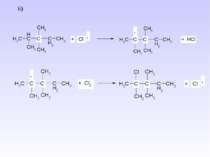
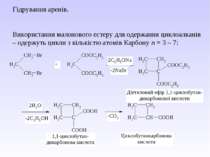
IV. Серед методів одержання циклоалканів необхідно виділити наступні: 1. Реакція В’юрца дигалогеналканів з металічним цинком або натрієм – реакція придатна для одержання циклоалканів з кількістю атомів Карбону n = 3 – 6: 2. ППіроліз барієвих, кальцієвих солей дикарбонових кислот – одержують цикли з кількістю атомів Карбону n = 5 – 7:
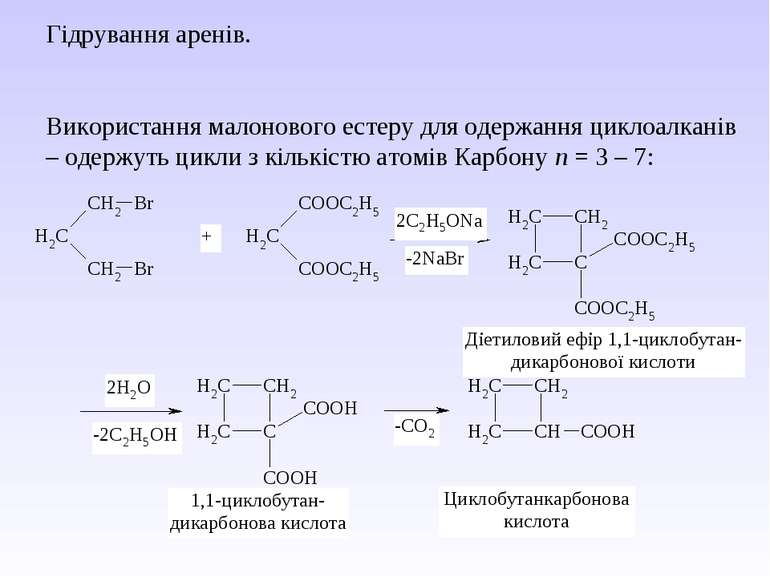
Гідрування аренів. Використання малонового естеру для одержання циклоалканів – одержуть цикли з кількістю атомів Карбону n = 3 – 7:
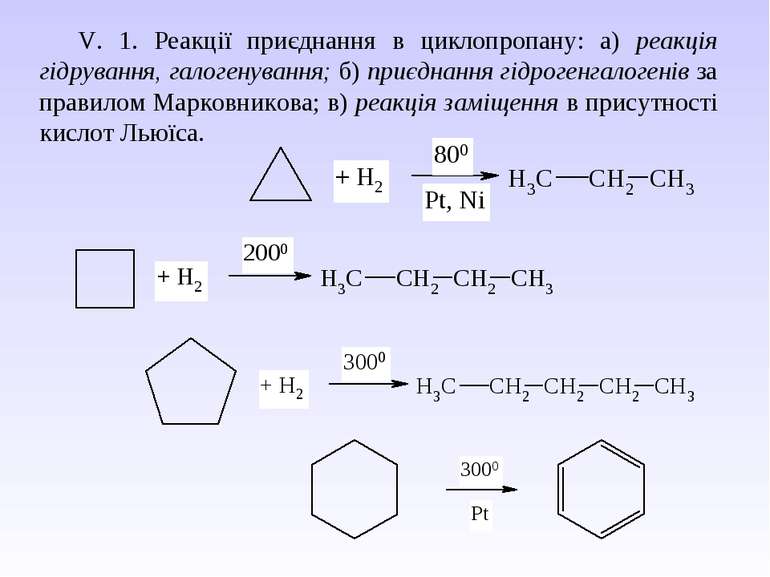
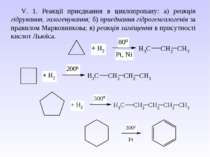
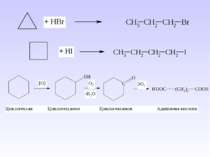
V. 1. Реакції приєднання в циклопропану: а) реакція гідрування, галогенування; б) приєднання гідрогенгалогенів за правилом Марковникова; в) реакція заміщення в присутності кислот Льюїса.
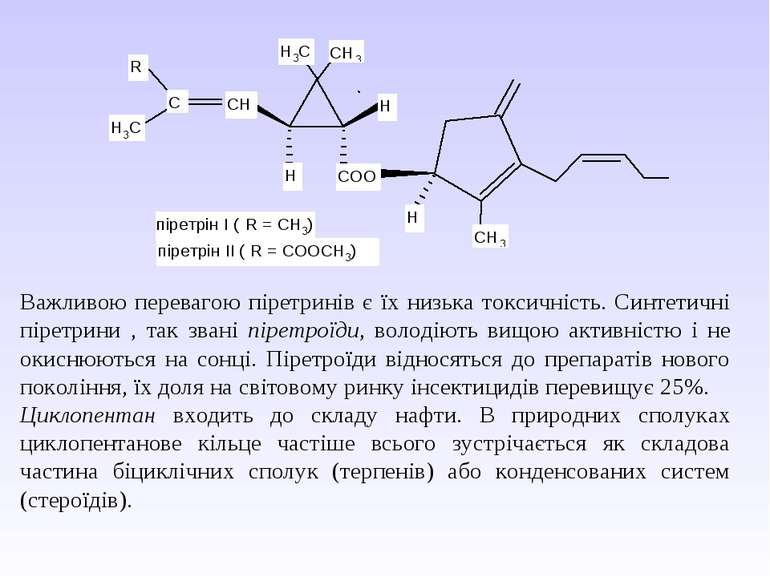
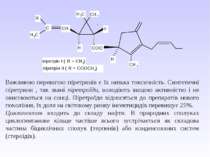
VI. Циклопропан – безбарвний газ, що зріджується при 20 С і тиску 5 атм. Володіє сильною знеболюючою дією, нетоксичний (при нормальному дозуванні). Проте з-за надзвичайно високої вогненебезпечності в даний час рідко використовується як засіб для наркозу. Серед похідних циклопропану необхідно виділити групу піретринів – природніх інсектицидів, що містяться в квітах багаторічних трав роду Pyrethrum, особливо ромашки далматської. Ці сполуки є похідними хризантемової кислоти. Діючим началом так званого персидського порошку, що одержують з ромашки і здавна використовується для знищення комах, виступають піретрини І і ІІ:
Важливою перевагою піретринів є їх низька токсичність. Синтетичні піретрини , так звані піретроїди, володіють вищою активністю і не окиснюються на сонці. Піретроїди відносяться до препаратів нового покоління, їх доля на світовому ринку інсектицидів перевищує 25%. Циклопентан входить до складу нафти. В природних сполуках циклопентанове кільце частіше всього зустрічається як складова частина біциклічних сполук (терпенів) або конденсованих систем (стероїдів).
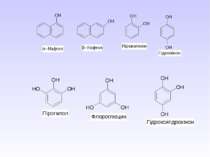
Спирти – це похідні насичених вуглеводнів, у яких атоми Гідрогену заміщені на ОН-групи. В залежності від кількості груп-ОН спирти поділяють на: –одноатомні; –двохатомні; –трьохатомні; –багатоатомні. В залежності від будови радикалу спирти бувають насичені і ненасичені. В залежності від положення групи ОН – первинні, вторинні і третинні.
Алканоли – це сполуки, що містять одну гідроксильну групу, що зв’язана з насиченим радикалом. CnH2n+1OH
Ізомерія одноатомних спиртів Структурна ізомерія залежить від: а) будови вуглецевого скелету; б) положення групи –ОН Наприклад, розглянемо це для бутанолу: С4Н9ОН Просторова ізомерія характеризується: а) оптична ізомерія – існування дзеркальних ізомерів – явище енантіомерії. Оптичні ізомери можна виявити з допомогою методу поляриметрії. Наприклад, б) конформаційна – здатність до обертання навколо одинарного -зв’язку. Розрізняють загальмовану (найбільш вигідну), заслонену та скошену конформації.
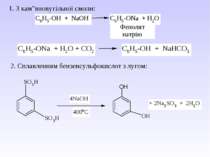
Це призводить до того, що зв’язок С–О розривається і спирти вступають в реакцію заміщення по групі – ОН (тобто проявляють спиртові властивості). Крім того розривається зв’язок ОН, і спирти проявляють кислотні властивості. За рахунок неподільної пари електронів кисню, спирти проявляють основні властивості. Оскільки під впливом групи ОН збільшується + заряд над атомом Карбону, то цей Карбон легко окиснюється. Таким чином, для спиртів характерні реакції: 1) Заміщення групи ОН; 2) Кислотні властивості (заміщ. Н); 3) Основні властивості; 4) Реакції окиснення.
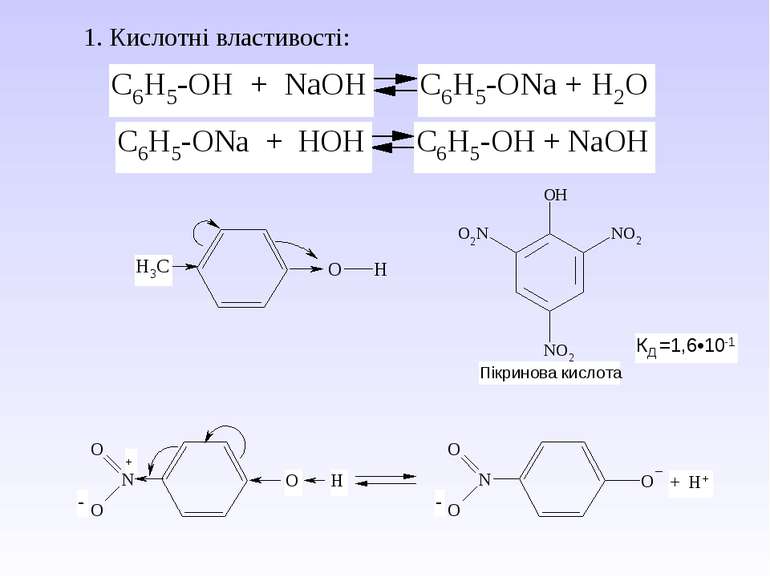
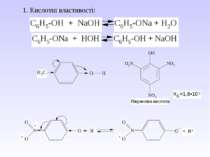
І. Кислотні властивості виражені внаслідок (+І)- ефекту алкільного радикалу. Питання для відповіді: 1. Як змінюються кислотні властивості в гомологічному ряду і чому? Тому спирти не вступають в реакцію з лугом, а тільки з металами. 2СН3СН2ОН + 2Na 2CH3CH2ONa + H2 алкоголяти являються солями слабких кислот і сильних основ, тому легко піддаються гідролізу. CH3CH2ONa + HOH C2H5OH + NaOH Етилат натрію ІІ. Основні властивості За рахунок неподільної пари електронів атома кисню спирти вступають в реакції з протонними і апротонними кислотами. Взаємодія проходить по донорно-акцепторному типу і утворюється оксонієва сполука (протонований спирт).
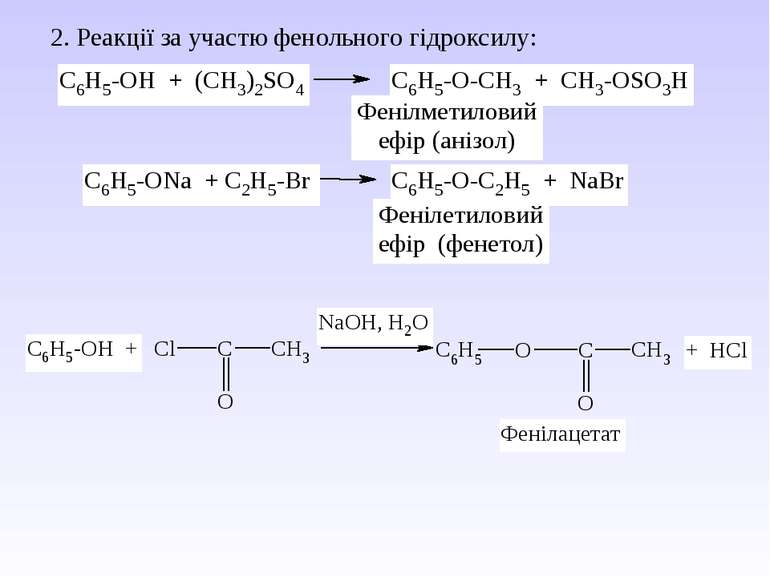
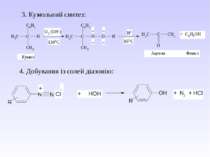
ІІІ. Спиртові властивості а) взаємодія з галогенопохідними б) реакції відщеплення води 1. Міжмолекулярна дегідратація 2. Внутрішньо-молекулярна дегідратація Механізм реакції дегідратації ІV. Реакції окислення а) повне окислення 2С2Н5ОН + 7О2 4СО2 + 6Н2О б) дія слабких окиснювачів – при дії хромовою сумішшю первинні спирти утворюють альдегіди, вторинні – кетони, третинні – не окислюються. При дії сильних окиснювачів первинні спирти окиснюються до кислот без зміни ланцюга, вторинні – суміш кислот, третинні – кислоти, кетони.
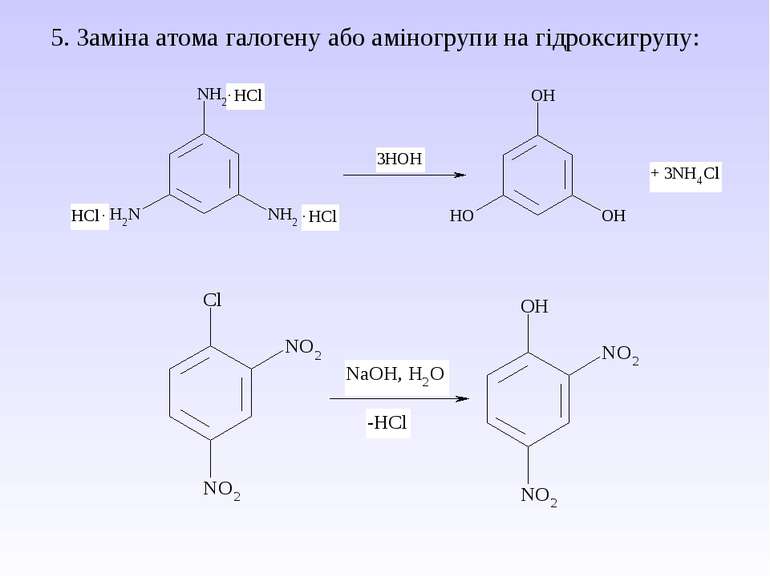
Багатоатомні спирти Найбільш поширеними представниками багатоатомних спиртів є етиленгліколь , гліцерин і сорбіт. Способи одержання 1. Гідроліз галогенпохідних 2. Гідроліз оксигалогенопохідних 3. Окиснення етиленових вуглеводнів водним розчином KMnO4 4. Гідроліз органічних оксидів Ізомерія і номенклатура багатоатомних спиртів Для них характерна структурна і просторова ізомерія. Структурні ізомери відрізняються між собою будовою вуглецевого скелету і взаємним розміщенням груп.
Хімічні властивості Відповідають одноатомним спиртам, але внаслідок наявності декількох груп – ОН, володіють більш вираженими властивостями. 1. Кислотні властивості Вступають в реакцію з металами і лугами. Реакція з Сu(ОН)2 є якісною, оскільки голубий колір гідроксиду змінюється на синій колір комплексної сполуки. 2. Утворення ефірів з мінеральними кислотами Процес проходить по стадіях:
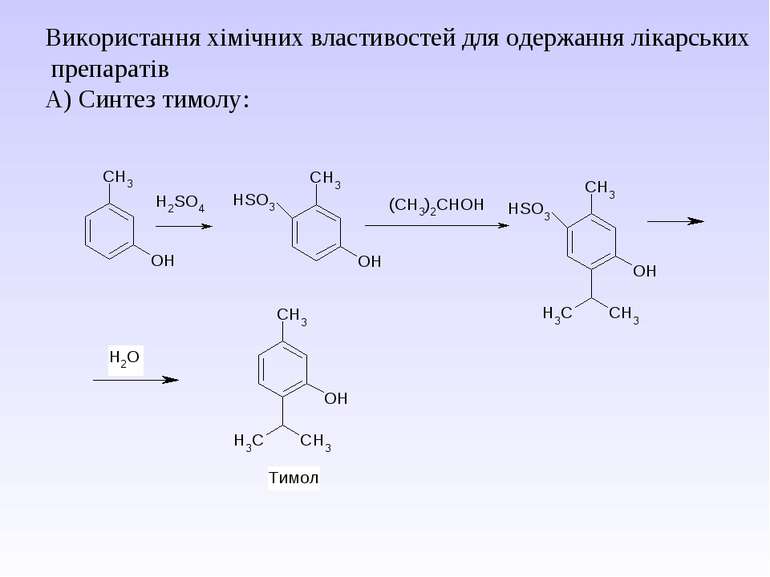
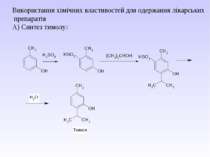
Практичне використання: 1. Як розчинники. 2. Як дезінфікуючий засіб. 3. Для синтезу пластмас по типу поліефірних смол. 4. Для одержання нітролаків. 5. Для лікарських препаратів, кремів, желе. 6. Для одержання антифризів. 7. Для виготовлення алкогольних напоїв.
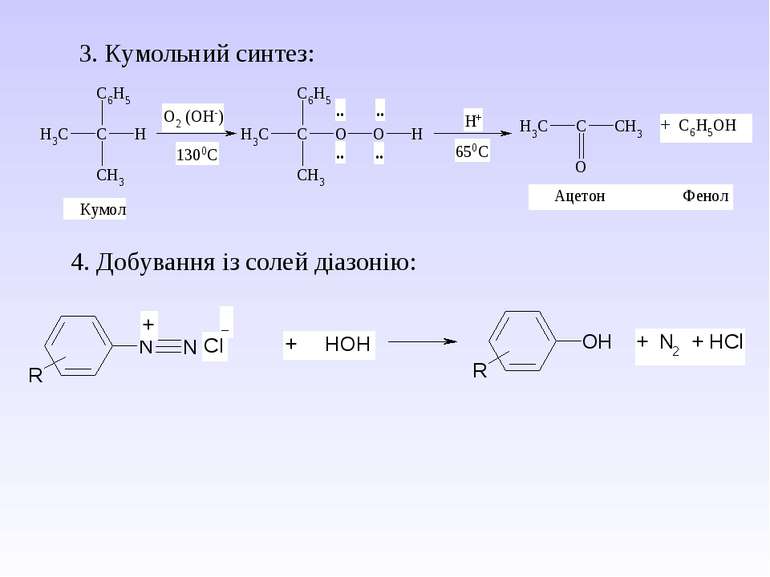
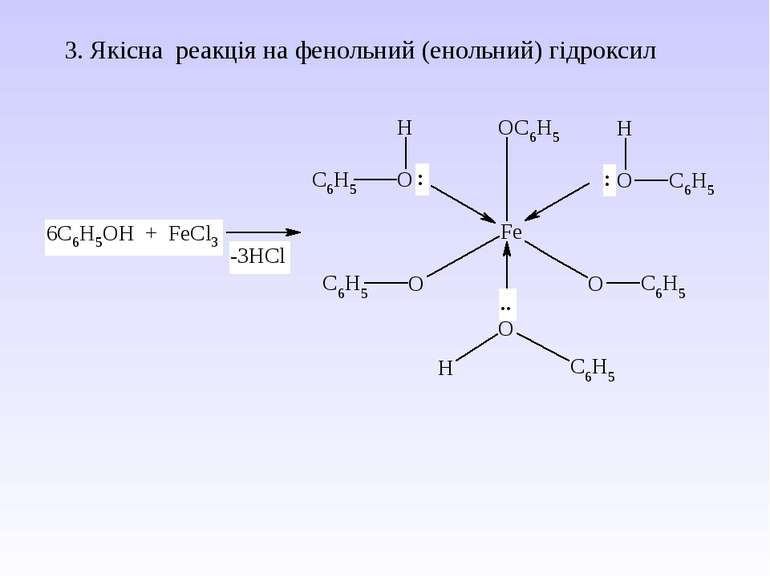
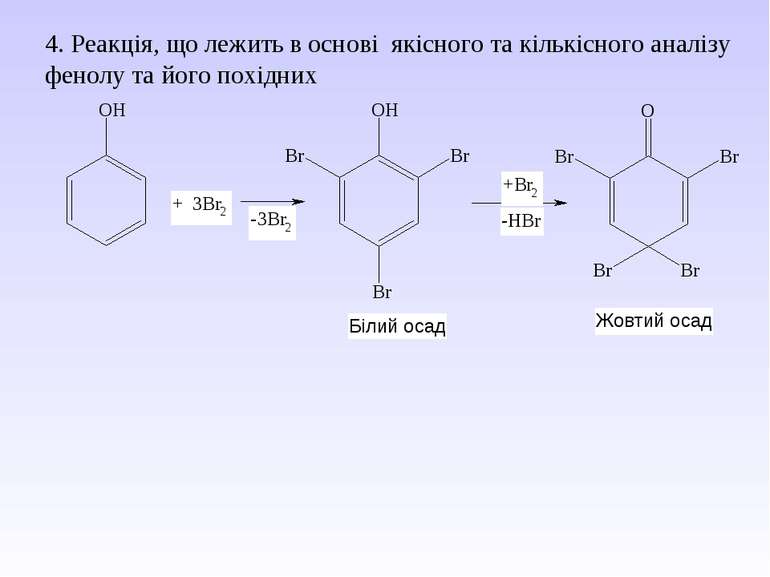
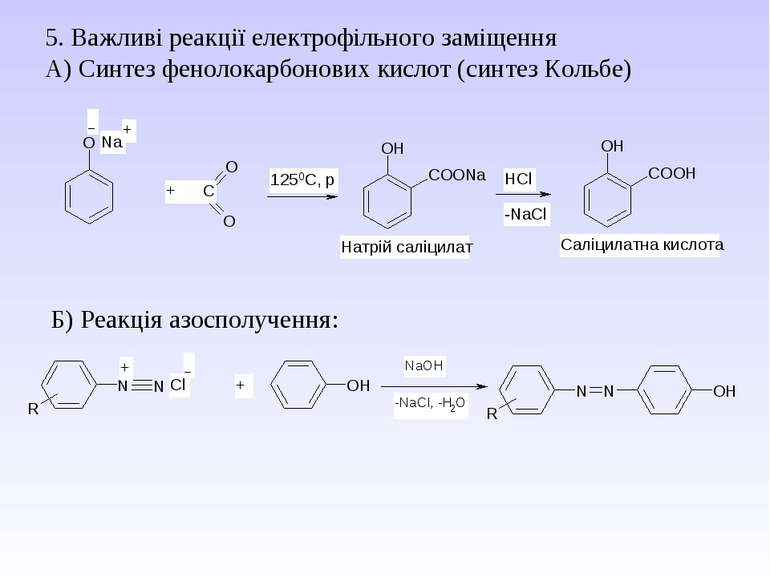
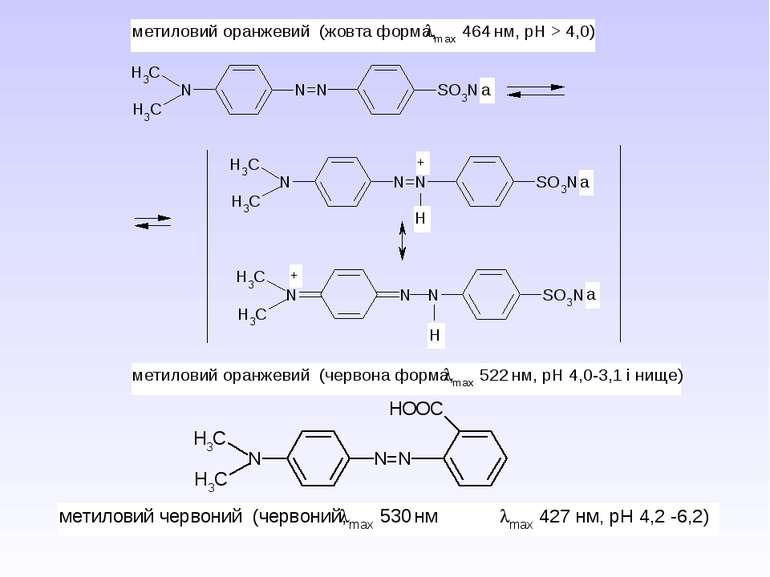
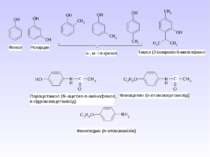
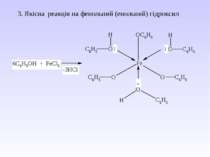
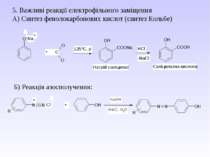
5. Важливі реакції електрофільного заміщення А) Синтез фенолокарбонових кислот (синтез Кольбе) Б) Реакція азосполучення:
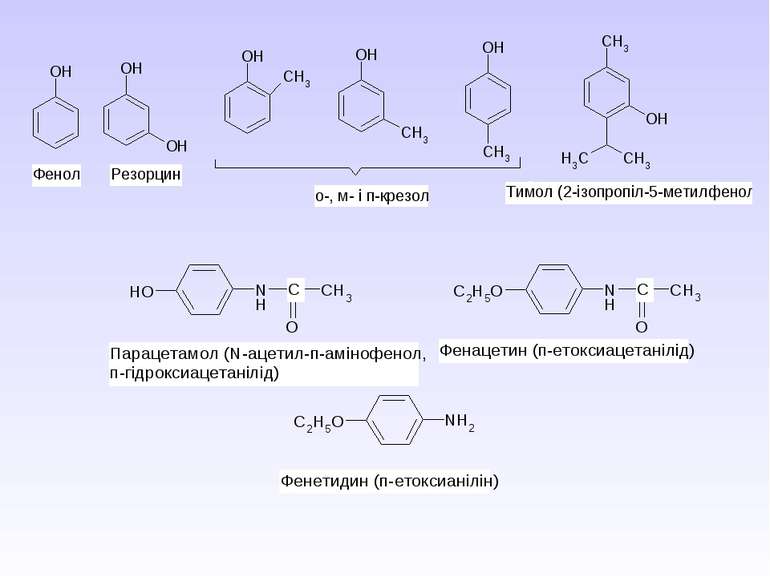
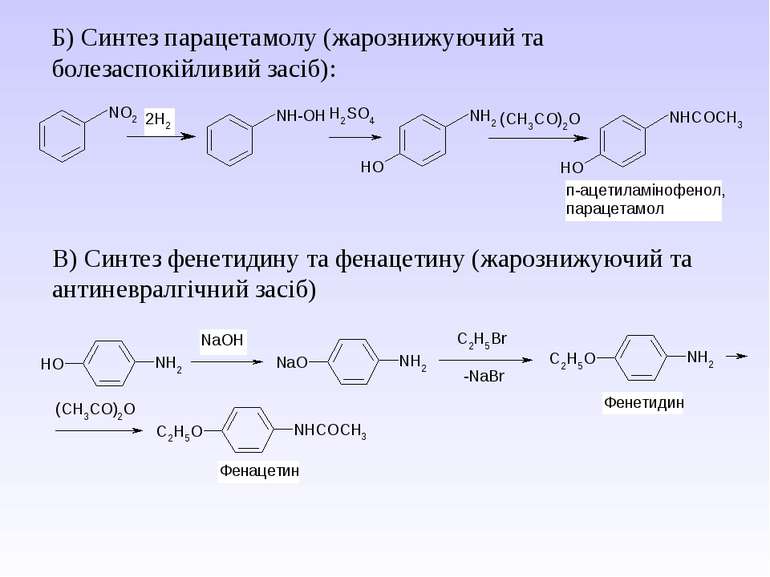
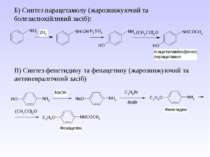
Б) Синтез парацетамолу (жарознижуючий та болезаспокійливий засіб): В) Синтез фенетидину та фенацетину (жарознижуючий та антиневралгічний засіб)
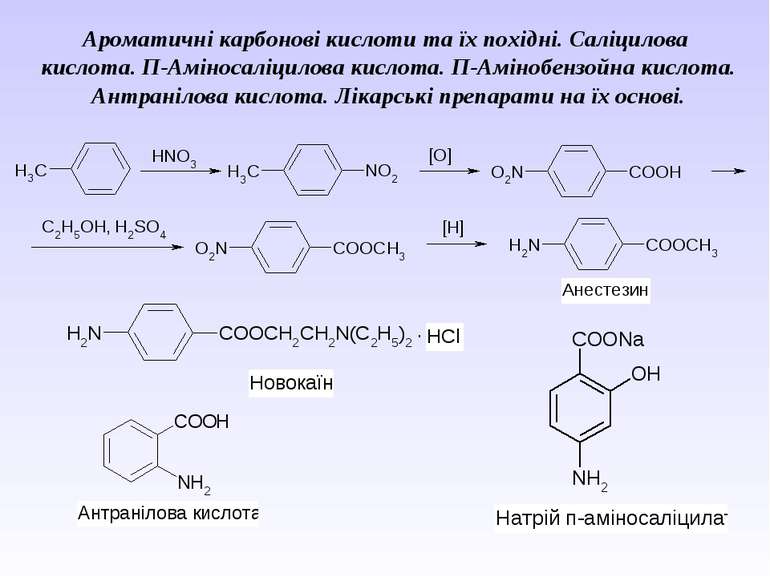
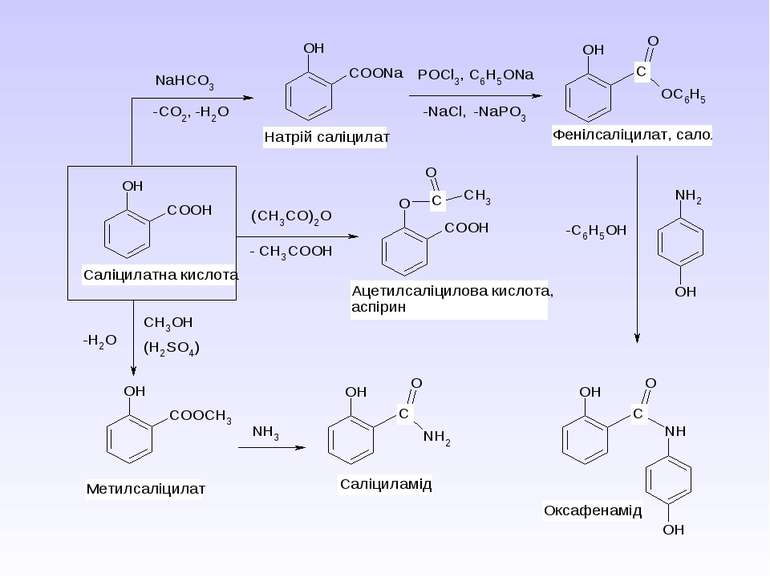
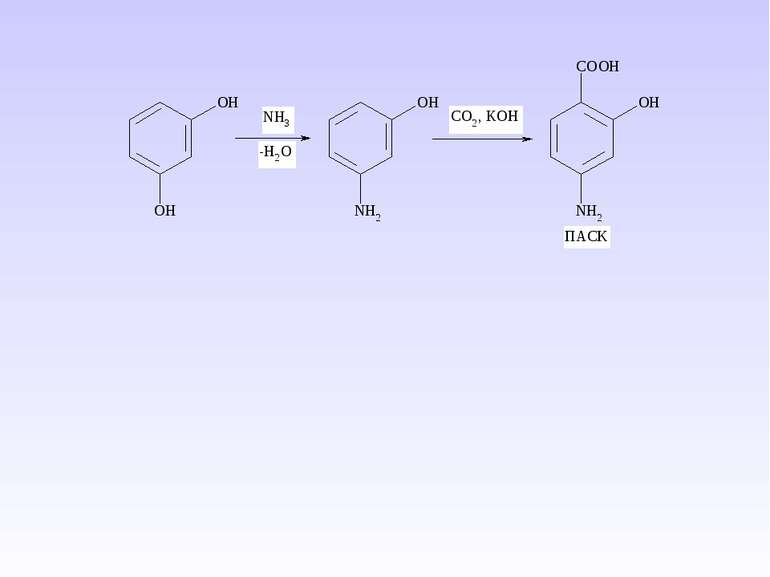
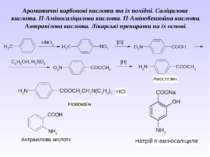
Ароматичні карбонові кислоти та їх похідні. Саліцилова кислота. П-Аміносаліцилова кислота. П-Амінобензойна кислота. Антранілова кислота. Лікарські препарати на їх основі.
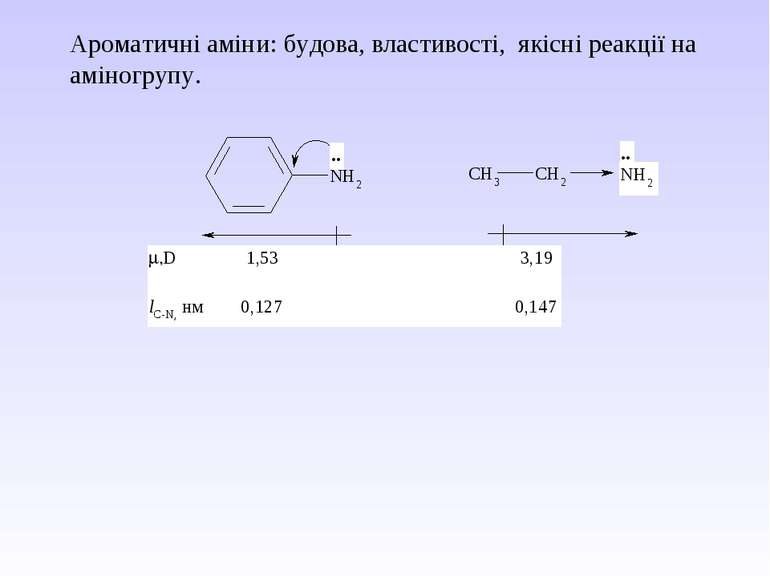
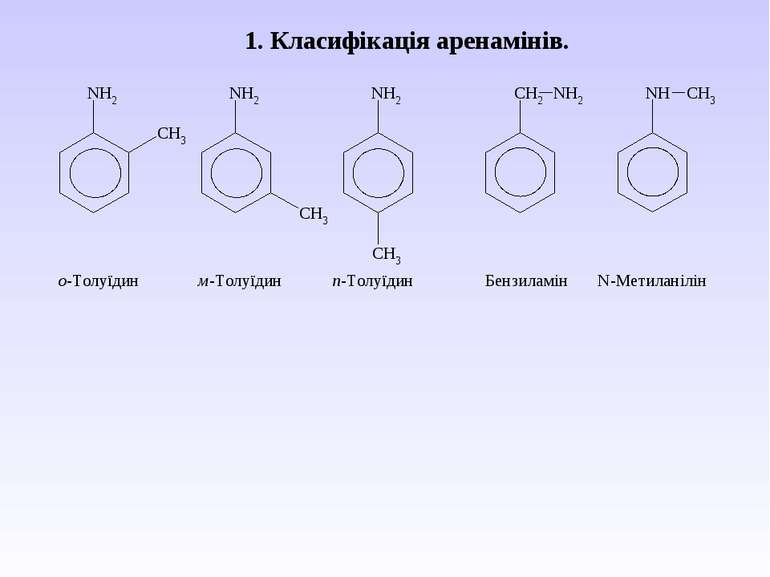
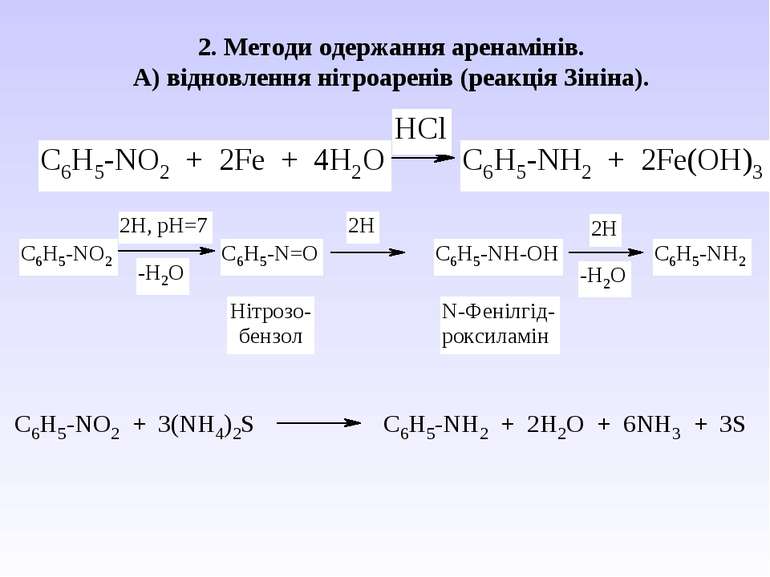
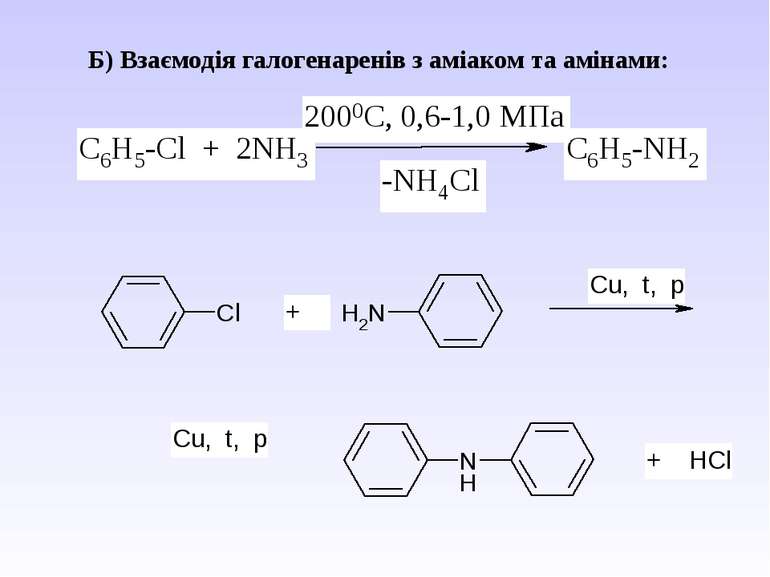
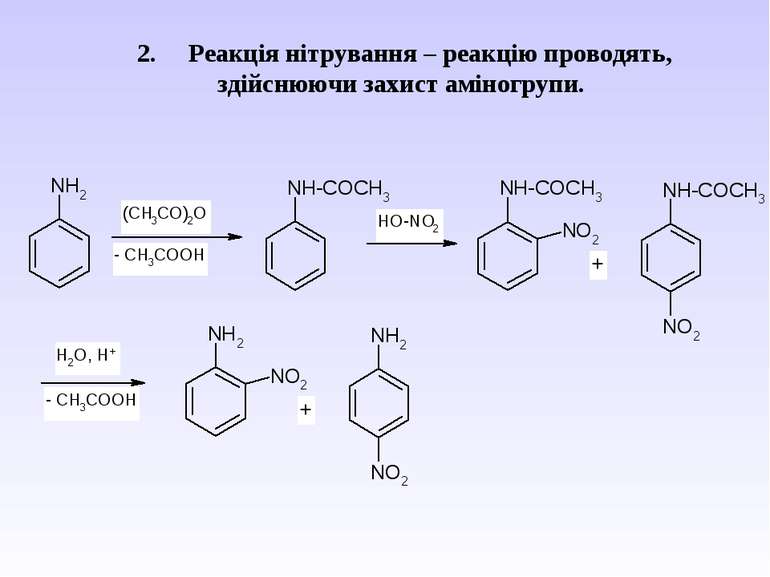
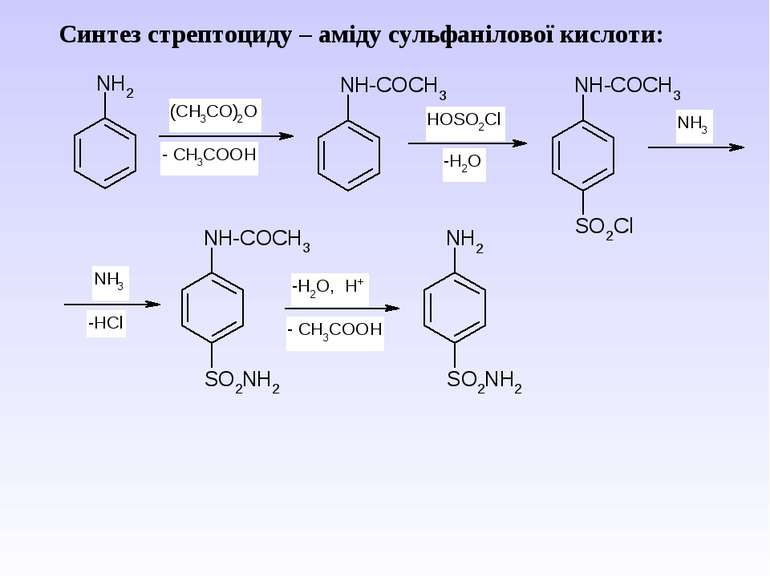
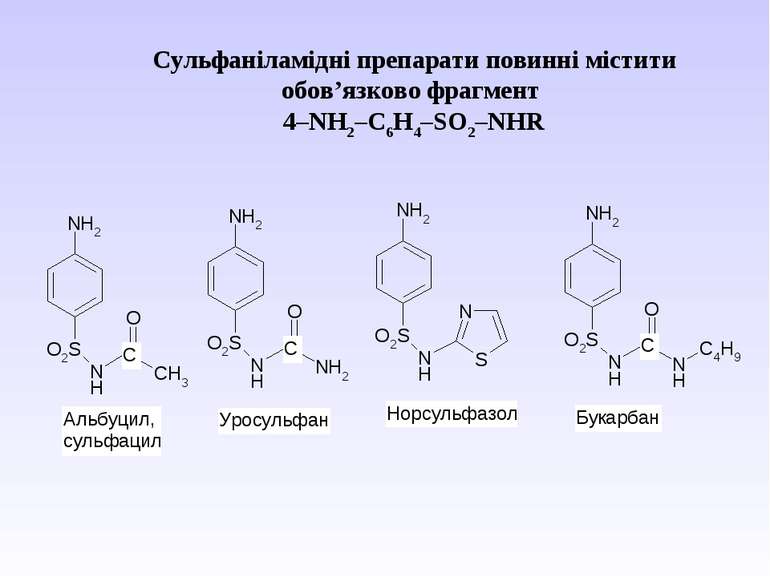
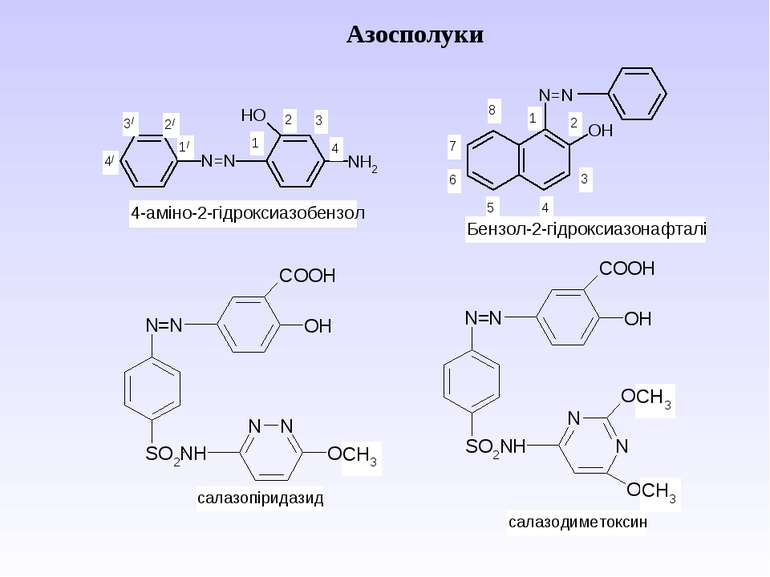
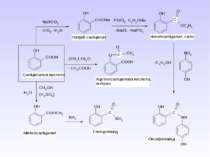
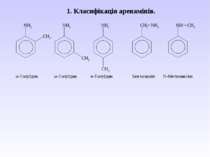
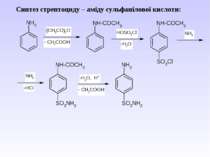
Ароматичні аміни. Сульфанілова кислота. Синтез стрептоциду. Сульфаніламідні препарати. Лікарські препарати, похідні п-амінобензойної кислоти (ПАБК). Антранілова кислота. Азо- і діазосполуки. Фізичні основи теорії кольоровості. Азобарвники. 1. Класифікація амінів. Способи одержання ароматичних амінів. 2. фізичні властивості. 3. Будова аренамінів та її зв’язок з хімічними властивостями. А. Основність амінів. Б. Реакції за участю аміно-групи: - алкілування; - ацилювання; - утворення ізоціанідів; - взаємодія з нітритною кислотою; - взаємодія з альдегідами.
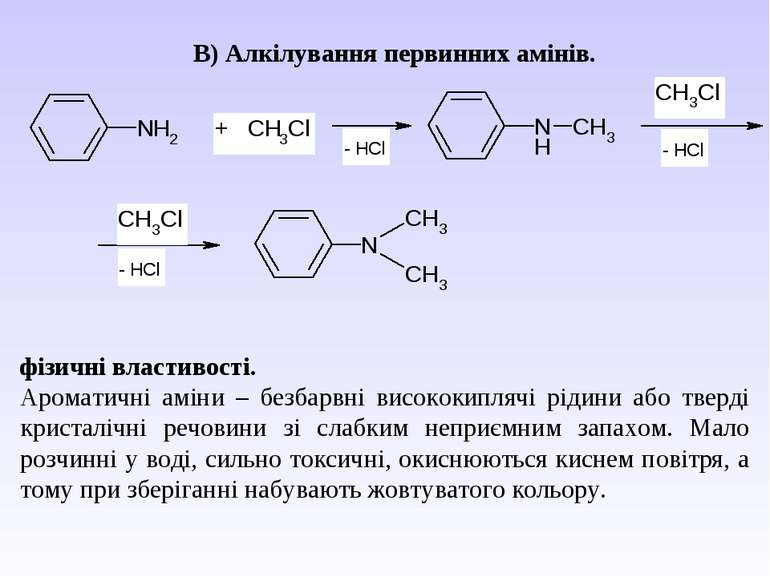
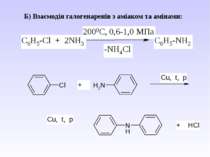
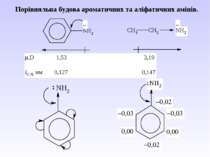
В) Алкілування первинних амінів. фізичні властивості. Ароматичні аміни – безбарвні висококиплячі рідини або тверді кристалічні речовини зі слабким неприємним запахом. Мало розчинні у воді, сильно токсичні, окиснюються киснем повітря, а тому при зберіганні набувають жовтуватого кольору.
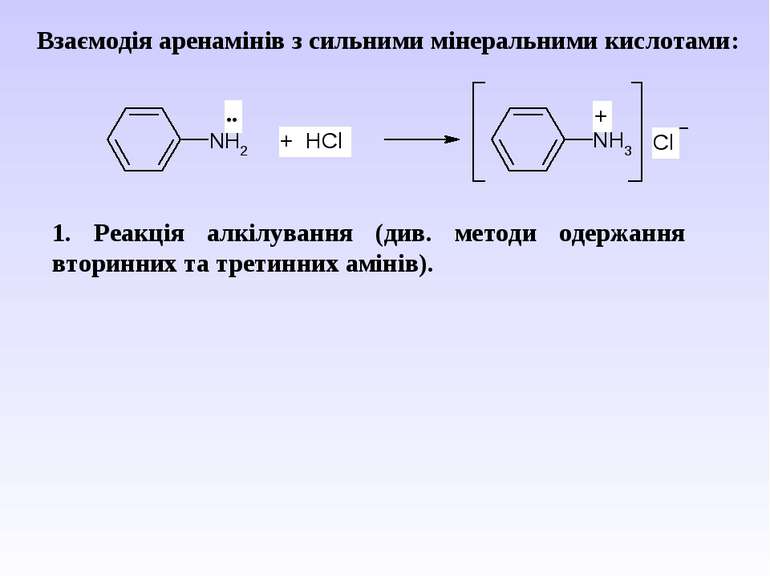
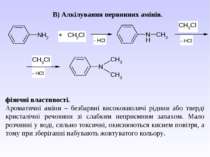
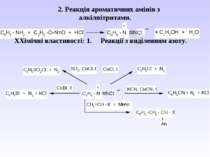
Взаємодія аренамінів з сильними мінеральними кислотами: 1. Реакція алкілування (див. методи одержання вторинних та третинних амінів).
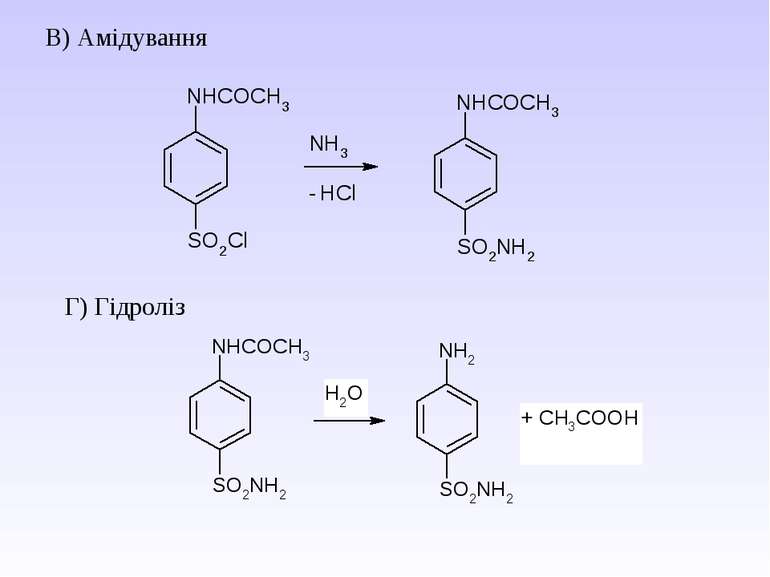
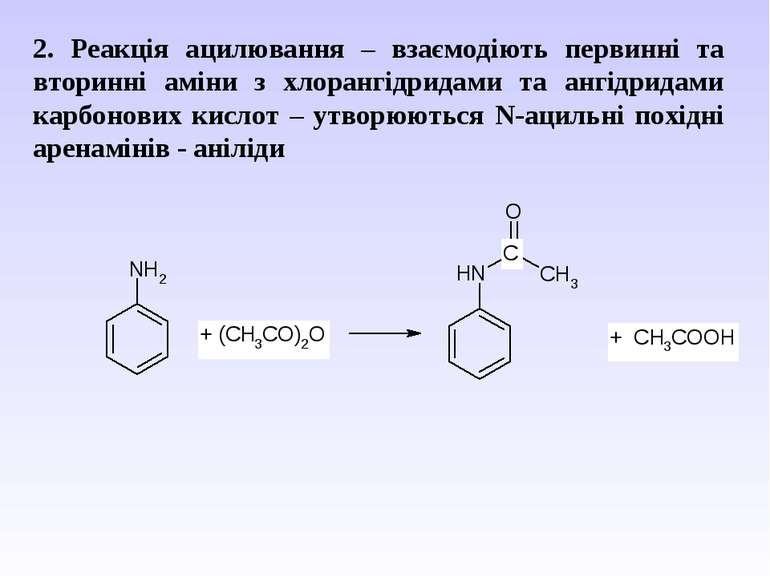
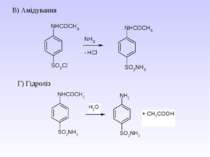
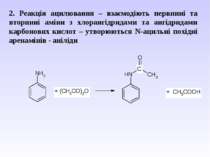
2. Реакція ацилювання – взаємодіють первинні та вторинні аміни з хлорангідридами та ангідридами карбонових кислот – утворюються N-ацильні похідні аренамінів - аніліди
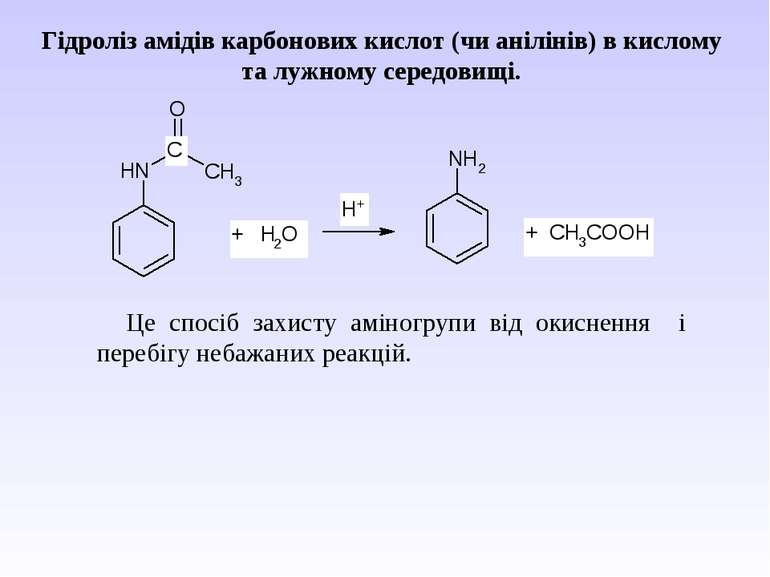
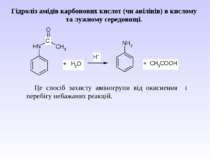
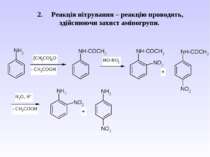
Гідроліз амідів карбонових кислот (чи анілінів) в кислому та лужному середовищі. Це спосіб захисту аміногрупи від окиснення і перебігу небажаних реакцій.
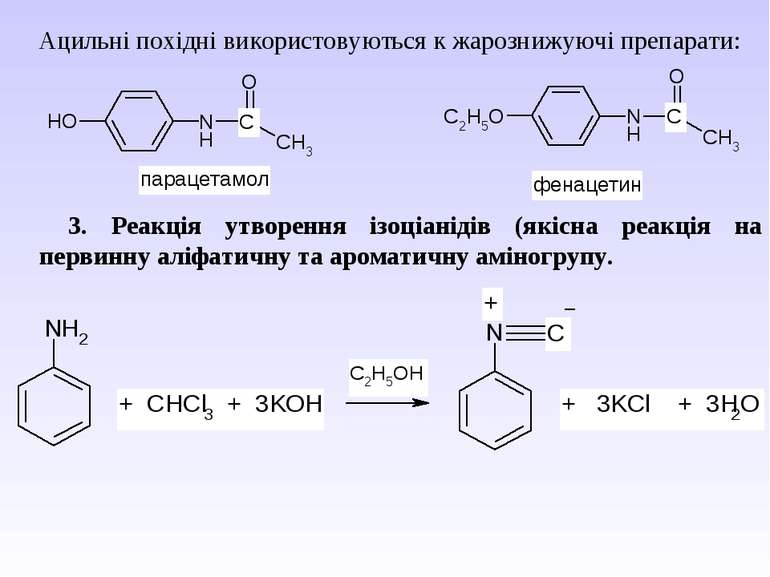
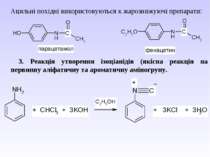
Ацильні похідні використовуються к жарознижуючі препарати: 3. Реакція утворення ізоціанідів (якісна реакція на первинну аліфатичну та ароматичну аміногрупу.
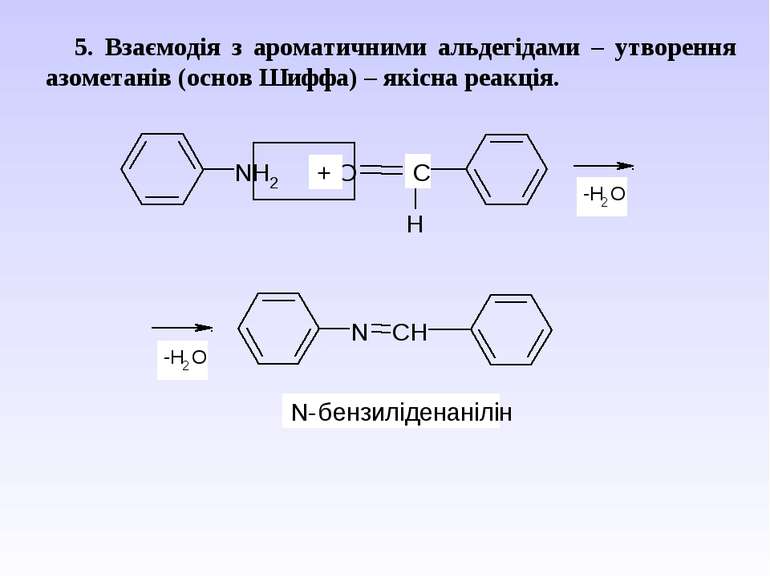
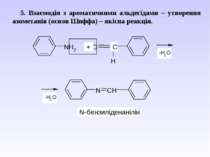
5. Взаємодія з ароматичними альдегідами – утворення азометанів (основ Шиффа) – якісна реакція.
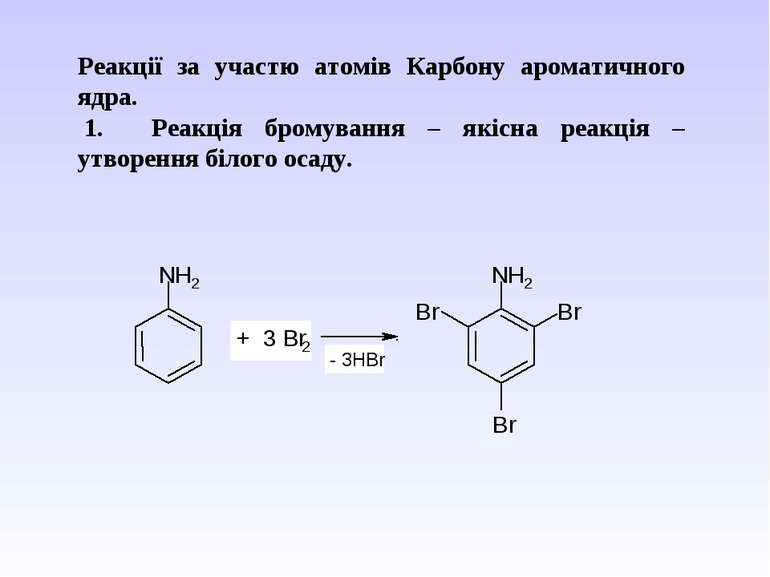
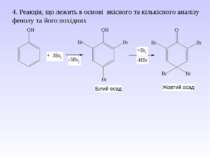
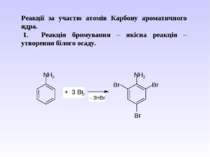
Реакції за участю атомів Карбону ароматичного ядра. 1. Реакція бромування – якісна реакція – утворення білого осаду.
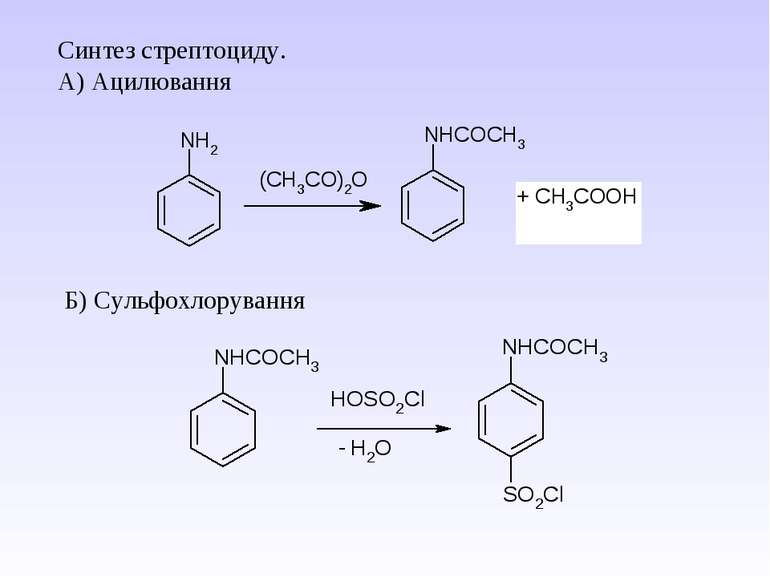
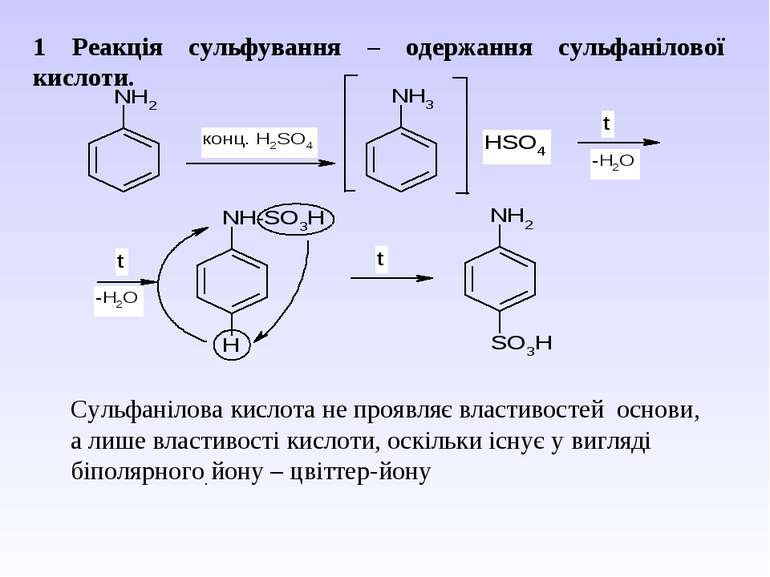
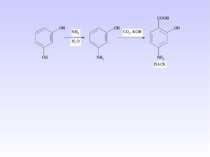
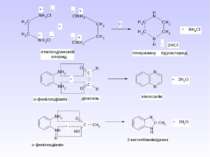
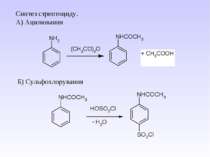
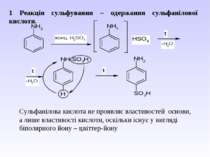
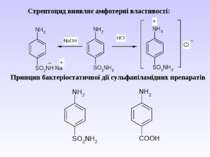
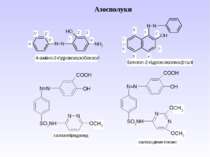
1 Реакція сульфування – одержання сульфанілової кислоти. Сульфанілова кислота не проявляє властивостей основи, а лише властивості кислоти, оскільки існує у вигляді біполярного йону – цвіттер-йону
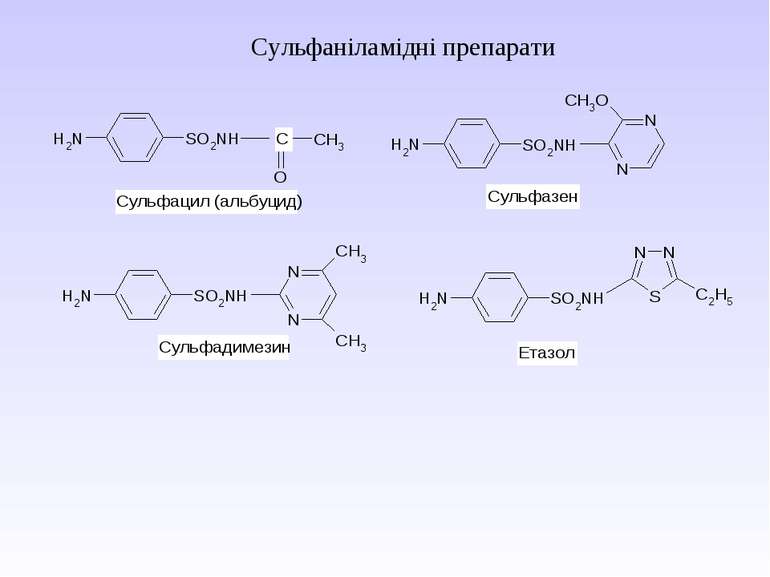
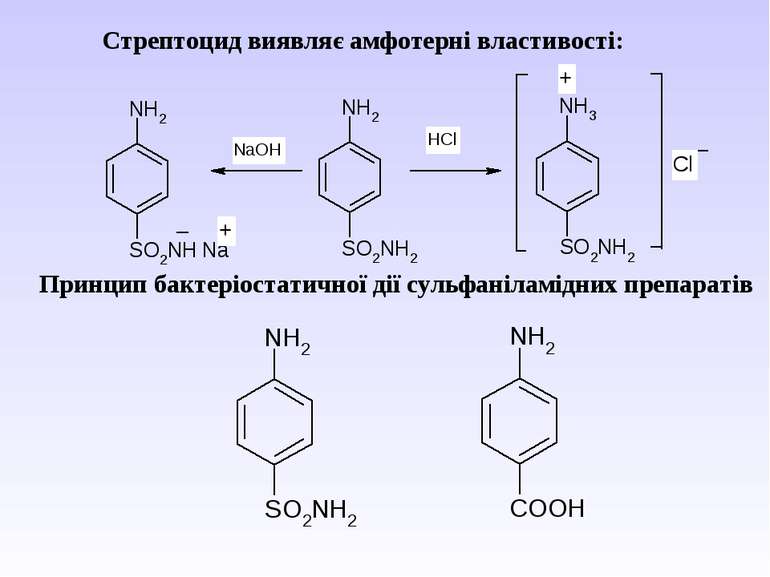
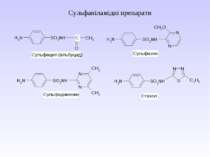
Стрептоцид виявляє амфотерні властивості: Принцип бактеріостатичної дії сульфаніламідних препаратів
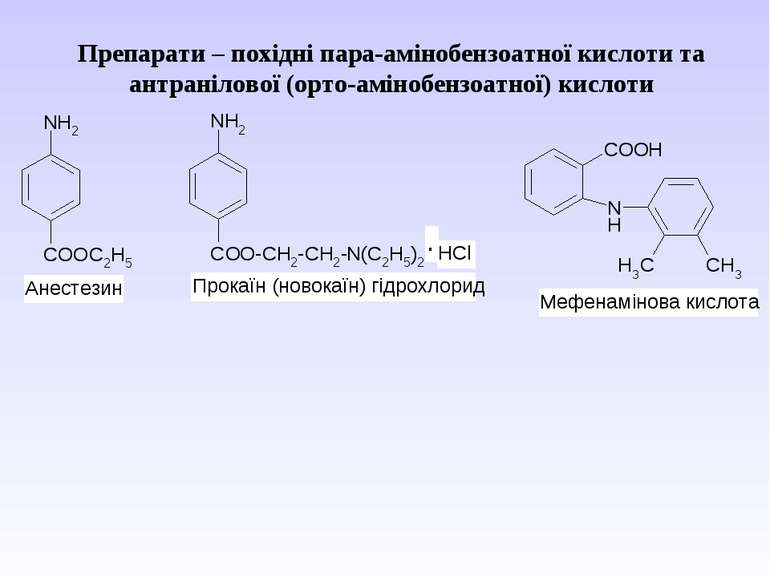
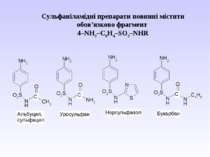
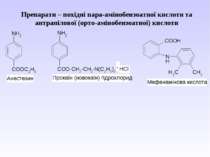
Препарати – похідні пара-амінобензоатної кислоти та антранілової (орто-амінобензоатної) кислоти
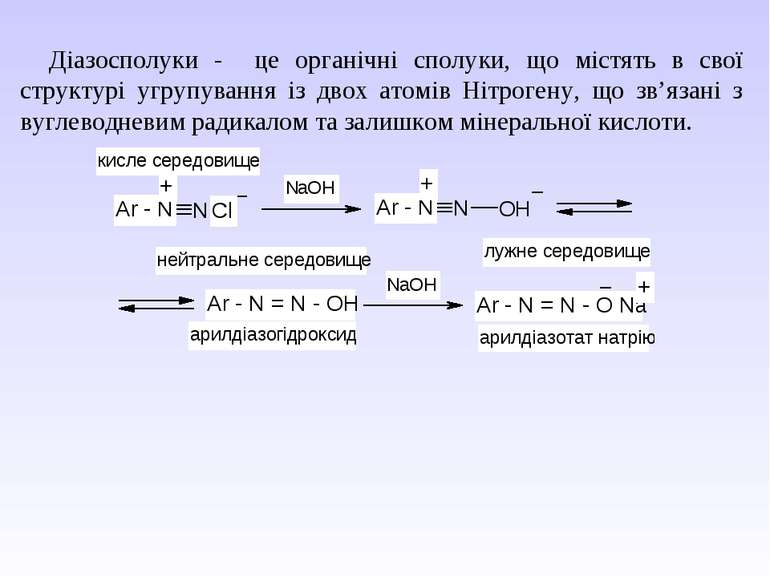
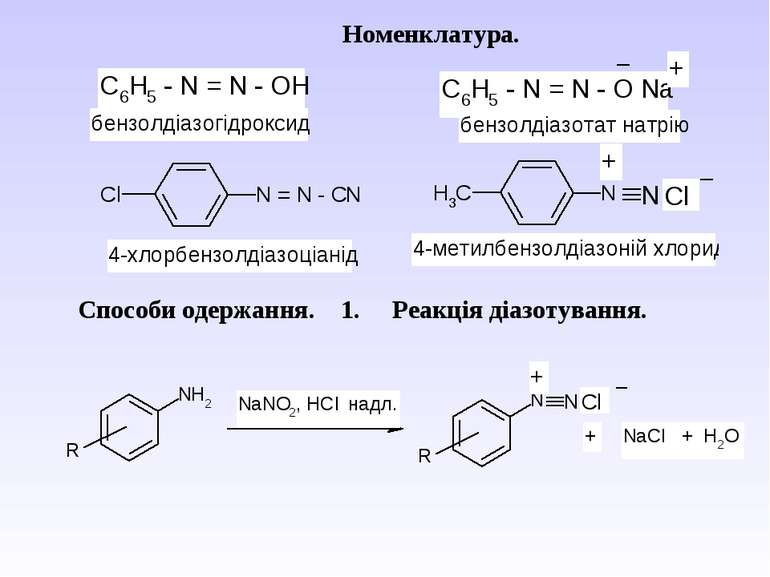
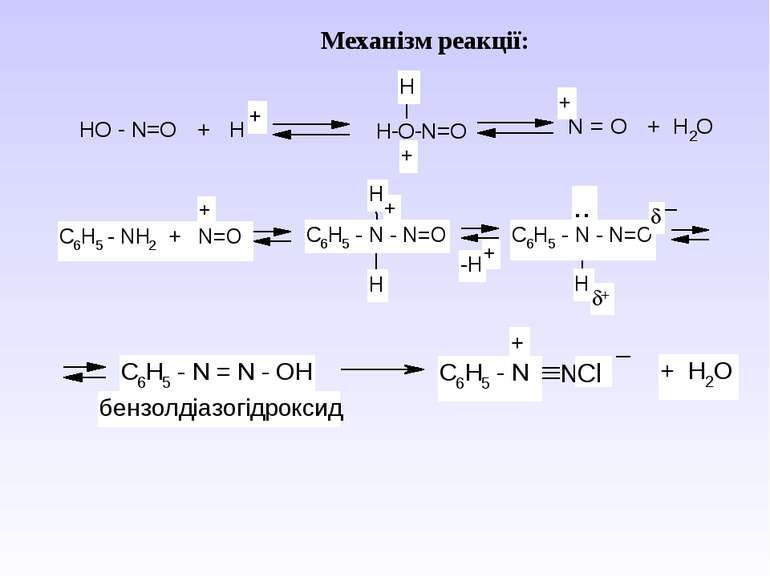
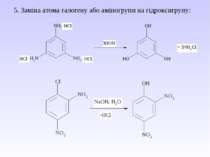
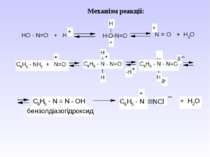
Діазосполуки - це органічні сполуки, що містять в свої структурі угрупування із двох атомів Нітрогену, що зв’язані з вуглеводневим радикалом та залишком мінеральної кислоти.
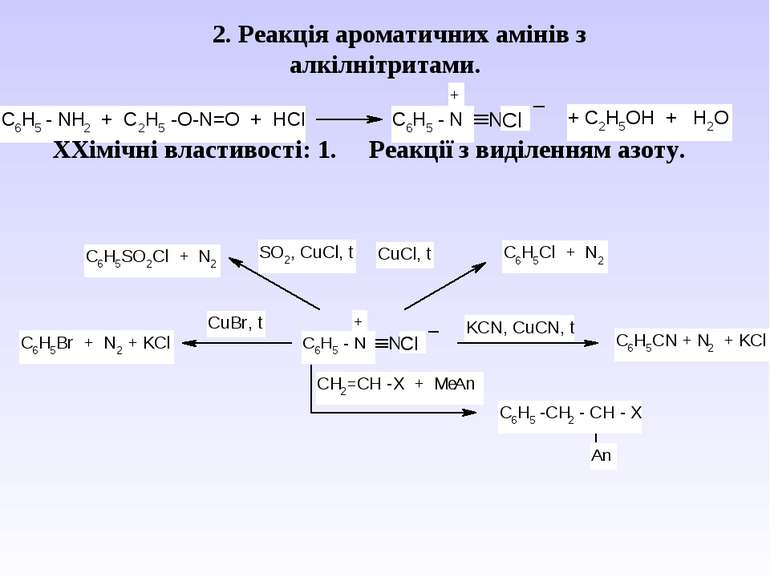
2. Реакція ароматичних амінів з алкілнітритами. ХХімічні властивості: 1. Реакції з виділенням азоту.
Схожі презентації
Категорії