Презентація на тему:
Окисно-відновні процеси навколо нас
Завантажити презентацію
Окисно-відновні процеси навколо нас
Завантажити презентаціюПрезентація по слайдам:
Окисно-відновні процеси навколо нас Овсієнко Наталія Іванівна, вчитель хімії, Черкаської загальноосвітньої школи І-ІІІ ступенів №26 Черкаської міської ради Черкаської області
Мета проекту Вивчити окисно - відновні процеси які оточують людину та забезпечують її життєдіяльність
План роботи над проектом Збір інформаційного матеріалу Аналіз матеріалу Створення міні проектів: Окисно-відновні реакції у живій природі Окисно-відновні реакції у навколишньому середовищі Окисно-відновні реакції у побуті Окисно-відновні реакції у хімічній промисловості та металургії Створення слайд-фільму
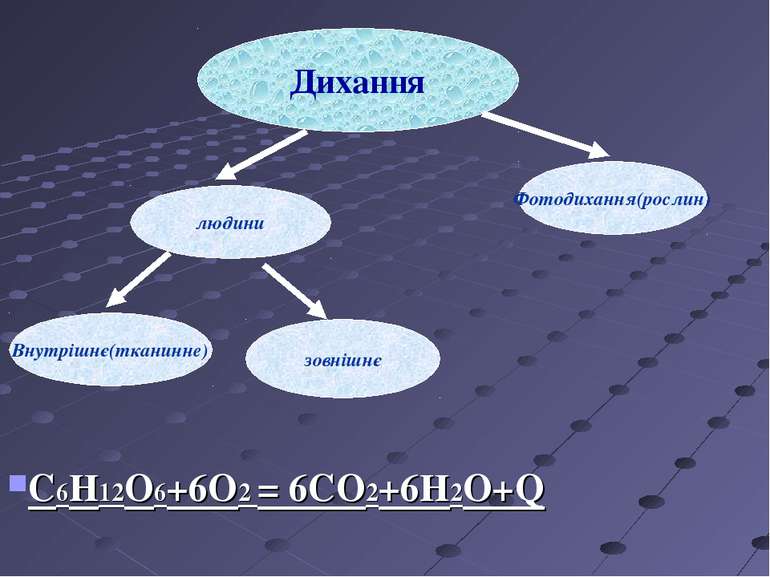
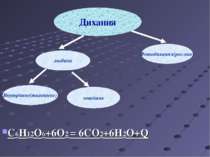
Окисно-відновні реакції у живій природі Фотосинтез Дихання Хемосинтез Колообіг хімічних елементів у природі
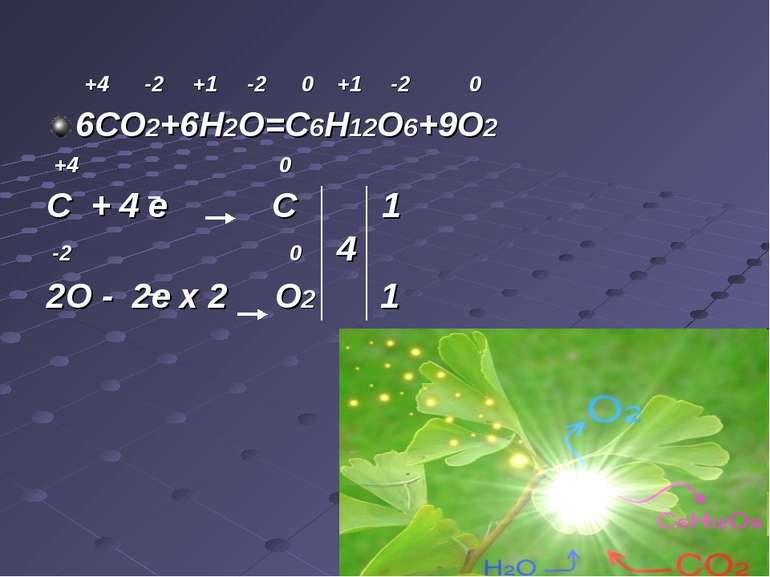
Фотосинтез Фотоси нтез— процес синтезу органічних сполук з вуглекислого газу та води з використанням енергії світла й за участю фотосинтетичних пігментів з виділенням кисню як побічного продукту.
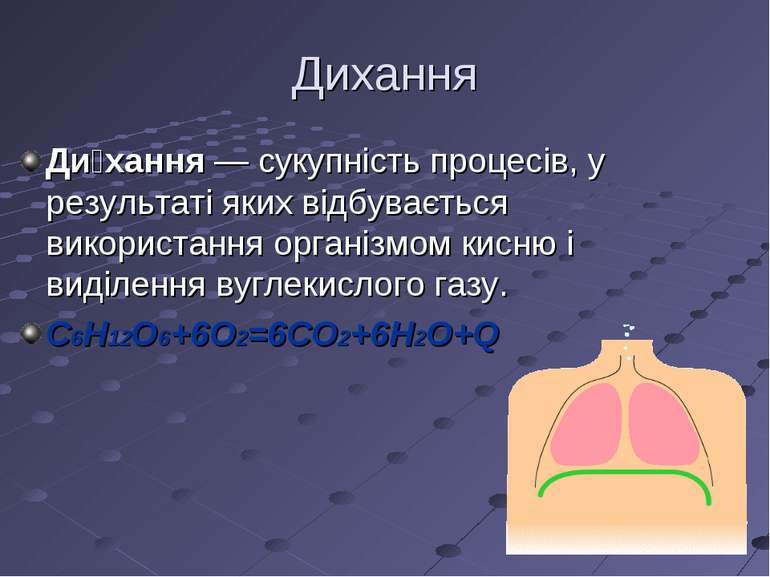
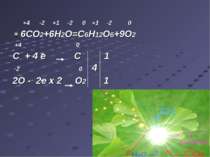
Дихання Ди хання — сукупність процесів, у результаті яких відбувається використання організмом кисню і виділення вуглекислого газу. C6H12O6+6O2=6CO2+6H2O+Q
Хемосинтез Хемоси нтез — це процес синтезу органічних речовин з вуглекислого газу і води з використанням енергії хімічних реакцій,що відбуваються в клітинах організмів(сіркобактерій ,нітрифікуючих і залізобактерій) Значення: хемотрофи беруть участь в утворенні гірських порід, спричиняють корозію металів.Імовірно,що саме за участю хемосинтетиків на дні деяких боліт на протязі багатьох мільйонів років утворилися поклади залізних і марганцевих руд.
Робота : Нітрифікуючих бактерій 2NH3+3O2 = 2HNO2+2H2O 2HNO2+O2 = 2HNO3 Залізобактерій 4FeCO3+O2+6H2O = 4Fe(OH)3+4C O2 Cіркобактерій 2S+3O2+2H2O = 2H2SO4
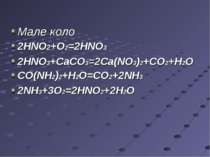
Колообіг хімічних елементів у природі Колообіг азоту(N2) Велике коло N2+ O2 = 2NO 2NO+ O2 = 2NO2 2NO2 + H2O = HNO3+ HNO2
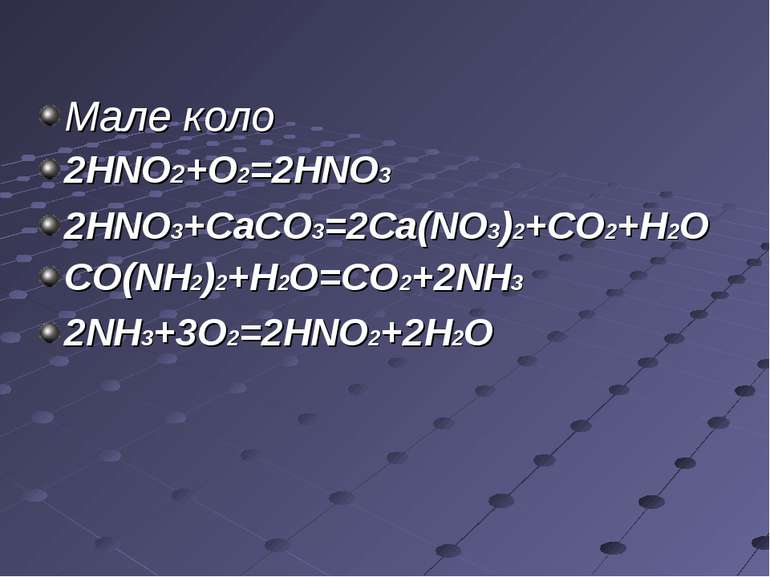
Мале коло 2HNO2+O2=2HNO3 2HNO3+CaCO3=2Ca(NO3)2+CO2+H2O СО(NH2)2+H2O=CO2+2NH3 2NH3+3O2=2HNO2+2H2O
Озоновий шар Озоновий шар — це шар атмосферного озону над пограничним шаром планети (стратосфери) в межах якого концентрація молекул озону в середньому у 10 разів вища, ніж біля поверхні Землі. Властивості озону: - Здатність поглинати біологічно небезпечне ультрафіолетове випромінювання Сонця. Озон - найсильніший окисник - Здатність поглинати інфрачервоне випромінювання земної поверхні. - Здатність прямим і непрямим чином впливати на хімічний склад атмосфери.
Існує велика кількість причин ослаблення озонового щита, викликаного антропогенною діяльністю. Загалом їх можна об'єднати у дві групи. 1. Викиди висотних літаків і ракет По-перше, - це запуски космічних ракет. По-друге, - літаки. Особливо ті, що летять на висотах в 12-15 км. Пара, що викидається ними, й інші речовини руйнують озон. По-третє, - оксиди нітрогену. Найбільше їх виділяється з поверхні ґрунту, особливо при розкладанні азотних добрив.
Як з'ясувалося, основний каталізатор розкладу озону - оксид нітрогену NO. Потрапляючи в озоносферу, він вступає в цикл реакцій: O30 + N+2O-2 → N+4O2-2 + O20, N+4O2-2 + O0 → N+2O-2 + O20, В результаті яких вміст в атмосфері оксиду нітрогену не змінюється, а стаціонарна концентрація озону знижується.
Хлорофторовуглеці 2. Хлорофторовуглеці (ХФВ), або фреони Інертність фреонів робить їх небезпечними для атмосферного озону. Ультрафіолет руйнує стійкі у звичайних умовах молекули фреонів, які розпадаються на компоненти, зокрема, атомний хлор, який вступає в такі хімічні реакції: Cl0 + O30 → Cl+2O-2 + O20 Cl+2O-2 + O0 → Cl0 + O20
Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як діоксид сульфуру (SO2) і різних оксидів нітрогену. Дані процеси пов’язані з наступними хімічними реакціями: 1. 2S+4O2-2 + О20 = 2S+6O3-2 2. S+6O3-2 + Н2+1О-2= H2+1S+6O4-2 3. S+4O2-2 + H2+1O-2 = H2+1S+4O3-2 4. 2H2+1S+4O3-2 + O20 = 2H2+1S+6O4-2 5. N20+O20 = 2N+2O-2 6. 2N+2O-2+O20 = 2N+4O2-2 7. 2N+4O2-2+H2+1O-2 = H+1N+5O3-2+H+1N+3O2-2 Рівняння 1, 4, 5, 6, 7 є окисно-відновними Кисло тний дощ — усі види метеорологічних опадів: дощ, сніг, град, туман, дощ зі снігом, — кислотність яких вища від нормальної. Кислотний дощ
Як запобігти руйнуванню озонового шару і зменшити кількість кислотних дощів Як запобігти утворенню озонової діри 1) Хочете допомогти - відмовтеся від аерозольних упаковок, будь то дезодоранти, освіжувачі. 2) Не випускайте фреон - стежте за цілісністю системи в холодильнику, автомобілі. 3) Протестуйте разом з «зеленими», підписуйте відозви урядам світу - чим більше активістів, тим більше шанс, що вас почують. Заходи для зменшення кількості кислотних дощів та очищення повітря 1) Зменшення кількості ТЕС за рахунок будівництва більш потужних, забезпечених новітніми системами очищення й утилізації (корисного використання) газу та пилу. Як відомо, одна потужна ТЕС забруднює повітря менше, ніж сотня котелень тієї самої сумарної потужності. 2) Очищення вугілля до його надходження в топки ТЕС від піриту (сірчаного колчедану). 3) Регулювання двигунів внутрішнього згорання в автомобілі, встановлення на них спеціальних каталізаторів, що нейтралізують чадний газ до СО. 4) Озеленення місті сіл. 5) Правильне планування житлових і промислових районів у межах міста .
Коро зія металів — процес хімічного руйнування металів і сплавів при їх взаємодії з зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну і електрохімічну.
Хімічна корозія Відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів. Великої шкоди завдає її різновидність газова корозія – взаємодія металів з киснем повітря. 2Zn0 + O20 = 2Zn+2O-2 Електрохімічна корозія Виникає при контакті двох металів у середовищі водних розчинів електролітів та супроводжується переміщенням валентних електронів з одної ділянки металу на іншу. Прикладом такої корозії є утворення іржі.
Утворення іржі Іржавіння заліза - це електрохімічний процес, який починається з перенесення електронів від заліза до кисню. Швидкість корозії залежить від кількості наявної води та прискорюється електролітами. Ключовими реакціями утворення іржі є перетворення заліза на ферум (ІІ) гідроксид та подальше його перетворення на ферум (ІІІ) гідроксид : 2Fe + 2H2O + O2 = 2Fe(OH)2; 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Історичні події очима хіміка В III в. до н.е. на острові Родос був побудований пам'ятник у вигляді величезної статуї Геліоса (у греків – бог Сонця). Грандіозний задум і досконалість виконання Колоса Родоського – одне із чудес світла – вражали всі, хто його бачив. Ми не знаємо точно, як виглядала статуя, але відомо, що вона була зроблена із бронзи й досягала у висоту близько 33 м. Статуя була створена скульптором Харетом, на її будівництво пішло 12 років. Бронзова оболонка кріпилася до залізного каркаса. Порожню статую почали будувати знизу й, у міру того як вона росла, заповнювали каменями, щоб зробити її стійкіше. Приблизно через 50 років після завершення будівництва Колос звалився. Під час землетрусу він переломився на рівні колін. Учені вважають, що дійсною причиною недовговічності цього чуда стала корозія металу. А в основі процесу корозії лежать окисно-відновні реакції.
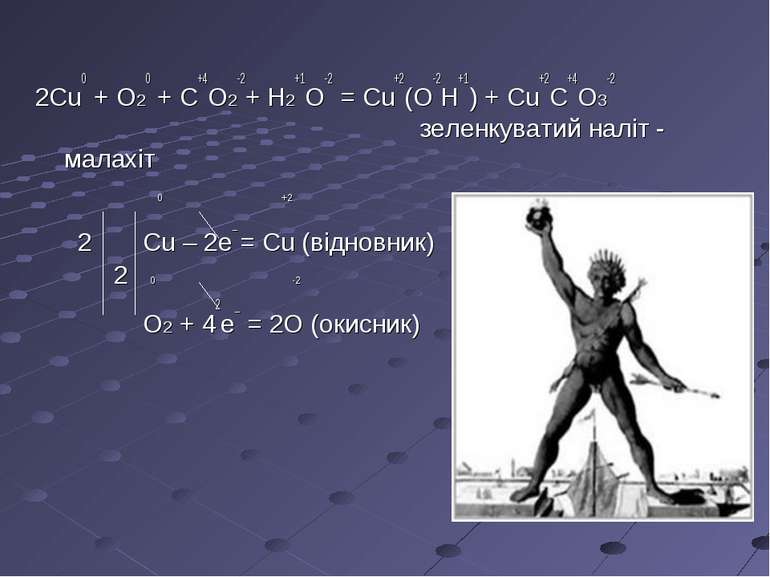
2Cu0 + O20 + C+4O2-2+ H2+1O-2 = Cu+2(O-2H+1) + Cu+2C+4O3-2 зеленкуватий наліт - малахіт 0 +2 2 Cu – 2e_ = Cu (відновник) 2 0 -2 O2 + 42e_ = 2O (окисник)
Затемнення срібних виробів 4Ag0 + 2H2+1S-2 + O20 = 2Ag2+1S-2 + 2H2+1O-2 4 Ag0 – 1e_ = Ag+1 (відновник) 4 O20 + 4e_ = 2O2-2 (окисник) Як слід доглядати за сріблом Уникайте використання грубих губок або абразивних речовин при чищенні срібла. Це може привести до мікроподряпини, потьмяніння вироби, виправити яке можна буде тільки за допомогою професійної полірування. Для регулярного догляду за сріблом можна замочити виріб в мильній воді, ретельно прополоскати, видалити вологу і відполірувати замшею. У разі значного забруднення або почорніння краще чистити срібло в ювелірній майстерні.
Окисно-відновні реакції у побуті Горіння звичайного сірника – окисно-відновна реакція При цьому відбуваються такі процеси: 4Р0 + 5О20 -> 2Р2+5О5-2 6Р0 + 5К+1СІ+5О3-2 -> 3Р2+5О5-2 + 5К+1СІ-1 3S0 + 2K+1Cl+5O3-2 -> 3S+4O2-2 + 2K+1СІ-1
Горіння природного газу: C-4H4+1 + 2O20 = С+4О2-2 + 2Н2+1О-2 Бенгальські вогники: 4K+1Cl+5O3-2 + (С60Н10+1О5-2)n = = 4K+1Cl-1+6nC+4O22 + 5nН2+1О-2
Виробництво Н2SO4 Виробництво сульфатної кислоти складається з трьох стадій: добування сульфур (IV) оксиду, окиснення його в сульфур (VI) оксид і поглинання його сульфатною кислотою.
Перша стадія процесу — випалювання колчедану і добування діоксиду сульфуру: 4Fe+2S2-2 + 11O20 = 2Fe2+3O3-2 + 8S+4O2-2 Друга стадія — окиснення діоксиду сульфуру і добування триоксиду сульфуру: 2S+4O2-2 + O20 = 2S+6O3-2 Третя стадія виробництва—поглинання триоксиду сульфуру й утворення сульфатної кислоти: S+6O3-2 + Н2+1О-2 = H2+1S+6O4-2
Виробництво HNO3 Процес добування нітратної кислоти складається з трьох стадій, кожна з них є окисно-відновною:
І стадія Окиснення амоніаку на платиновому каталізаторі: 4N-3H3+1+5O20=4N+2O-2+6H2+1O-2 II стадія Окиснення нітроген (ІІ) оксиду киснем повітря: 2N+2O-2+O20= 2N+4O2-2 ІІІ стадія Поглинення нітроген (ІV) оксиду водою в присутності великої кількості кисню: 4N+4O2-2+2H2+1O-2+O20=4H+1N+5O3-2
Добування амоніаку у промисловості Амоніак синтезують з простих речовин водню та азоту N20 + 3H20→ 2N-3H3+1 N20+ 63е_ → 2N-3 (окисник.) H20 - 2е_ → 2H+1 (відновник.) Водень добувають розкладом метану: C-4 H4+1 → C0+ 2H20 C-4- 42e_ → C0 (відновник.) 2 2H+1+ 2e_ → H20 (окисник.)
ЧЕРКАСЬКИЙ ПАТ «АЗОТ» Черкаське публічне акціонерне товариство «Азот» є одним з найбільших виробників мінеральних добрив в Україні, яке розпочало відлік в історії становлення та розвитку хімії в регіоні з одержання першої продукції – аміаку – 14 березня 1965 року. 60-ті: розпочате будівництво аміачного виробництва Введена в дію перша черга виробництва амоніаку та карбаміду
ЧЕРКАСЬКИЙ ПАТ «АЗОТ» 70-ті: введені в дію друга та третя черги амоніачного виробництва, слабкої нітратної кислоти та амоніачної селітри.
ЧЕРКАСЬКИЙ ПАТ «АЗОТ» 80-ті: введений у дію цех по виробництву карбаміду введено в дію виробництво капролактаму 90-ті: введено в дію виробництво амоніачної води У 1999 році підприємтсву здійснили реконструкцію устаткування, замінивши його на більш ефективне і сучасне. За підсумками Міжнародного Академічного рейтингу популярності і якості «Золота фортуна» у номінації «Престиж і якість продукції на ринку хімічної продукції» Черкаський «Азот» нагороджений Дипломом і «Стелою срібленої якості» (2002 рік.), а у 2004 р. Черкаський «Азот» став лауреатом Всеукраїнського конкурсу «100 кращих товарів України».
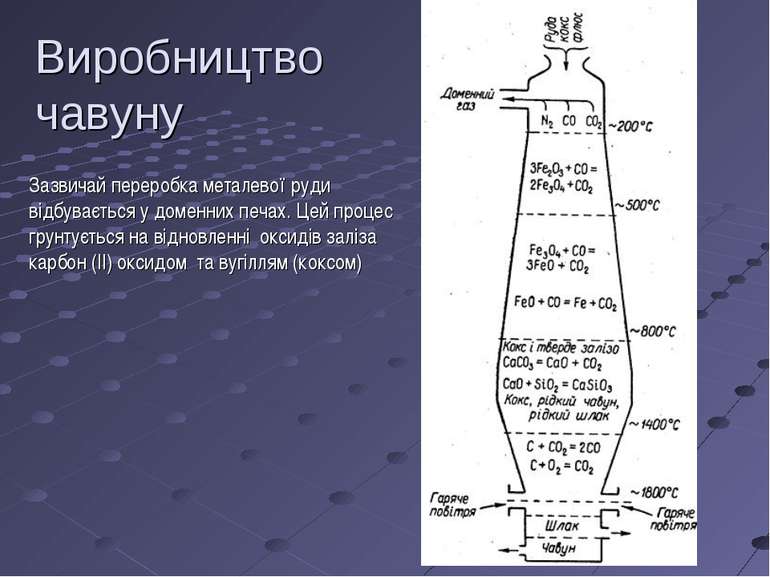
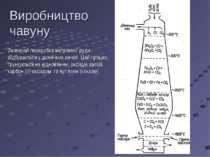
Зазвичай переробка металевої руди відбувається у доменних печах. Цей процес грунтується на відновленні оксидів заліза карбон (ІІ) оксидом та вугіллям (коксом) Виробництво чавуну
Мартенівська піч Мартенівський спосіб характеризується випалюванням надлишку вуглецю в чавуні. Це відбувається за рахунок кисню повітря, а також оксигену оксидів феруму. Вигоряння вуглецю і домішок чавуну в перший період плавки відбувається головним чином за рахунок надлишку кисню в горючій суміші, а коли над розплавленим чавуном утвориться шар шлаку — за рахунок оксидів феруму. +3 0 0 +4 4Fe2O3 + 6Si = 8Fe + 6SiO2 +3 0 0 +2 2Fe2O3 + 6Mn = 4Fe + 6MnO +3 0 0 +2 Fe2O3 + 3C = 2Fe + 3CO ↑ +3 0 +2 +5 5Fe2O3 + 2P = 10FeO + P2O5 +2 0 0 +2 FeO + С = Fe + CO ↑
Металотермічний Цим методом добувають : марганець, хром, титан, молібден, вольфрам. Наприклад: +3 0 +3 0 Сr2O3+2Al=Al2O3+2Cr Іноді метали з їх оксидів відновлюють воднем: +6 0 0 +1 MoO3+3H2=Mo+3H2O
Гідрометалургія Охоплює способи добування металів з розчинів їх солей: +2 0 0 +2 CuSO4+Fe=Cu+FeSO4
Схожі презентації
Категорії