Презентація на тему:
Нітратна кислота
Завантажити презентацію
Нітратна кислота
Завантажити презентаціюПрезентація по слайдам:
Історія 17 ст.- Дж. Глаубер отримав чисту нітратну кислоту реакцією і перегонкою селітри з сірчаною кислотою. 18 ст.- склад кислоти(азот та кисень) вперше визначив Лавуазьє. Точний склад був визначений Генрі Кавендішем. 19 ст.- промислове виробництво почалося лише тоді, коли сірчана кислота та нітрат натрію були доступні в великих кількостях. 1838 рік - сучасний спосіб добування кислоти, каталітичне окислення аміаку на платині було відкрито Ч.Ф. Кульманом.До винаходу синтетичного аміаку названого на честь його першовідкривачів "Аміак Габер і Бош", такий спосіб залишався дуже дорогим у порівнянні з добування з натрієвої селітри. 20 ст. – В. Оствальд започаткував виробництво кислоти з аміаку у промислових масштабах. Зараз дешевий спосіб окислення аміаку замінив всі інші промислові способи добування нітратної кислоти.
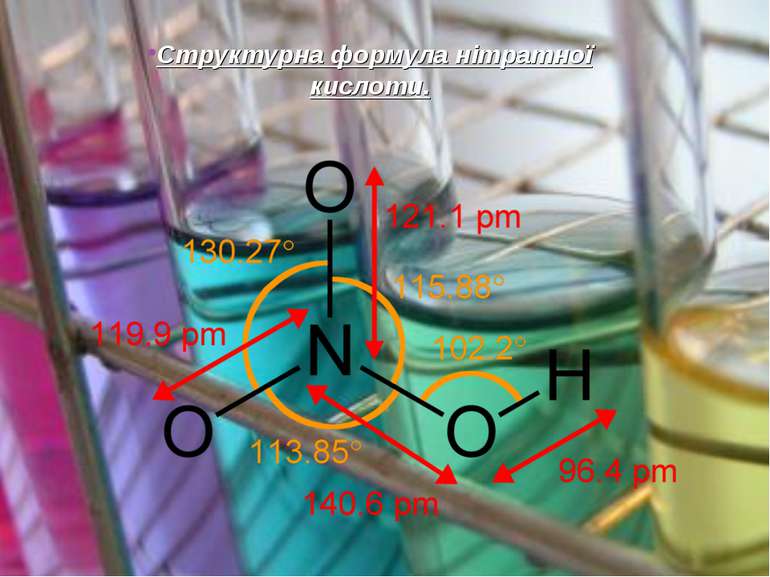
Будова.Тривимірна модель молекули. Один зв'язок з киснем утворюється за донорно-акцепторним механізмом, але через близькість розташування атомів в молекулі стають рівноцінними.
Фізичні властивості безбарвна димуча рідина з їдким запахом Сильний окисник легко розкладається, забарвлення у жовтий колір. tпл=-41,60C tкип=82,60C Концен- трація 68%
Загальні з іншими кислотами: 1. Сильний електроліт , добре дисоціює на іони. HNO3 -> H+ +NO3- Змінює забарвлення індікатора 2. Реагує основними оксидами СuO+2 HNO3 -> Cu(NO3)2 +H2O 3.Реагує з основами HNO3 + KOH -> KNO3 + H2O 4. Реагує з солями більш летких кислот Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3 cуха / \ H2O CO2
Специфічні: 5. При нагріванні та під дією розкладаеться 4HNO3 -> 2H2O +4NO2 + O2 6. Нітратна кислота специфічно взаємодіє з металами, продукти реакції залежать від активності металу і концентрації кислоти (табл.№2) а)4HNO3(конц) + Cu -> Cu(NO3)2 + 2NO2↑ + 2H2O «лисий хвіст» б)4HNO3(разб) + 3Ag -> 3AgNO3 + NO↑ + 2H2O 7.Нітратна кислота сильний окисник. 2HNO3(конц.) + S -> H2SO4 + 2NO 5HNO3 + 3P + 2H2O -> 3H3PO4 + 5NO↑
Таблиця 2 P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30%
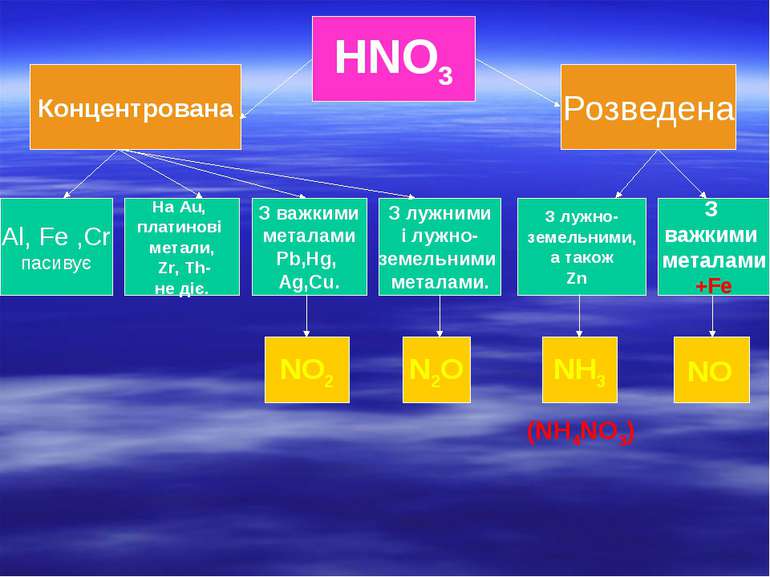
Нітратна кислота HNO3 характеризується деякими специфічними властивостями. Вона є сильним окисником і реагує практично з усіма металами, за виключенням Au і Pt. На відміну від H2SO4, яка має окисні властивості тільки в концентрованому стані, HNO3 є окисником і в розведених розчинах (тому в реакціях з металами водень ніколи не виділяється). Окислювальні властивості HNO3 обумовлені наявністю в її молекулі Нітрогену зі ступенем окиснення +5, який може відновлюватися, знижуючи свій ступінь окиснення до +4, +3, +2, +1, 0, -3. +5 +4 +3 +2 +1 0 HNO3 NO2 HNO2 NO N2O N2 NH3
HNO3 Концентрована Розведена З лужно- земельними, а також Zn З лужними і лужно- земельними металами. З важкими металами Pb,Hg, Ag,Cu. На Au, платинові метали, Zr, Th- не діє. NO2 N2O NH3 NO (NH4NO3) Al, Fe ,Cr пасивує З важкими металами +Fe
Нітратна кислота є одним з найважливіших продуктів хімічної промисловості. Вона виробляється у дуже великих кількостях, використовується для виробництва азотних добрив, у кольоровій металургії для розділення металів, а також хімічній промисловості для виробництва пластмас, вибухових речовин, целулоїду і фотокіноплівки, штучного волокна, органічних барвників, лікувальних речовин тощо.
Схожі презентації
Категорії