Презентація на тему:
Класифікація, властивості та добування основних класів неорганічних сполук
Завантажити презентацію
Класифікація, властивості та добування основних класів неорганічних сполук
Завантажити презентаціюПрезентація по слайдам:
Класифікація, властивості та добування основних класів неорганічних сполук Міков Анатолій Валерійович, учитель хімії Вороненської ЗОШ І-ІІІ ступенів Жашківської районної ради Черкаської області
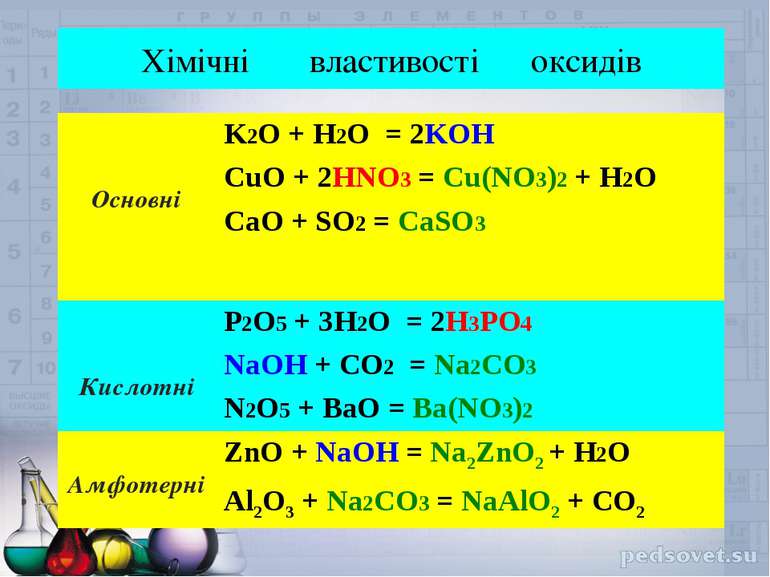
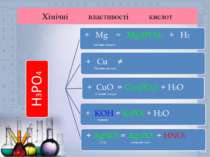
Хімічні властивості оксидів Основні K2O + H2O = 2KOH CuO + 2HNO3 = Cu(NO3)2 + H2O CaO + SO2 = CaSO3 Кислотні P2O5 + 3H2O = 2H3PO4 NaOH + CO2 = Na2CO3 N2O5 + BaO = Ba(NO3)2 Амфотерні ZnO + NaOH = Na2ZnO2 + H2O Al2O3 + Na2CO3 = NaAlO2 + CO2
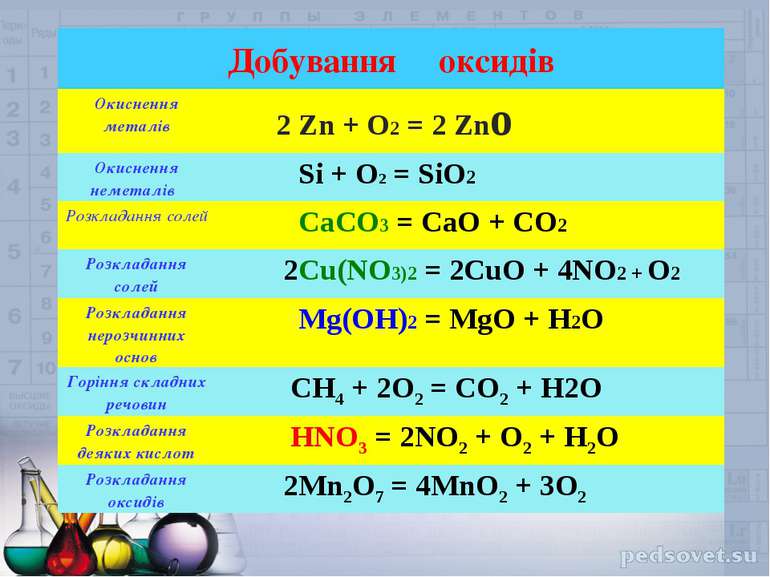
Добування оксидів Окиснення металів 2 Zn + O2 = 2 Zno Окиснення неметалів Si + O2 = SiO2 Розкладання солей CaCO3 = CaO + CO2 Розкладання солей 2Cu(NO3)2 = 2CuO + 4NO2 + O2 Розкладання нерозчинних основ Mg(OH)2 = MgO + H2O Горіння складних речовин CH4 + 2O2 = CO2 + H2O Розкладання деяких кислот HNO3 = 2NO2 + O2 + H2O Розкладання оксидів 2Mn2O7 = 4MnO2 + 3O2
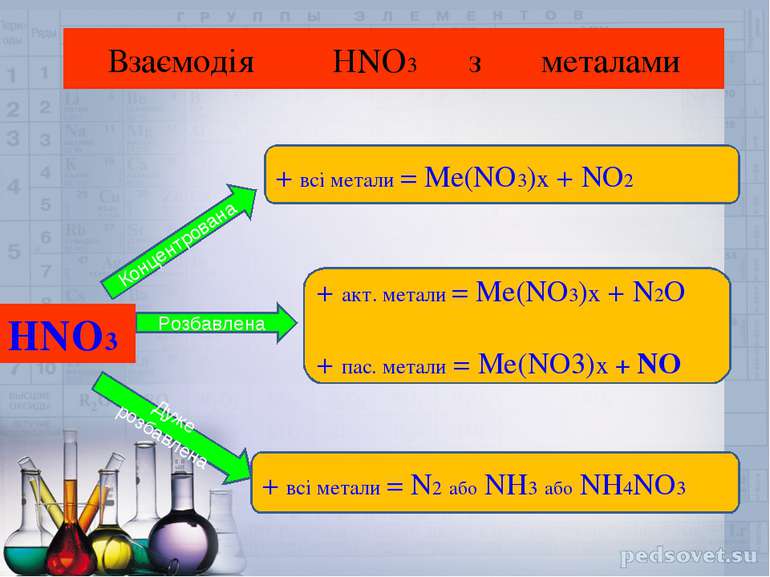
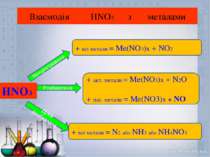
Взаємодія HNO3 з металами HNO3 Концентрована Розбавлена Дуже розбавлена + всі метали = Ме(NO3)x + NO2 + акт. метали = Ме(NO3)x + N2O + пас. метали = Ме(NO3)x + NO + всі метали = N2 або NH3 або NH4NO3
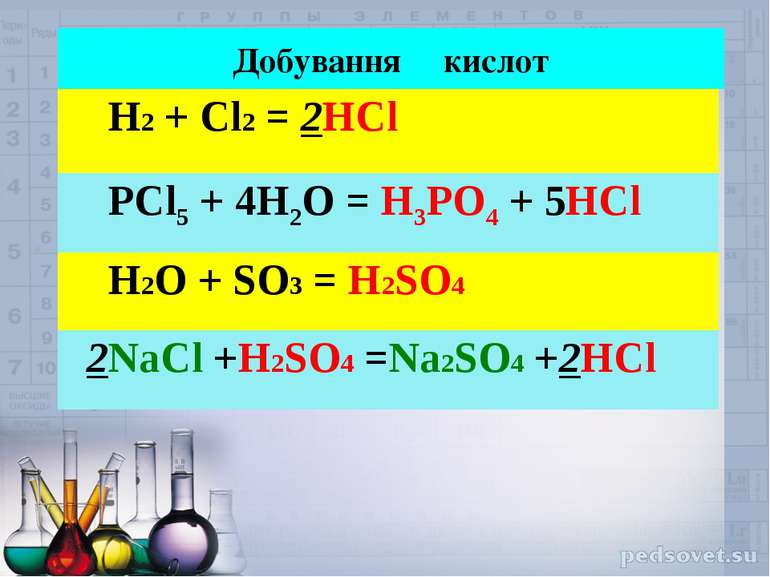
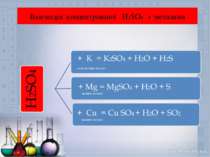
Добування кислот H2 + Cl2 = 2HCl PCl5 + 4H2O = H3PO4 + 5HCl H2O + SO3 = H2SO4 2NaCl +H2SO4 =Na2SO4 +2HCl
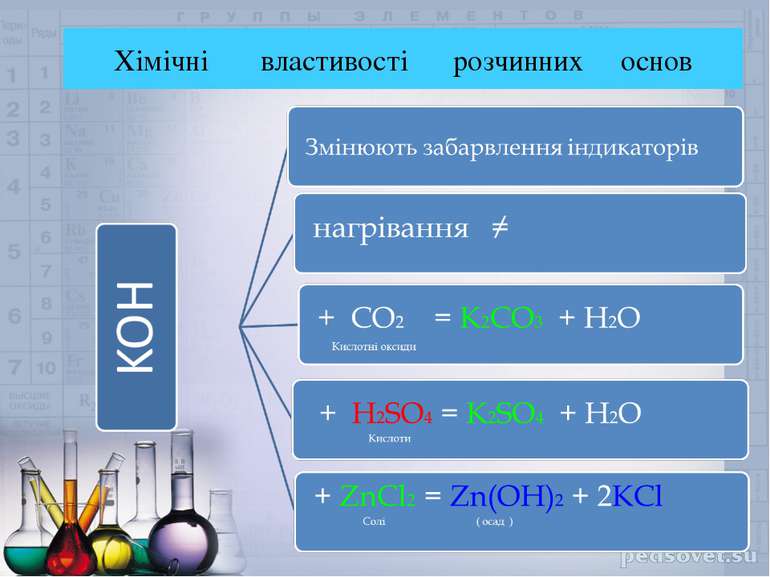
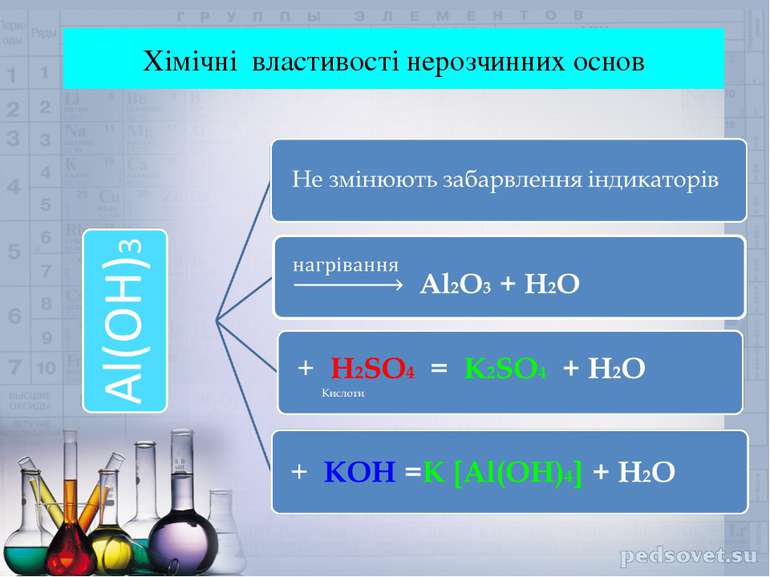
Гідроксиди – це складні речовини ,утворені атомами металів та однією , або декількома гідроксогрупами. Лугами називають електроліти , під час дисоціації яких утворюються гідроксид – аніони ( ОН - ) Ba ( OH )2 Ba2+ + 2OH-
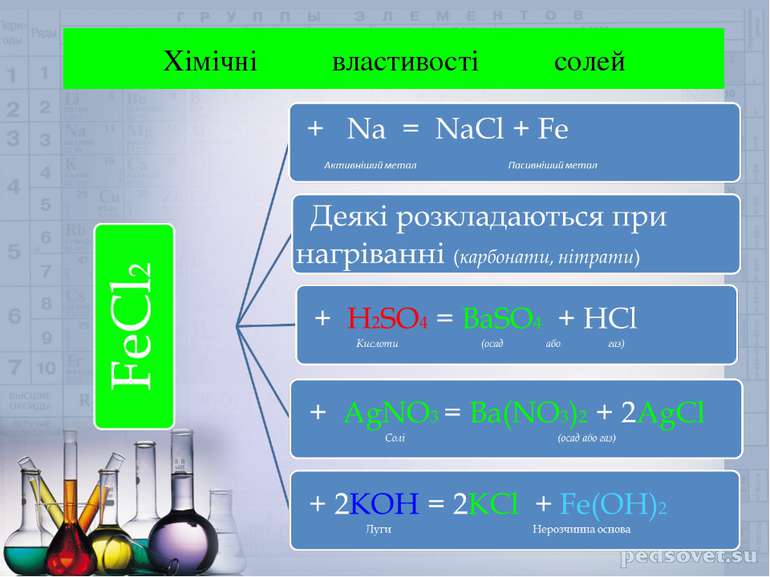
Солі – це складні речовини ,утворені атомами металів та кислотними залишками . KCl ZnSO4 Al(NO3)3 Солі – це електроліти , під час дисоціації яких утворюються катіони металів та аніони кислотних залишків . Al(NO3)3 Al 3+ + 3NO3-
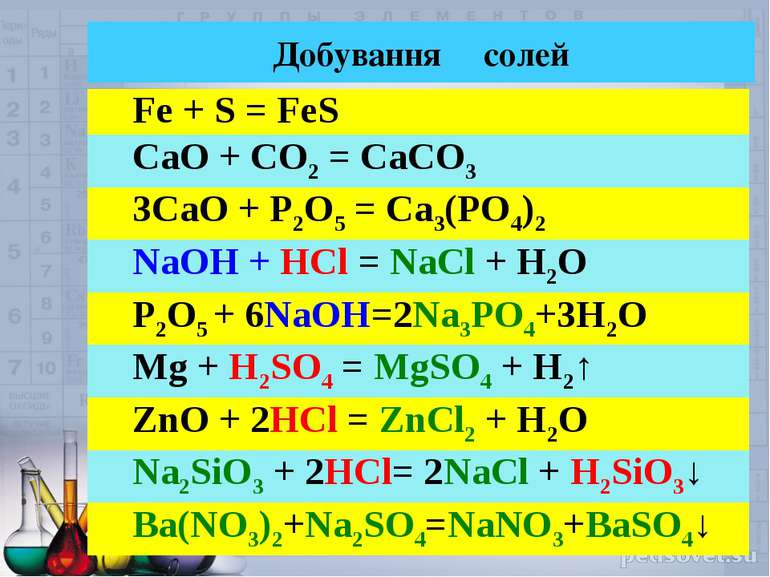
Добування солей Fe + S = FeS CaO + CO2 = CaCO3 3CaO + P2O5 = Ca3(PO4)2 NaOH + HCl = NaCl + H2O P2O5 + 6NaOH=2Na3PO4+3H2O Mg + H2SO4 = MgSO4 + H2↑ ZnO + 2HCl = ZnCl2 + H2O Na2SiO3 + 2HCl= 2NaCl + H2SiO3↓ Ba(NO3)2+Na2SO4=NaNO3+BaSO4↓
Список використаних джерел: Попель П.П., Крикля Л.С. Хімія: Підруч. для 8 кл. загальноосвіт. Навч. Закл. – К.: ВЦ «Академія», 2008. – 232 с.: іл. http://pedsovet.su/load/ http://prezentacii.com/po_himii/ http://www.twirpx.com/files/abit/sc_chemistry/
Схожі презентації
Категорії