Презентація на тему:
Кислотний характер Оксидів і гідратів оксидів. Кислотні дощі.
Завантажити презентацію
Кислотний характер Оксидів і гідратів оксидів. Кислотні дощі.
Завантажити презентаціюПрезентація по слайдам:
Кислотний характер Оксидів і гідратів оксидів. Кислотні дощі. Мета: поглибити знання про кислотні оксиди на прикладі вивчених оксидів сульфуру, нітрогену, карбону, фосфору, силіцію; порівняти їх властивості, розвивати та формувати знання про кислотний характер оксидів; розкрити сутність поняття “кислотні дощі”, розвивати екологічні знання.
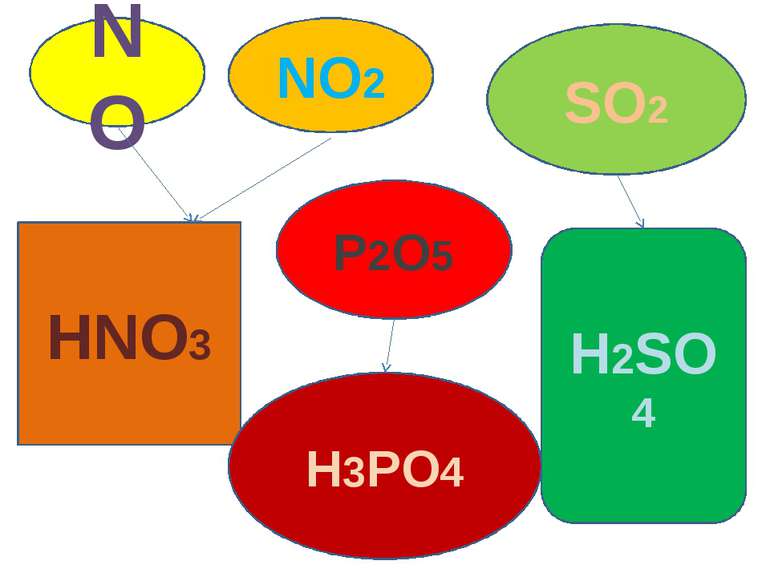
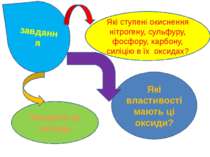
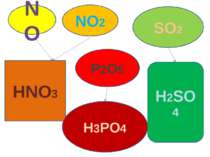
Які ступені окиснення нітрогену, сульфуру, фосфору, карбону, силіцію в їх оксидах? Назвати ці оксиди Які властивості мають ці оксиди? завдання
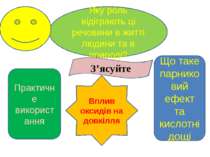
Яку роль відіграють ці речовини в житті людини та в природі? Практичне використання З’ясуйте Вплив оксидів на довкілля Що таке парниковий ефект та кислотні дощі
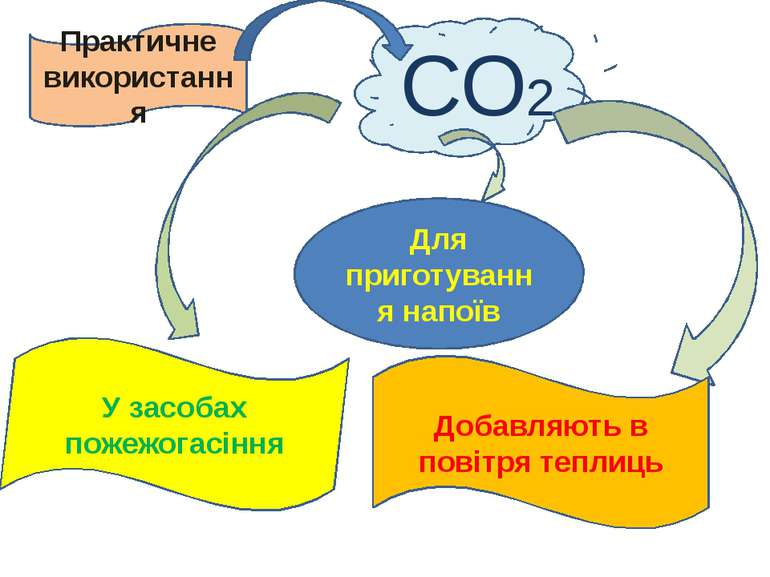
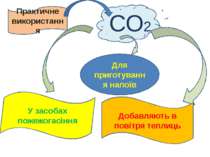
СО2 Практичне використання Добавляють в повітря теплиць У засобах пожежогасіння Для приготування напоїв
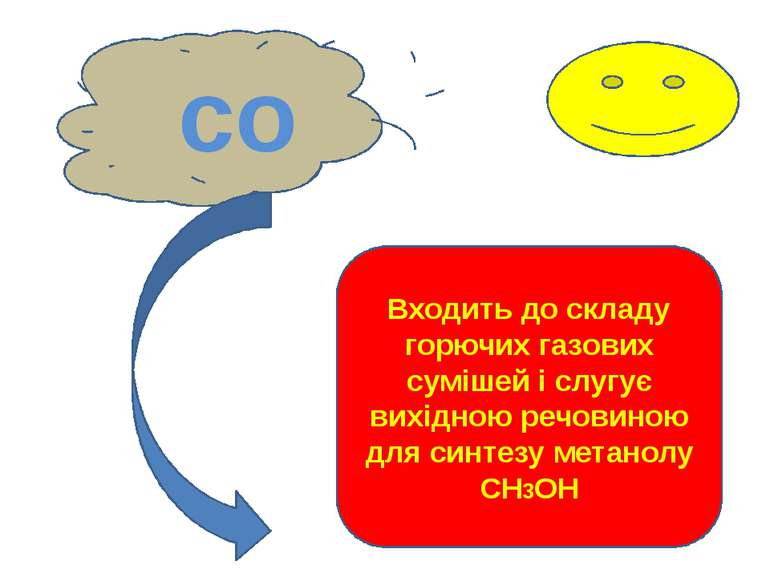
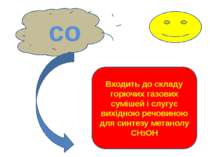
со Входить до складу горючих газових сумішей і слугує вихідною речовиною для синтезу метанолу СН3ОН
К в а р ц Кварц имеет формулу SiO2. Встречается в природе в виде песка. При накаливании смеси песка с углем получают карборунд, служащий для изготовления точильных камней. добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем)
Г р а н и т Гранит-самая распространенная горная порода. Состоит из кварца, полевого шпата и слюды. Содержит до 70% кремнезема. Гранит-прекрасный строительный материал.
Т а л ь к Тальк-3MgO*H2O*4SiO2-природный силикат магния. Применяется в бумажной, парфюмерной промышленности, в медицине.
А с б е с т Асбест-3MgO*2H2O*2SiO3-природный силикат магния отличается огнестойкостью. Применяется в качестве тепло- и электроизоляционного материала.
Содержание воды в природе Вода - это самый распространенный на Земле минерал. Запасы воды на Земле 1млн 454 тыс м3 из них менее 2% относится к пресным водам, а доступны для использования 0,3% Большая часть пресной воды недоступна человеку, т.к. содержится в ледниках Объем воды в Мировом океане составляет 1370 млн км3 На поверхности Земли 1,39 х 1018 т В атмосфере 1,3 х 1013т
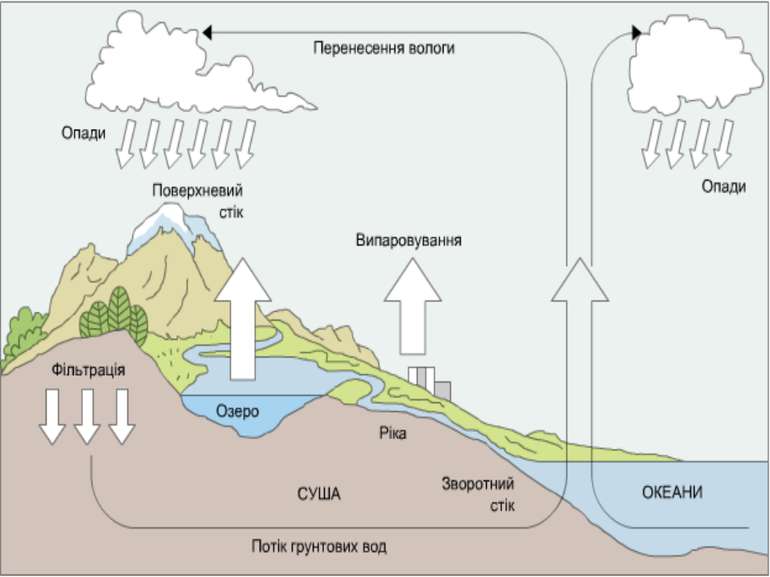
КОЛООБІГ ВОДИ Сонце розливає своє світло над Землею. Тепла його променів вистачає, щоб нагріти верхні шари води в річках, морях, океанах і перетворити їх на пару. У день разом з нагрітим повітрям пара легко здіймається в гору. Піднімаючись все вище вона охолоджується і стає краплинами води у вигляді хмаринки. Під впливом вітру хмаринки зливаються одна з одною. Краплинки в них з'єднуються, стають важкими і падають на Землю у вигляді опадів. Снігу, дощу, граду.
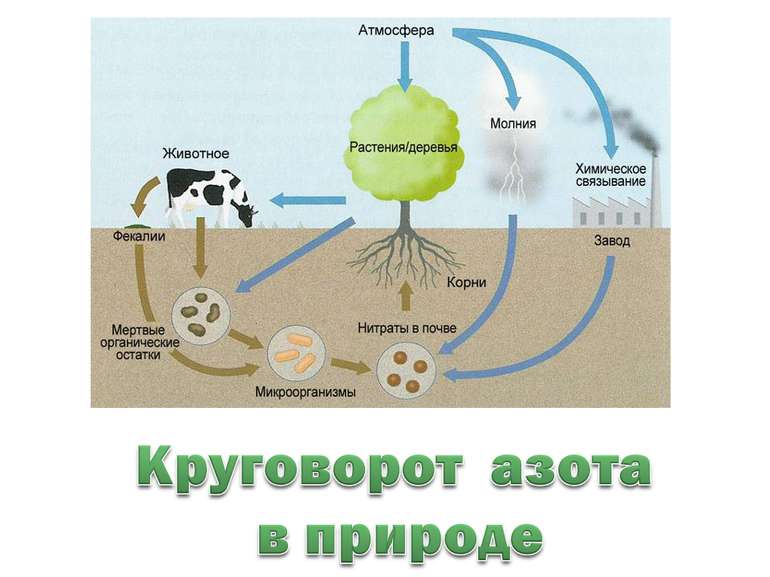
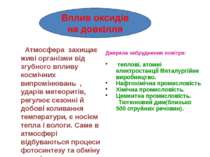
Атмосфера захищає живі організми від згубного впливу космічних випромінювань , ударів метеоритів, регулює сезонні й добові коливання температури, є носієм тепла і вологи. Саме в атмосфері відбуваються процеси фотосинтезу та обміну енергією. Джерела забруднення повітря: теплові, атомні електростанціЇ Металургійне виробництво. Нафтохімічна промисловість Хімічна промисловість. Цементна промисловість. Тютюновий дим(близько 500 отруйних речовин). Вплив оксидів на довкілля
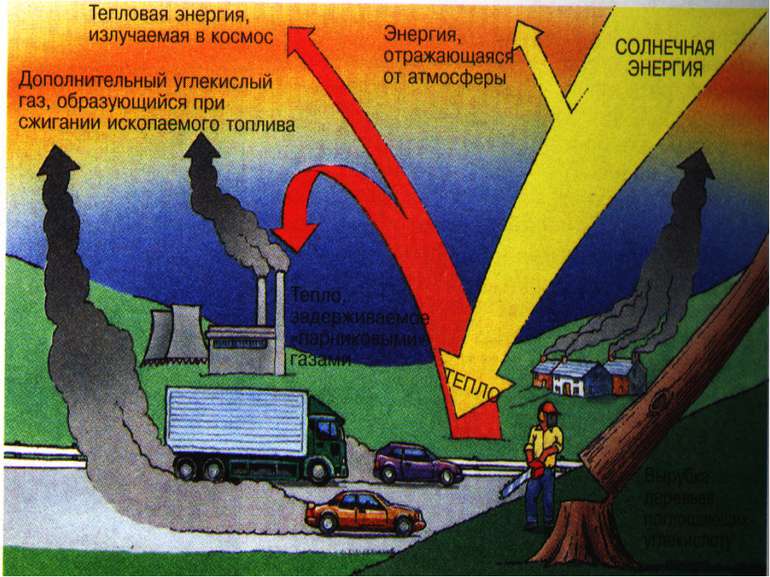
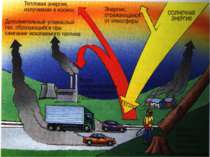
(щільний шар СО2 пропускає сонячну енергію до землі, але власна теплова енергія в космосі не розсіюється; тобто планета не охолоджується), головною загрозою якого є зростання середньої річної температури атмосфери на 1-2 градуси. Як результат – неприродна зміна клімату, глобальне потепління і танення льодовиків. У зв’язку з антропогенною діяльністю вміст СО2 в атмосфері значно перевищує допустимі норми. Це зумовлює виникнення „ парникового ефекту”
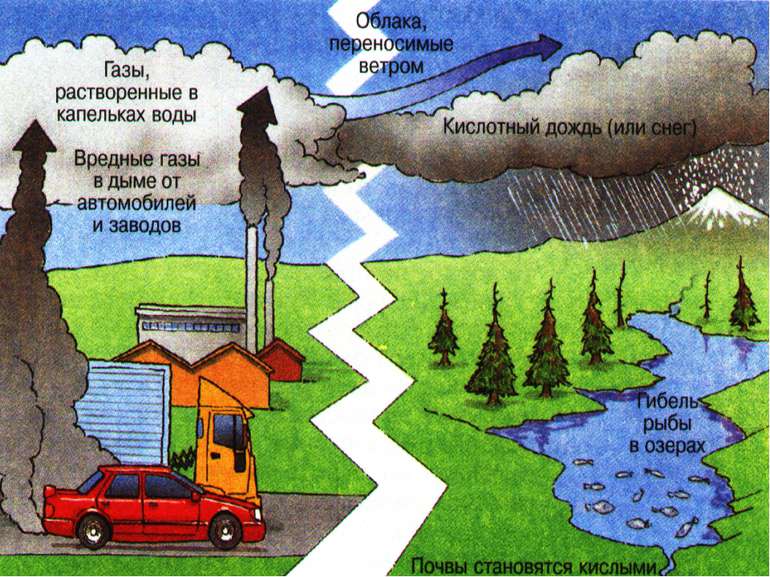
Кислотні дощі, атмосферні опади(в тому числі сніг), підкисленні (рН нижче 5,6) внаслідок підвищеного вмісту в повітрі промислових викидів, здебільшого SO2, NO2, HCI та ін. В результаті потрапляння кислотних опадів в поверхневі шари ґрунту та водоймищ, розвивається їх підкислення, це приводить до деградації екосистеми, гибелі тварин, зниження родючості ґрунтів, зниження приросту лісів та їх засихання. Кислотні дощі особливо характерні для країн Зах. та Півн. Європи, США, Канади, промислових районів Російської Федерації,України та ін.
До чого прагнемо? Шукати інші джерела енергії (енергія вітру, Сонця, рослин. З рапсу виготовляють олію, яку використовують як паливо, цукрову тростину використовують як паливо). На промислових підприємствах використовувати фільтри, пило – газовловлювачі. Сміття сортувати. Повторна переробка пластмаси на смолу. Скляну тару переплавляти повторно. Виховання екологічної культури людей. Посилення екологічного контролю за викидами в атмосферу. Зелені насадження. Пропозиції Чому це треба робити? Хто, коли і як буде це робити?
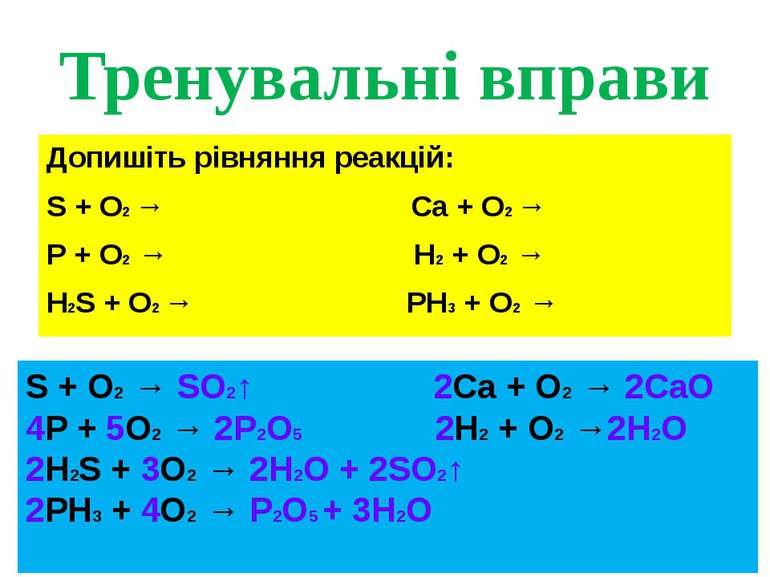
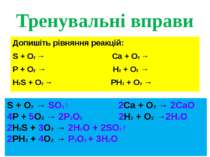
Тренувальні вправи Допишіть рівняння реакцій: S + O2 → Ca + O2 → P + O2 → H2 + O2 → H2S + O2 → PH3 + O2 → S + O2 → SO2↑ 2Ca + O2 → 2CaO 4P + 5O2 → 2P2O5 2H2 + O2 →2H2O 2H2S + 3O2 → 2H2O + 2SO2↑ 2PH3 + 4O2 → P2O5 + 3H2O
Схожі презентації
Категорії