Презентація на тему:
хлоридна кислота
Завантажити презентацію
хлоридна кислота
Завантажити презентаціюПрезентація по слайдам:
Не просто слухати, а чути. Не просто дивитися, а бачити. Не просто відповідати, а міркувати. Дружно і плідно працювати.
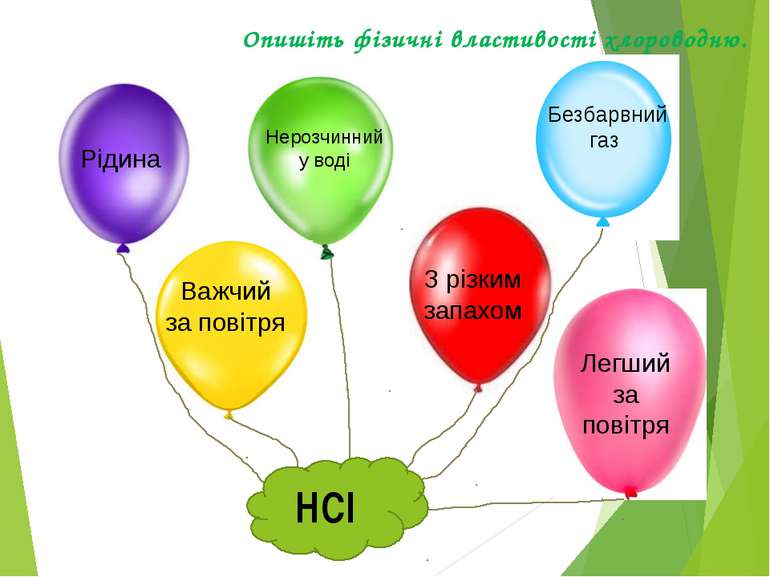
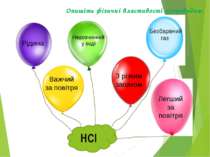
Опишіть фізичні властивості хлороводню. Безбарвний газ Рідина З різким запахом Нерозчинний у воді Важчий за повітря Легший за повітря НСl
Хлориди – солі хлоридної кислоти Купрум (ІІ) хлорид Ферум (ІІІ) хлорид Складіть формули запропонованих хлоридів Натрій хлорид
У пробірку налийте 1 мл розчину натрій хлориду, додайте 1—2 краплі розчину аргентум нітрату. Зверніть увагу на колір і характер осаду. Напишіть рівняння реакції у молекулярному та йонному вигляді. Висновок: реактивом на хлорид-йон є йон Ag+. Утворюється білий сирнистий осад AgCl, нерозчинний у сильних кислотах.
З якими речовинами буде реагувати хлоридна кислота? Сu, NO2, H2S, AgNO3, Na, Ca(OH)2, MgO, S, CaCO3
NaNO3 AgNO3 AgNO3 NaСl У двох пробірках без етикеток містяться NaNO3, NaCl. Як визначити, яка саме сіль в кожній з пробірок?
Схожі презентації
Категорії