Презентація на тему:
Хімічні властивості алкенів і алкінів
Завантажити презентацію
Хімічні властивості алкенів і алкінів
Завантажити презентаціюПрезентація по слайдам:
Самостійна робота Варіант І Напишіть рівняння реакцій, з допомогою яких можна здійснити такі перетворення: Обчисліть, який об’єм кисню (н. у.) знадобиться для спалювання 8,8 г пропану.
Варіант ІІ Напишіть рівняння реакцій, з допомогою яких можна здійснити такі перетворення: Обчисліть, який об’єм водню (н. у.) виділиться в результаті дегідрування 7,8 г бутану.
Запитання Наведіть загальні формули гомологічних рядів алканів, алкенів, алкінів. Назвіть види гібридизації в молекулах етану, етену, етину. Якими видами хімічного зв’язку утворені молекули етану, етену, етину? Порівняйте види ізомерії в алканів, алкенів, алкінів на прикладі бутану, бутену, бутину. Які вуглеводні (алкени, алкіни, алкани) частіше трапляються в природі? У вигляді яких сполук?
Одержання й горіння етилену та ацетилену Демонстрація 9. Одержання й горіння етилену 1) Одержання етилену дегідратацією етанолу в присутності концентрованої сульфатної кислоти: C2H5OH(H 2SO4(конц.)) t°→ C2H4 + H2O 2) Горіння етилену.
Демонстрація 10. Одержання й горіння ацетилену 1) Одержання ацетилену з кальцій карбіду: CaC2 + H2O → C2 H2 + Ca(OH)2 2) Горіння ацетилену.
Демонстрація 12. Реакції ненасичених вуглеводнів з розчинами кислот, лугів, калій перманганату 1) Взаємодія етилену з бромною водою й калій перманганатом. CH2 = CH2 + Br2 → CH2Br − CH2Br Висновок: ненасичені вуглеводні знебарвлюють розчини калій перманганату і бромну воду. ! Реакція з бромною водою (Br2) — якісна реакція на наявність кратного зв’язку!
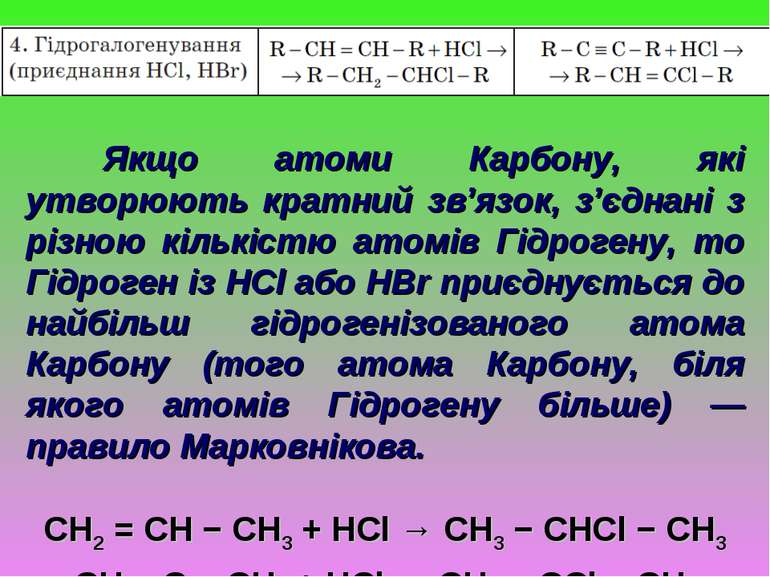
Якщо атоми Карбону, які утворюють кратний зв’язок, з’єднані з різною кількістю атомів Гідрогену, то Гідроген із НСl або НBr приєднується до найбільш гідрогенізованого атома Карбону (того атома Карбону, біля якого атомів Гідрогену більше) — правило Марковнікова. CH2 = CH − CH3 + HCl → CH3 − CHCl − CH3 CH ≡ C − CH3 + HCl → CH2 = CCl − CH3
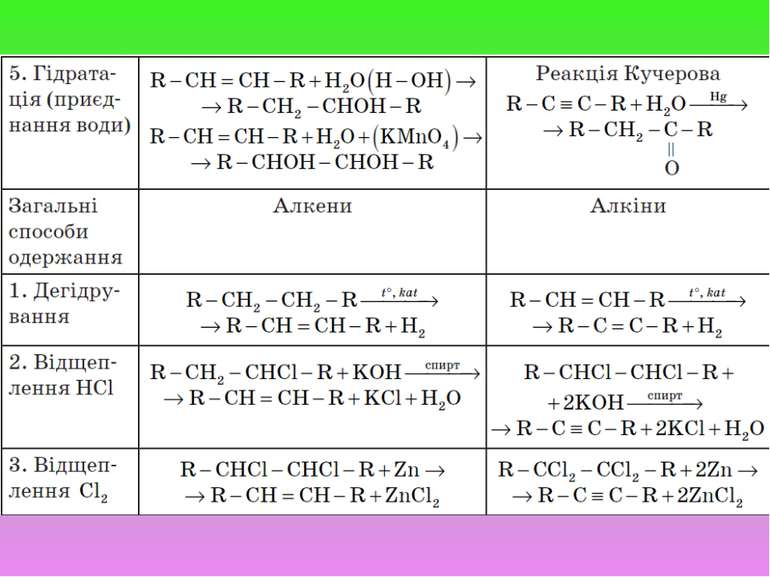
Додаткові способи одержання А. Алкенів 1. Гідрування алкінів: R − C = C −R + H2 t°, kat → R − CH = CH −R 2. Дегідратація спиртів (відщеплення води):
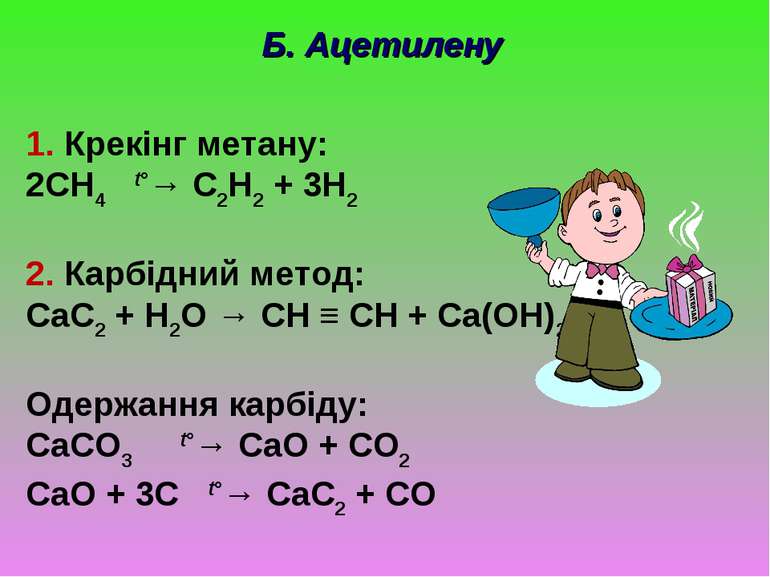
Б. Ацетилену 1. Крекінг метану: 2CH4 t°→ C2H2 + 3H2 2. Карбідний метод: CaC2 + H2O → CH ≡ CH + Ca(OH)2 Одержання карбіду: CaCO3 t°→ CaO + CO2 CaO + 3C t°→ CaC2 + CO
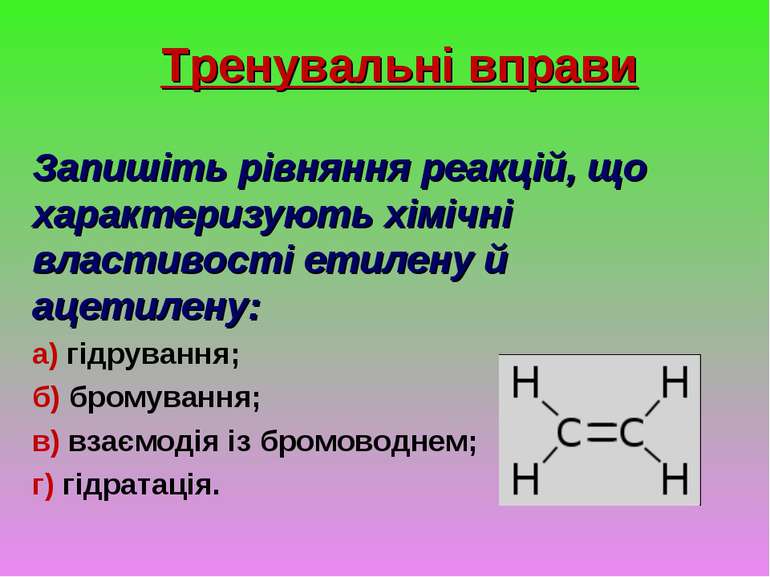
Тренувальні вправи Запишіть рівняння реакцій, що характеризують хімічні властивості етилену й ацетилену: а) гідрування; б) бромування; в) взаємодія із бромоводнем; г) гідратація.
Поясніть, яка властивість ацетилену використовується під час зварювання металів? У результаті згоряння вуглеводню масою 5,6 г утворилося 8,96 л карбон (IV) оксиду (н. у.) і 7,2 г води. Відносна густина цього вуглеводню за воднем дорівнює 14. Установіть формулу вуглеводню.
У результаті згоряння вуглеводню масою 6,5 г утворилося 11,2 л карбон (IV) оксиду (н. у.) і 4,5 г води. Відносна густина вуглеводню за воднем дорівнює 13. Установіть формулу вуглеводню.
Запитання 1) Назвіть загальні хімічні властивості вуглеводнів. 2) Назвіть відмітні хімічні властивості насичених і ненасичених вуглеводнів. 3) Який клас вуглеводнів найбільш хімічно активний? 4) Яку реакцію можна використати для визначення етану й етину? 5) Яка властивість ацетилену використовується під час зварювання металів?
Домашнє завдання Опрацювати матеріал параграфа, відповісти на питання до нього, виконати вправи. Творче завдання. Підготувати повідомлення про застосування вуглеводнів.
Схожі презентації
Категорії