Презентація на тему:
Буферні системи. Класифікація та механізм дії-1
Завантажити презентацію
Буферні системи. Класифікація та механізм дії-1
Завантажити презентаціюПрезентація по слайдам:
Буферні системи. Класифікація. Механізм дії. Буферні розчини. Їх значення у біології та медицині. Типи буферних систем. Буферна дія. Ацетатна, амонійна, гідрогенкарбонатна, карбонатна, фосфатна буферні системи. Вплив розведення на рН буферних систем. Буферна ємність. Буферні системи організму. Кислотно-основний стан крові.
Буферні розчини. Їх значення у біології та медицині. Часто під час експериментальних досліджень у хімії, біології, медицині, у промисловому виробництві виникає потреба забезпечити сталість рН середовища, оскільки внаслідок перебігу хімічних реакцій можуть утворюватись або витрачатись іони Гідрогену. Щоб процес відбувався за сталого значення рН, у розчин вводять буферні системи, які підтримують рН середовища практично незмінним. Фізіологічні рідини організму характеризуються сталим значенням рН. Це досягається як за допомогою фізіологічних ( за участю таких органів, як нирки, печінка, легені, кишки), так і фізико-хімімічних механізмів (завдяки дії буферних систем). Буферними системами називають розчини, які здатні зберігати постійну концентрацію іонів Гідрогену, тобто значення рН середовища, при добавлянні до них невеликих кількостей кислоти чи лугу або при розбавлянні їх.
Типи буферних систем До буферних систем належать суміші, що містять: Слабку кислоту і сіль цієї кислоти, утворену сильною основою, наприклад СН3СООН + СН3СООNa (ацетатний буфер); Слабку основу і сіль цієї основи, утворену сильною кислотою, наприклад NH4OH + NH4Cl (аміачний буфер); Солі багатоосновних кислот, наприклад NaH2PO4 + Na2HPO4 (фосфатний буфер); Na2CO3 + NaHCO3 (карбонатний буфер); Сильну або слабку кислоту (кислотний компонент) і гліцин або луг (основний компонент), наприклад HCl + NH2CH2COOH (діапазон рН 1,0-3,7), NH2CH2COOH + NAOH (діапазон рН 2,2 – 6,5).
Буферна дія Ацетатний буфер (діапазон рН 3,75 – 5,6) Наприклад концентрація кислоти та солі однакова. CH3COONa → CH3COO- + Na+ CH3COOH →CH3COO- + H+ Ka=[CH3COO-] [H+]/[CH3COOH] звідси [H+]=Ka[CH3COOH]/[CH3COO-], тобто [H+]=Ka Скислоти/Ссолі, тоді рН=рКа - lg Скислоти/Ссолі Приклад: обчислити концентрацію іонів Гідрогену і рН буферного розчину, враховуючи, що в ньому Скислоти = Ссолі = 0,1 моль/л, а Ка(СН3СООН)= 1,75*10-5 [H+] = 1,75*10-5 * 0,1/0,1= 1,75*10-5 моль/л рН = -lg[H+] = -lg1.75*10-5 = 4.75
Механізм буферної дії ацетатного буферного розчину на основі теорії електролітичної дисоціації. За рахунок часткової дисоціації кислоти та повної дисоціації солі в розчині будуть знаходитись одночасно іони СН3СОО-, Н+, Na+: CH3COONa → CH3COO- + Na+ CH3COOH →CH3COO- + H+ Якщо до нього добавити сильної кислоти, то іони Гідрогену реагуватимуть з аніонами солі, утворюючи слабку ацетатну кислоту: CH3COO- + H+ → CH3COOH (рКа = 4,75) Сильна кислота заміняється еквівалентною кількістю слабкої кислоти і рівновага зміщується вліво. При добавлянні лугу до буферного розчину гідроксид-іони взаємодіятимуть з іонами Н+ ацетатної кислоти з утворенням молекул води: CH3COOH + ОН- →CH3COO- + H2О
Вплив розведення на рН буферних систем. Буферні розчини часто доводиться розбавляти водою, особливо у біохімічних дослідженнях при вимірюванні рН малих об'ємів біорідин, зокрема крові. З рівняння [H+] =Ka*Скислоти/Ссолі =Ка*0,1/0,1 =Ка*0,01/0,01 видно, що при розбавлянні розчину концентрації обох компонентів зменшуються однаковою мірою, тому їх співвідношення залишається сталим. Проте незначні зміни рН середовища все-таки відбуваються, що пояснюють впливом розбавляння на ступінь дисоціації слабкої кислоти та на ступінь гідролізу. Отже здатність буферних розчинів зберігати сталим значення рН при розбавлянні або при додаванні кислот є обмеженим.
Буферна ємність. Кількісною мірою стійкості буферних систем підтримувати стале значення рН є величина буферна ємність. Буферною ємністю називають кількість моль-еквівалентів сильної кислоти, яку необхідно долити до одного дециметра кубічного буферного розчину, щоб змінити його рН на одиницю. В=C*V/∆pH*Vбуф, де В – буферна ємність, С – концентрація кислоти або основи, V – обєм даного електроліту, Vбуф – обєм буферного розчину, ∆pH – зміна рН. Буферна ємність залежить від: Концентрації компонентів Співвідношення компонентів Найбільшу буферну ємність мають розчини з однаковою концентрацією компонентів буферної суміші.
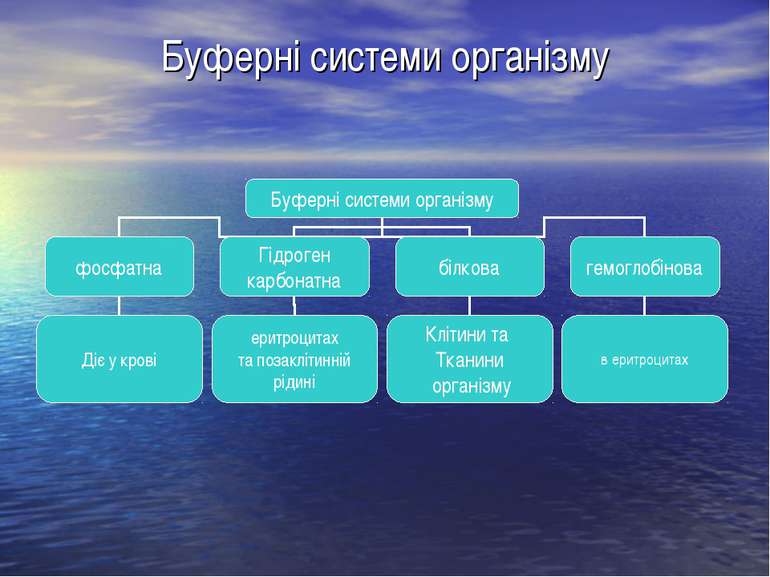
Буферні системи організму Організм людини володіє спеціальним механізмом координації фізіологічних та біохімічних процесів і може підтримувати на певному рівні вміст різних речовин, а саме: газів, води, електролітів, іонів металів і Гідрогену, біолігандів. Ця координація за пропозицією К.Кеннона була названа гомеостазом. Важливою складовою цього процесу є підтримання певного значення рН середовища біорідин, що досягається за допомогою фізіологічних та фізико-хімічних механізмів. Фізіологічні системи регулювання рН пов'язані з роботою легень, нирок, кишківника і розглядаються у курсі фізіології. Під фізико-хімічним механізмом треба розуміти дію буферних систем. Вони надають можливість організму, як відкритій термодинамічній системі реалізувати принцип Ле Шательє, тобто активно протидіяти впливу зовнішніх чинників, спрямованих на зміну кислотності його фізілогічних рідин – крові, жовчі, сечі, секретів внутрішніх залоз.
Кислотно-основний стан крові Невідємною складовою частиною гомеостазу внутрішнього середовища організму є кислотно-основний стан (КОС), що забезпечує оптимальні умови перебігу обмінних процесів і спрямований на підтримання сталої концентрації іонів Гідрогену. Він досягається як за допомогою фізіологічних механізмів регулювання у легенях, нирках, шлунково-кишковому тракті, так і за допомогою буферних систем організму. За нормальних умов рН крові коливається у межах 7,25 – 7,44. Слаболужне середовище є оптимальним для роботи численних ферментних систем, перебігу реакцій гідролізу. Продукти харчування, лікарські препарати, забруднене повітря потрапляючи у організм можуть порушити КОС крові. Зміщення КОС крові у напрямку підвищення концентрації іонів Гідрогену називається ацидозом, а в напрямку зниження їх концентрації – алкалозом.
Стосовно осаду AgCl правило добутку розчинності в ненасиченому розчині [Ag+][Cl–] ДРAgCl в насиченому розчині [Ag+][Cl-] = ДРAgCl в пересиченому розчині [Ag+][Cl-] ДРAgCl
2. Розрахунки розчинності та констант добутків розчинності в системі осад – розчин АmВn mА + nВ ДРС = [A]m [B]n [A] = m[AmBn] = m S [B] = n[AmBn] = nS ДРС = (mS)m(nS)n = mmnn Sm+n
При розрахунках розчинності слід пам’ятати іонну силу можна прийняти рівною нулю і протіканням конкуруючих реакцій знехтувати, то розчинність осаду розраховують по величині ДРТ впливом іонної сили знехтувати не можна, але конкуруючі реакції відсутні, то розчинність розраховують за величиною ДРС(Р) конкуруючими реакціями знехтувати не можна, тоді розчинність розраховують по величині ДРУ
3. Вплив хімічних чинників на розчинність важкорозчинних електролітів Хімічні чинники протолітичні реакції реакції комплексоутворення реакції окиснення-відновлення
4. Повнота осадження і фактори, які впливають на неї Осадження вважається практично повним, якщо концентрація осаджуваних іонів в розчині над осадом не перевищує 1,0 10-6 моль/л Повнота осадження електроліту підвищується при введені в розчин надлишку однойменних іонів Чим сильніший електроліт - осаджувач, тим повніше осадження Повнота осадження багатьох осадів залежить від рН розчину
5. Умови розчинення осадів Для розчинення осаду необхідно, щоб його іонний добуток став меншим константи добутку розчинності: [Kat+][An–] ДРKatAn
Зменшення концентрації іонів може бути здійснено наступними способами: 1. сильне розбавлення розчину Характеристика Об’єм розчинника на 1 г субстанції Дуже легко розчинна До 1 мл Легко розчинна > 1 до 10 мл Розчинна > 10 до 30 мл Помірно розчинна > 30 до 100 мл Мало розчинна > 100 до 1000 мл Дуже мало розчинна > 1000 до 10 000 Практично не розчинна > 10 000 мл
Зменшення концентрації іонів може бути здійснено наступними способами: 2. зв’язуванням іонів осаду в малодисоці-йовану сполуку, яка добре розчинна у воді Co(OH)Cl + HCl = CoCl2 + H2O 3. переведення іонів осаду в сполуку, яка розкладається з виділенням газів ZnS + 2HCl = ZnCl2 + H2S
Зменшення концентрації іонів може бути здійснено наступними способами: 3. зв’язуванням іонів осаду в комплекс AgCl + 2NH3 = [Ag(NH3)2]Cl 4. окисненням або відновленням іонів осаду в іншу сполуку MnO(OH)2 + H2C2O4 + H2SO4 = MnSO4 + 2CO2 + 3H2O
Розчинення важкорозчинних осадів сульфатів Содова витяжка – це переведення сульфатів ІІІ аналітичної групи у карбонати BaSO4 ДР=1,1 10-10 BaCO3 ДР=5,1 10-9
Схожі презентації
Категорії












![Стосовно осаду AgCl правило добутку розчинності в ненасиченому розчині [Ag+][... Стосовно осаду AgCl правило добутку розчинності в ненасиченому розчині [Ag+][...](https://svitppt.com.ua/images/24/23868/770/img12.jpg)





















![Стосовно осаду AgCl правило добутку розчинності в ненасиченому розчині [Ag+][... Стосовно осаду AgCl правило добутку розчинності в ненасиченому розчині [Ag+][...](https://svitppt.com.ua/images/24/23868/210/img12.jpg)
































