Презентація на тему:
"Історія вивчення атома"
Завантажити презентацію
"Історія вивчення атома"
Завантажити презентаціюПрезентація по слайдам:
Історія вивчення атома. Ядерна модель атома. Квантові постулати Бора. Випромінювання та поглинання Світла атомами
Будова атома Дж. Дж. Томсона Експеримент Резерфорда Планетарна модель Резерфорда Квантові постулати Бора Як розвивалось вчення про будову атома?
Слово «атом» з - грецької означає неподільний. Давньогрецькі вчені вважали атоми неподільними частинками, своєрідними цеглинками із яких побудовані всі тіла природи. Атом по теорії древніх вчених
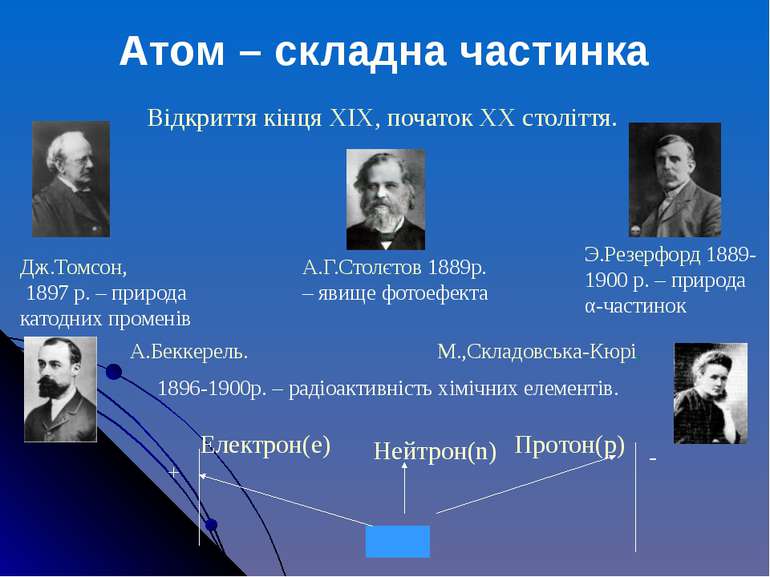
Відкриття кінця XIX, початок XX століття. Дж.Томсон, 1897 р. – природа катодних променів А.Г.Столєтов 1889р. – явище фотоефекта Э.Резерфорд 1889-1900 р. – природа α-частинок А.Беккерель. М.,Складовська-Кюрі, 1896-1900р. – радіоактивність хімічних елементів. Електрон(e) Нейтрон(n) Протон(p) - + Атом – складна частинка
Уявлення про неподільність атома стверджувалося у фізиці майже до кінця 19 століття. Подальший розвиток фізики в корені змінило це подання. Вивчення електромагнітних явищ в кінці 19 - початку 20 століття показало, що атоми речовини представляють складні світи: вони складаються з часток, які є носіями позитивної і негативної електрики. З атома речовини вдалося виділити спочатку найдрібніші (елементарні) негативно заряджені частинки - електрони. Потім були виявлено, що до складу атома входять елементарні позитивно заряджені частинки - протони. Перед вченими виникли найважливіші питання: Як побудований атом? Що являють собою окремі частини атома? Як вони взаємно розташовані?
Гіпотеза Дж.Томсона 1904 р. «Теорія пудинга» Планетарна модель атома Е.Резерфорда 1911р. Квантові постулати Н. Бора 1. Е=0 2. Е>0 е е е е е е е Теорії будови атома + е е е е е +
Англійський фізик, член Лондонської королівської общини. Його робото присвячені вивченню катодних і рентгенівських променів, атомній фізиці. В 1897 році, вивчаючи відхилення катодних променів в магнітному і електричному полях, відкрив електрон. В 1903 році запропонував одну із перших атомних моделей Дж.Дж. Томсон
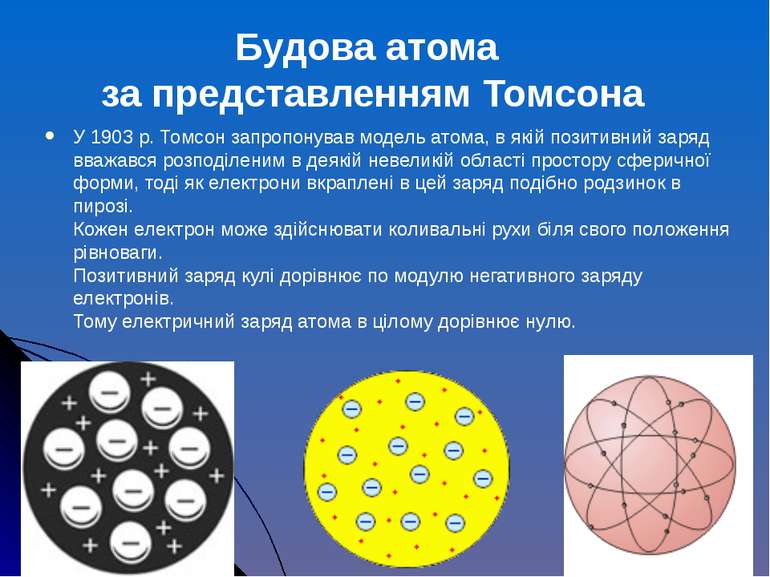
У 1903 р. Томсон запропонував модель атома, в якій позитивний заряд вважався розподіленим в деякій невеликій області простору сферичної форми, тоді як електрони вкраплені в цей заряд подібно родзинок в пирозі. Кожен електрон може здійснювати коливальні рухи біля свого положення рівноваги. Позитивний заряд кулі дорівнює по модулю негативного заряду електронів. Тому електричний заряд атома в цілому дорівнює нулю. Будова атома за представленням Томсона
Модель будови атома, запропонована Томсоном, потребувала експериментальної перевірки так як явища радіоактивності, фотоефекту не можна було пояснити, застосувавши модель атома Томсона. Важливо було перевірити, чи дійсно позитивний заряд розподілений по всьому обсязі атома з постійною щільністю. Тому в 1911 році Ернест Резерфорд провів ряд дослідів по дослідженню складу і будові атомів Чому модель Томсона потребувала перевірки?
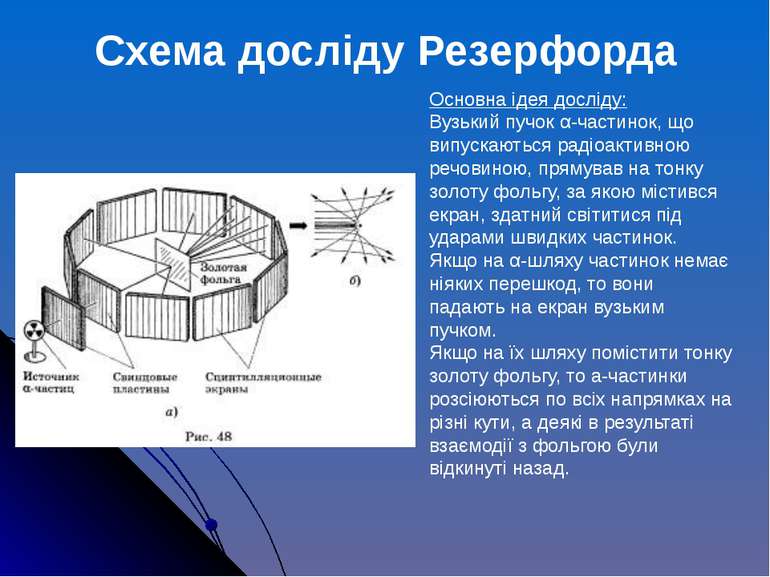
Основна ідея досліду: Вузький пучок α-частинок, що випускаються радіоактивною речовиною, прямував на тонку золоту фольгу, за якою містився екран, здатний світитися під ударами швидких частинок. Якщо на α-шляху частинок немає ніяких перешкод, то вони падають на екран вузьким пучком. Якщо на їх шляху помістити тонку золоту фольгу, то а-частинки розсіюються по всіх напрямках на різні кути, а деякі в результаті взаємодії з фольгою були відкинуті назад. Схема досліду Резерфорда
Напруженість (E) створюваного ядром електричного поля, а значить, і сила дії на α-частинку досить швидко убуває із збільшенням відстані від ядра. Тому напрямок польоту частинки сильно змінюється, якщо вона проходить дуже близько до ядра. Оскільки діаметр ядра значно менше діаметра атома, то більша частина з числа всіх α-частинок проходить крізь атом на таких відстанях від ядра де сила відштовхування створюваного ним поля занадто мала, щоб істотно змінити напрямок руху α-частинок. І лише деякі частинки пролітають поруч з ядром, тобто в області сильного поля, і відхиляються на великі кути. Чим же пояснити Розсіювання а-частинок при проходженні ними речовини?
Планетарна модель атома, запропонована Резерфордом, - це спроба застосування класичних уявлень про рух тіл до явищ атомних масштабів. Ця спроба виявилася неспроможною. Класичний атом нестійкий. Електрони, що рухаються по орбіті з прискоренням, повинні неминуче впасти на ядро, розтративши всю енергію на випромінювання електромагнітних хвиль. Вперше прозвучало, те що закони класичної механіки не можуть пояснити явища, що відбуваються на атомному рівні. Модель Резерфорда
Проаналізувавши результати дослідів, Резерфорд в 1911 році запропонував наступну модель атома: Атом складається з позитивно зарядженого ядра, яке займає мізерно малий обсяг атома. Навколо ядра розташовані електрони. Електрони обертаються навколо ядра на досить великих відстанях від нього. Сукупність цих електронів називають електронною оболонкою. Таким чином, Атом представляється у вигляді планетної системи в маленькому масштабі (тому таку модель назвали планетарною) Як же побудований атом?
У 1913 році датський фізик Нільс Бор розвинув теорію квантових уявлень про процеси в природі. Він сформулював у вигляді постулатів основні положення нової теорії, які накладали певні обмеження на допустимий класичною фізикою рух. Нільс Бор застосував свої постулати для найпростішої атомної системи - атома водню. Як Нільс Бор допоміг Резерфорду?
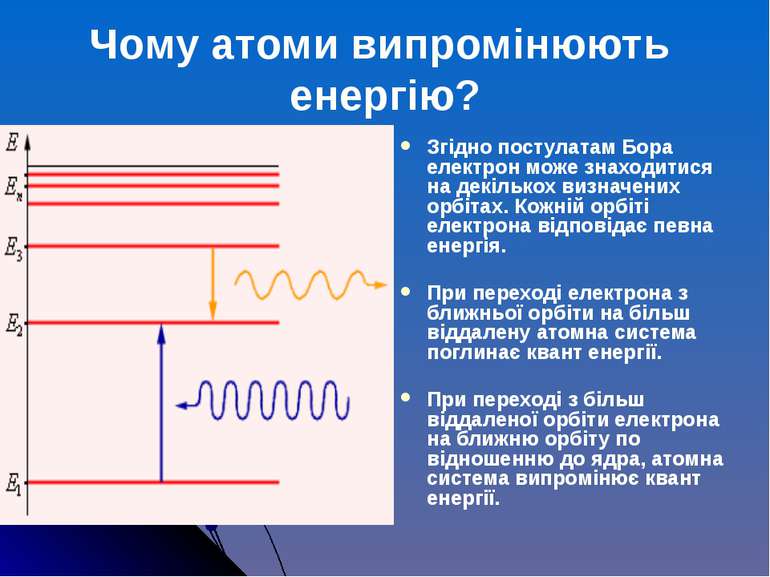
Згідно постулатам Бора електрон може знаходитися на декількох визначених орбітах. Кожній орбіті електрона відповідає певна енергія. При переході електрона з ближньої орбіти на більш віддалену атомна система поглинає квант енергії. При переході з більш віддаленої орбіти електрона на ближню орбіту по відношенню до ядра, атомна система випромінює квант енергії. Чому атоми випромінюють енергію?
Обраний Нільсом Бором шлях привів до створення чіткої теорії руху мікрочастинок – квантової механіки. На порозі квантової механіки
Схожі презентації
Категорії