Презентація на тему:
Роль кінази фокальної адгезії у інтегрин-опосередкованій сигналізації
Завантажити презентацію
Роль кінази фокальної адгезії у інтегрин-опосередкованій сигналізації
Завантажити презентаціюПрезентація по слайдам:
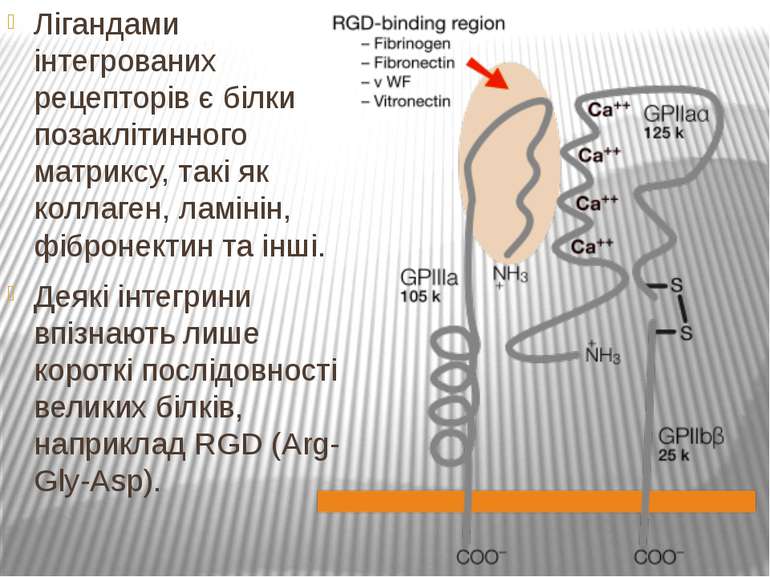
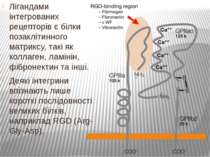
Найбільш відомими рецепторами клітинної адгезії є інтегрини, представники великої родини гетеродимерних трансмембранних білків, α- і β-субодиниці яких у різних поєднаннях формують більше 20 рецепторів до різних білків позаклітинного матриксу. У людини описано 18 α- і 8 β-субодиниць, що можуть утворювати 24 варіанти димерів.
Лігандами інтегрованих рецепторів є білки позаклітинного матриксу, такі як коллаген, ламінін, фібронектин та інші. Деякі інтегрини впізнають лише короткі послідовності великих білків, наприклад RGD (Arg-Gly-Asp).
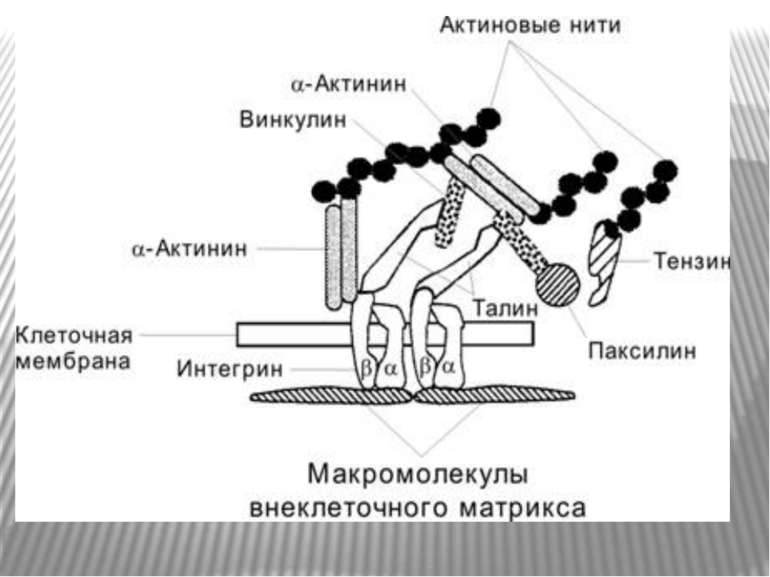
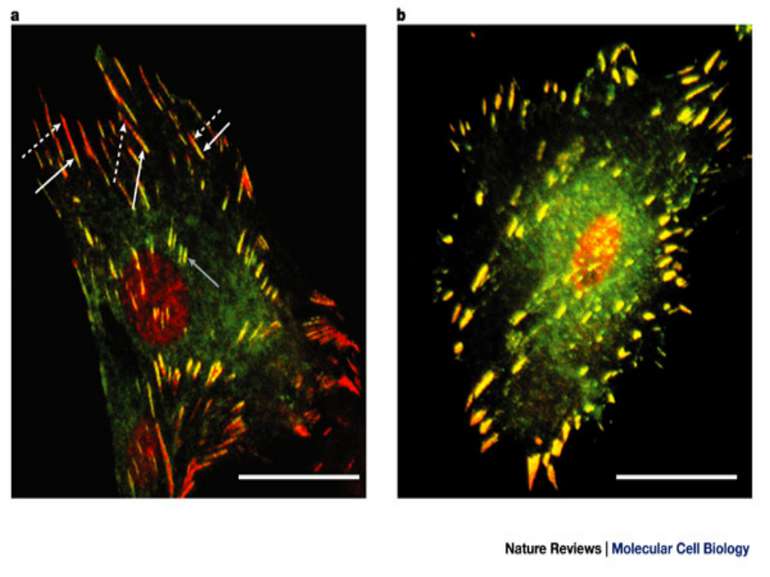
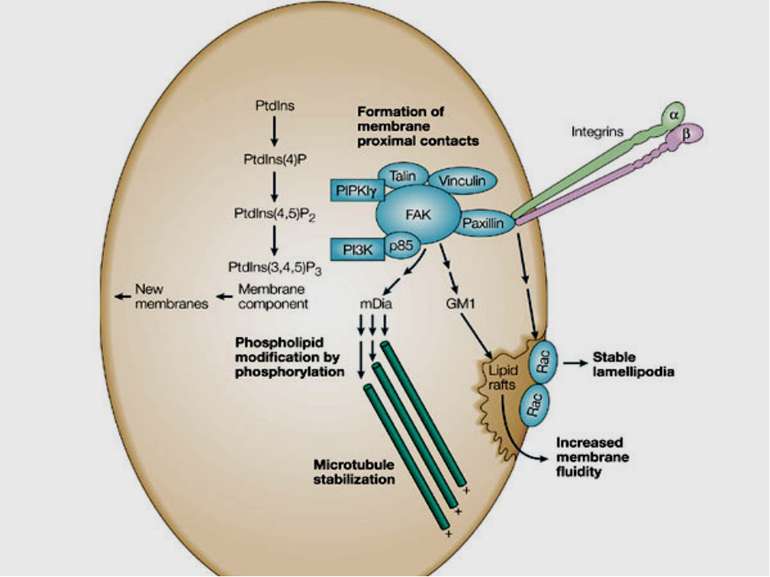
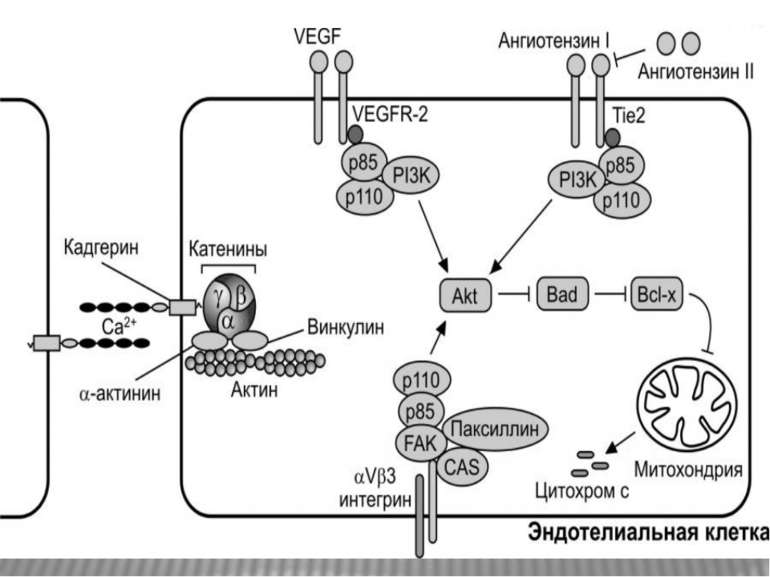
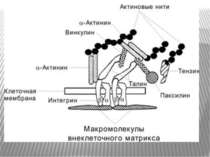
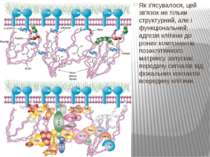
Міцне прикріплення клітин до позаклітинної матриксу здійснюється в невеликих дискретних ділянках клітинної поверхні - фокальних контактах. Внутрішньоклітинний домен інтегринових рецепторів через ланцюг різних пов'язаних між собою цитоплазматичних білків (таліна, альфа-актініна, вінкуліна та ін) зв'язується з актиновими мікрофіламентами цитоскелету. Таким чином здійснюється структурний зв'язок між позаклітинним матриксом і цитоскелетом прикріпленої клітини.
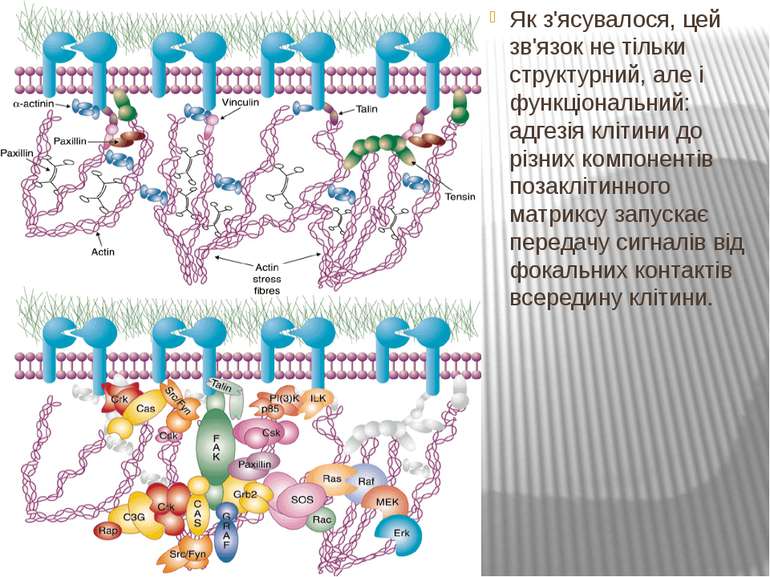
Як з'ясувалося, цей зв'язок не тільки структурний, але і функціональний: адгезія клітини до різних компонентів позаклітинного матриксу запускає передачу сигналів від фокальних контактів всередину клітини.
Структура FAK є унікальною серед родин тирозинових протеїнкіназ. Її можна розділити на три домени (N-термінальний, кіназний і С-кінцевий), кожен домен складається приблизно з 400 амінокислот. Кіназний домен FAK оточений великими некаталітичними N-і С-кінцевими доменами, які не мають значної гомології з іншими білками, за винятком тирозинкінази Pyk2/CAKβ/RAFTK. Порівняння амінокислотних послідовностей з кДНК що кодують FAK, від птахів, мишей та людини показує надзвичайно високий ступінь ідентичності (близько 90%), припускаючи, що клітинні функції FAK висококонсервативні.
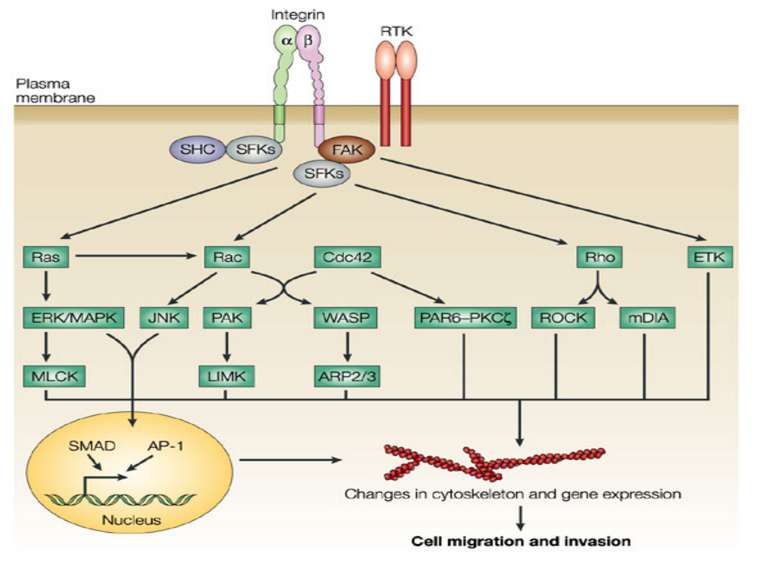
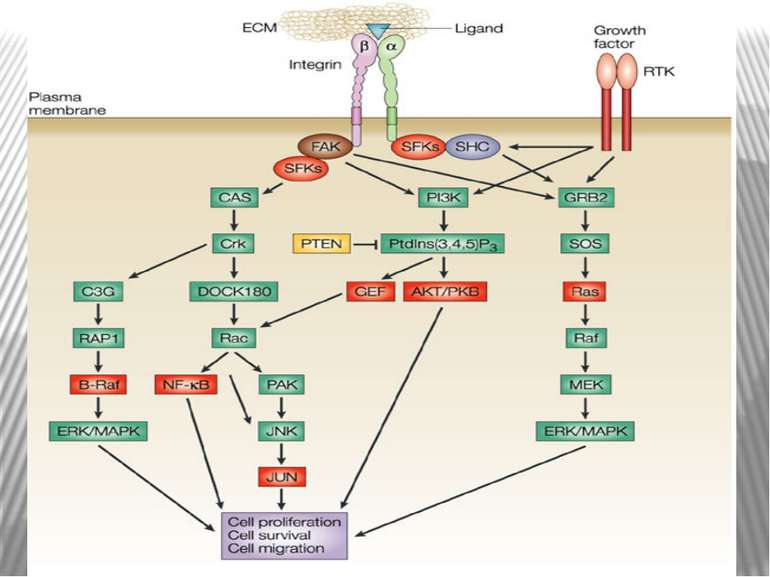
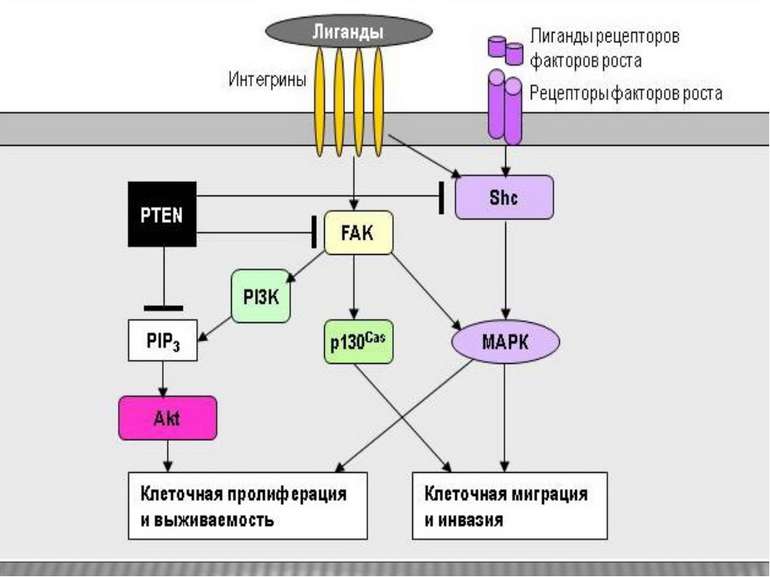
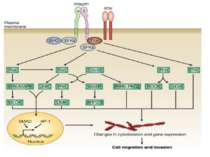
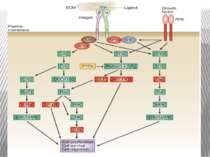
Інтегриновий рецептор, зв'язавшись зі своїм лігандом, зазнає конформаційних змін та індукує в цитоплазмі підвищення рівня Са2+ і рН, а також фосфорилювання по тирозину ряду білків, пов'язаних з фокальним контактом. Серед цих білків ключовими учасниками передачі сигналів є тирозинова протеїнкіназа фокальних контактів - FAK (pp125FAK), безпосередньо пов'язана з цитоплазматичним доменом бета-субодиниці інтегринів, а також білки фокальних контактів - паксилін (пов'язаний з FAK і з вінкуліном) і тензин (пов'язаний з вінкуліном і з актиновими мікрофіламентами). Фосфорилювання по тирозину цих білків робить їх здатними активувати і залучати до послідовної передачі сигналів інші молекули: субмембранні тирозинкінази сімейства SRC, ГТФ-зв'язуючі білки (G-білки), цитоплазматичні протеїнкінази і на кінцевому етапі-транскрипційні фактори клітинного ядра, результатом чого є модифікація експресії специфічних генів, що виявляється в ростових, морфогенетичних і локомоторних реакціях прикріпленої клітини.
Взаємодія між Src і FAK досить складна. FAK аутофосфорилюється під дією інтегринів, в результаті чого тирозин в положенні 397 стає доступний для SН2-домену Src. Відповідно стимулюється кіназна активність Src і відбувається зворотнє фосфорилювання FAK по чотирьом тирозиновим залишкам, що призводить до індукції її повноцінної активності. Інші потенційні субстрати Src в зоні фокальних контактів можуть бути також і субстратами для FAK. Це питання залишається відкритим, оскільки дискримінувати субстратнуспецифічність двох кіназ, що знаходяться в комплексі, важко. Наприклад, паксилін, асоціюючись з С-кінцевим фрагментом FAK, може взаємодіяти з Src за рахунок SH3-домену. Є докази, що FAK не єдиний фермент, здатний фосфорилювати паксилін, вінкулін, таллін і тензин, так як було продемонстровано, що в дефектних за FAK клітинах мишей зазначені білки залишаються в фосфорильованому стані.
При зв'язуванні з позаклітинним матриксом менша (β) субодиниця інтегринів активує нерецепторну тирозинкіназу FAK . Активована FAK, в свою чергу, через послідовність адапторних сигнальних білків (Grb2, Src, Shc) активує МАР-кіназний проліферативний каскад . Крім цього, FAK може прямо або опосередковано фосфорилювати свої власні мішені, зокрема білок р130Cas Таким чином, інтегрин-індуковані FAK-опосередковані сигнальні шляхи приводять не тільки до посилення клітинної проліферації, але і до підвищення міграційної та інвазивної клітинної активності.
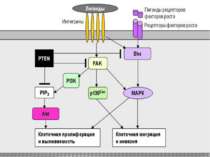
Активація FAK в процесі адгезії з субстратом призводить до фосфорилювання по тирозину паксиліну, тензину і Р130cas. Далі сигнал передається через адапторні білки і фактори обміну нуклеотидів на Ras, і далі через МАР кіназний каскад в ядро. У деяких трансформованих клітинах FAK конститутивно активована, що, мабуть, забезпечує незалежний від субстрату ріст цих клітин. Крім центральної ролі в інтегриновій сигналізації, FAK також є супресором апоптозу в епітеліальних клітинах. Цікаво, що в цьому процесі не бере участь класичний каскад МАР кіназ . Була виділена нова серин / треонінова кіназа IGL ( integrin-linked kinase ), яка, можливо і здійснює цю функцію.
Схожі презентації
Категорії