Презентація на тему:
Ферум та його сполуки
Завантажити презентацію
Ферум та його сполуки
Завантажити презентаціюПрезентація по слайдам:
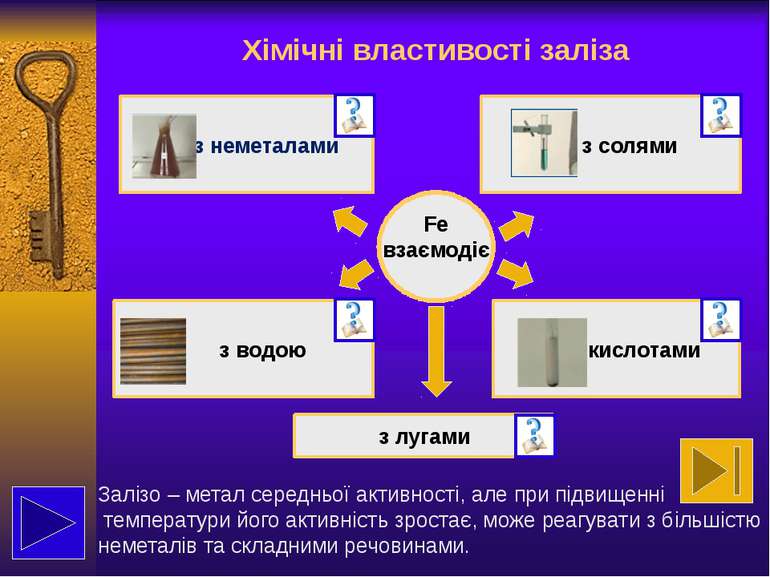
властивості Феруму як представника елементів побічних підгруп та сполук, утворених ним характеризувати Ферум за положенням в періодичній системі та будовою його атома; прогнозувати хімічні властивості заліза та його сполук, описувати їх хімічними рівняннями; пояснювати застосування заліза та його сполук на основі їх властивостей. Що необхідно знати: Що необхідно вміти: Виконай завдання позначені символом
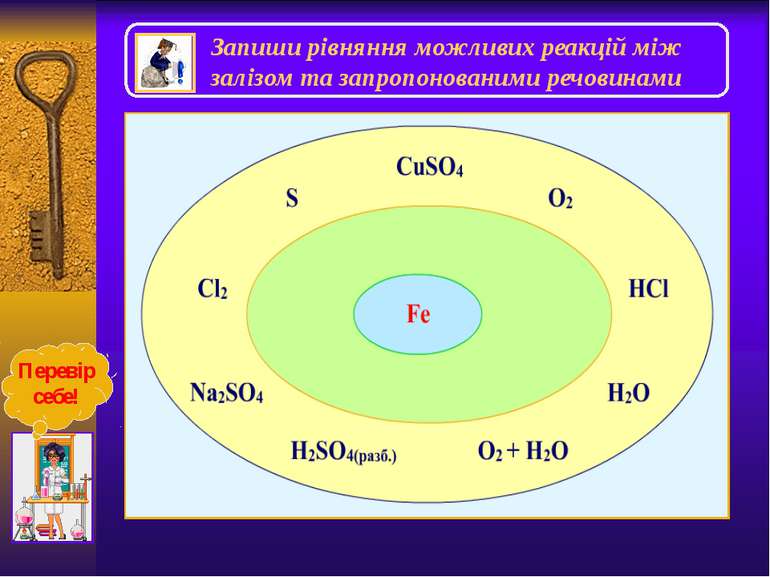
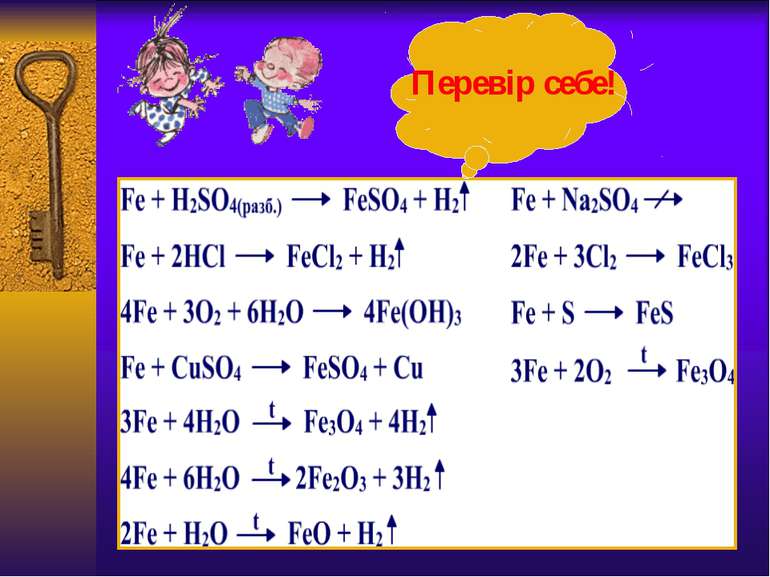
Взаємодія з водою Чисте залізо стійке до дії води. Домішки підвищують його хімічну активність, і вода в присутності кисню взаємодіє з залізом з утворенням жовто-бурої плівки з гідроксиду феруму (ІІІ), яка не захищає метал від подальшого руйнування: 4Fe+6H2O+3О2= 4Fe(OН)3 Цей процес називається корозією. Деякі види метеоритного заліза не піддаються корозії. Розжарене залізо реагує з водяною парою з виділенням водню – це залізопаровий спосіб добування водню: 3Fe+4H2O= Fe3O4+4H2↑ Лавуазьє використовував цю реакцію для добування водню: “Дослід Лавуазьє”
Символом Всесвітньої промислової виставки 1958 року став незвичайний павільйон під назвою Атоміум. Це куб, в кутах якого містяться вісім куль, а дев’ятий – в центрі. Це комірка кристалічної ґратки заліза, збільшена в 165 млрд. разів. Павільон такої форми вказує на важливість заліза в кінці другого тисячоліття, але воно збереже своє значення і в третьому. На яких властивостях ґрунтується широке використання заліза?
Будова атома на основі положення в періодичній системі та можливі ступені окиснення 1. Опиши положення Ферума в періодичній системі хімічних елементів. 2. В чому особливості будови електронної оболонки атома Феруму? 3. Які ступені окиснення він може проявляти? 4. Який ступінь окиснення найбільш стійкий? Чому?
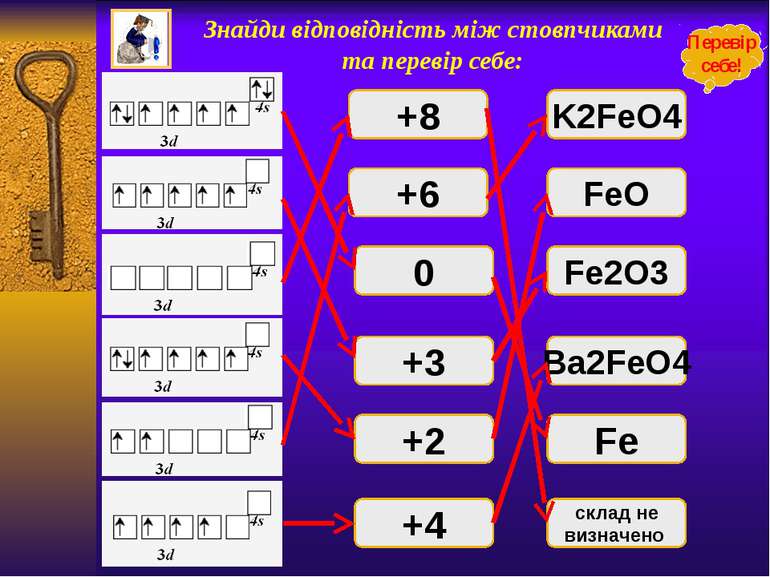
Знайди відповідність між стовпчиками та перевір себе: +8 +6 0 +3 +2 +4 FeO K2FeO4 склад не визначено Fe Ba2FeO4 Fe2O3 Перевір себе!
Поширення в природі Після Алюмінію Ферум – найпоширеніший метал на земній кулі, він трапляється у вигляді сполук, а у вільному стані – у метеоритах. За твердженням вчених, ядро Землі переважно складається із заліза. Знайди відповідність даних у таблиці та перевір себе Перевір себе! мінерал хімічнаформула 1.червоний залізняк (гематит) А.Fe2O3 2.магнітнийзалізняк (магнетит) Б.Fe2O3•H2O 3.бурийзалізняк (лимоніт) С.FeS2 4.залізний колчедан (пірит) Д.Fe3O4
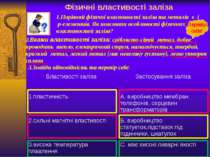
Фізичні властивості заліза 1.Порівняй фізичні властивості заліза та металів s- і p-елементів. Як пояснити особливості фізичних властивостей заліза? 3.Знайди відповідність та перевір себе: 2.Вкажи властивості заліза: сріблясто-сірий метал, добре проводить тепло, електричний струм, намагнічується, твердий, крихкий метал, легкий метал (має невелику густину), легко утворює сплави Перевір себе! Властивості заліза Застосуваннязаліза 1.пластичність А. виробництво мембран телефонів, серцевин трансформаторів 2.сильні магнітні властивості Б. виробництво статуеток,підставок під годинники, шкатулок 3.висока температура плавлення С. має високі ливарні якості
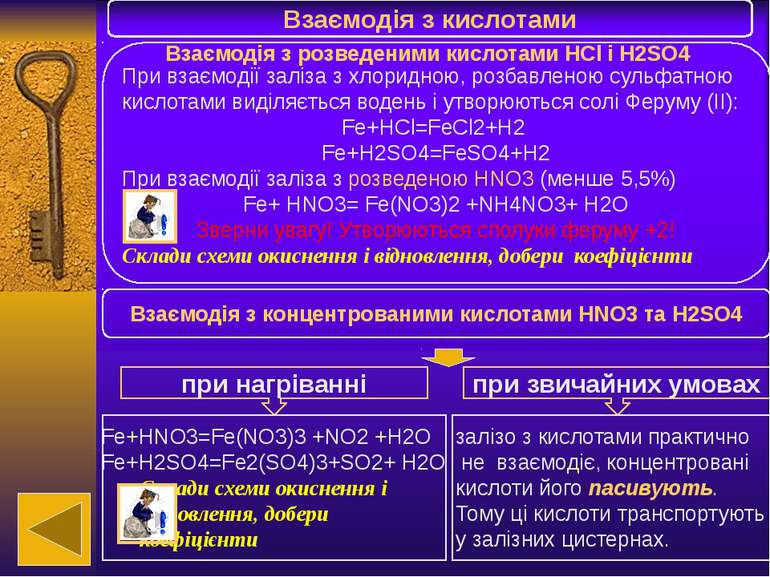
Залізо в подрібненому вигляді може розчинятися у концентрованих гарячих розчинах лугів з утворенням комплексних солей феруму (ІІ): Fe+2NaOH+2H2O = Na2[Fe(OH)4]+H2 Запиши йонно - молекулярне рівняння та назви утворену комплексну сполуку. Взаємодія з лугами Перевір себе!
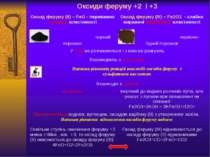
Оксиди феруму +2 і +3 Оксидферуму(ІІ)–FeO-переважноосновнівластивості Оксидферуму(ІІІ)– Fe2O3-слабко вираженіамфотернівластивості чорний порошок червоно-бурий порошок Уводіне розчиняються і з нею не реагують Взаємодіють зкислотами Напиши рівняння реакцій взаємодії оксидівферумуз сульфатною кислотою Взаємодія злугами не реагує Інертний до водних розчинів лугів, але реагує з лугами при сплавлянні чи спіканні: Fe2O3+2KOH→2KFeO2+H2O↑ Відновлюютьсяводнем, вуглецем, оксидом карбону (ІІ) з утворенням заліза.Напиши рівняння відновлення оксидівферумуводнем Оскільки ступінь окисненняферуму+2 менш стійка , ніж +3, то оксидферуму(ІІ)окиснюєтьсядо оксидуферуму(ІІІ) 4FeO+O2=2Fe2O3 Оксидферуму(ІІІ)відновлюється до оксидуферуму(ІІ) відновниками Fe2O3+СО=2FeO+СО2
Гідроксиди феруму +2 і +3 Гідроксидферуму(ІІ)– Fe(OН)2-має переважноосновнівластивості Гідроксидферуму(ІІІ)– Fe(OН)3-маєслабко вираженіамфотернівластивості Тверда речовинабілого кольору Тверда речовина бурого кольору Уводіне розчиняються Взаємодіють зкислотами Напиши рівняння реакцій взаємодії гідроксидівферумуз нітратноюкислотою Взаємодія злугами не реагує Повільнорозчиняється в гарячому розчині лугу Fe(ОН)3+3NaOH=Na3[Fe(OH)6] Розкладаються при нагріванні з утворенням води і відповідних оксидів Напиши рівняння реакцій розкладу гідроксидівферуму Гідроксидферуму(ІІ), подібно до оксиду легкоокиснюється, перетворюючись в сполуку з більш стійким ступенем окиснення Fe(ОН)2+O2+H2O=Fe(ОН)3 Склади схему електронного балансу і розстав коефіцієнти в рівнянні реакції. Добувають гідроксидиферумувзаємодією відповідних солейферумуз лугами Напиши рівняння реакцій добуваннягідроксидівферуму
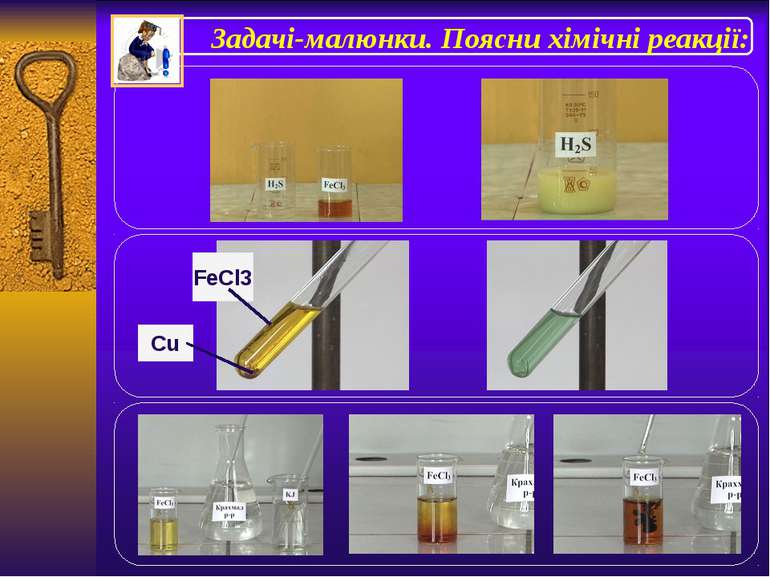
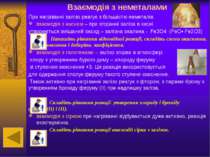
Солі феруму +2 і +3 Із солейферуму(ІІ) найбільше значення мають соліFeS. FeCl2. FeSO4.які є нестійкими та легкоокиснюютьсядо сполукферуму(ІІІ),виявляючивідновні властивості.Можутьокиснюватиськиснем, тому зберігають в склянках з притертими пробками. Хлоридферуму(ІІ) можнаокиснитихлором . 2FeCl2+Cl2=2FeCl3 10FeSO4+2KMnO4+8H2SO4= 5Fe2(SO4)3+K2SO4+2MnSO4+8H2O FeSO4•H2O– залізний купорос Найбільше значення має хлоридферуму(ІІІ), який легко гідролізується. Також соліферуму(ІІІ) виявляють достатньо сильніокисні властивості: 2FeCl3+H2S=2FeCl2+S+2HCl 2FeCl3+KI=I2+2FeCl2+2KCl 2FeCl3+Cu=CuCl2+2FeCl2 Знайди в додаткових джерелах інформаціюпро застосування солейферуму.
Якісні реакції на сполуки феруму +2 і +3 Сполукиферуму+2 Сполукиферуму+3 Реактивом найониферуму+2 єгексаціаноферат(ІІІ)калію (червона кров'яна сіль). Під час взаємодії солейферуму(ІІ) згексаціаномфератом(ІІІ) калію утворюється осад синього кольору –турнбулевасинь. 3FeSO4+ 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓+3K2SO4 Реактивом найониферуму+3єгексаціаноферат(ІІ)калію (жовта кров'яна сіль)татіоціанат(роданід) каліюKSCN. Під час взаємодії солейферуму(ІІІ) згексаціаномфератом(ІІ) калію також утворюється осад синього кольору – берлінська лазур. 4FeCl3+ 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓+12KCl Під час взаємодії солейферуму(ІІІ) зтіоціанатом (роданідом) каліюKSCNутворюється сполука темно-червоного кольорутіоціанатферуму(ІІІ) FeCl3+3KSCN= Fe(SCN)3+3KCl Напиши повні та скороченійоннірівняння реакцій
1.Досліди вплив середовища на корозію заліза. В три посудини налий розчини оцту, кальцинованої соди та кухонної солі, опусти в кожну по залізному цвяху (попередньо промитого милом та зачищеного шкіркою). Для контролю один цвях опусти у чисту прокип'ячену воду. Чому саме прокип'ячену? Кожного дня спостерігай за змінами – перебігом корозії. Визнач, в якому розчині корозія відбувається найбільш інтенсивно. Яке середовище у цьому розчині – кисле, лужне чи нейтральне (врахуй гідроліз)? 2.Проведи реакцію окиснення заліза йодом. Залізну деталь зачисти шкіркою до блиску. Візьми настоянку йоду і піпеткою нанеси краплі йоду на поверхню металу. Спостерігай, що відбувається. Поясни спостережувані явища. Домашній експеримент
Схожі презентації
Категорії