Презентація на тему:
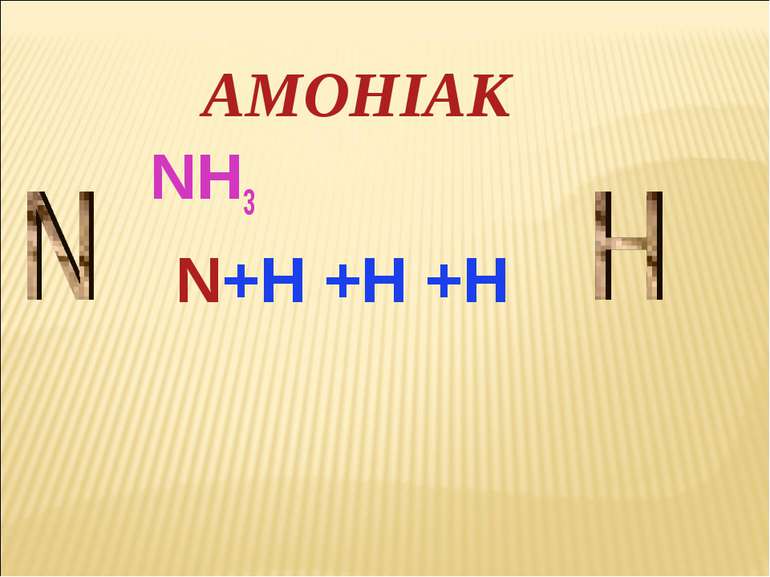
Амоніак
Завантажити презентацію
Амоніак
Завантажити презентаціюПрезентація по слайдам:
МЕТА: ознайомитися зі складом, особливостями будови молекули й властивостями амоніаку; розчинністю амоніаку у воді; особливостями взаємодії амоніаку з водою й кислотами; розвивати вміння складати молекулярні рівняння реакцій на прикладі властивостей амоніаку. ТЕМА АМОНІАК
Визначте хімічний елемент за підказками 1.Цей елемент основний компонент суміші газів земної атмосфери. ( 5б.) 2.Цей елемент входить до складу добрив( 4б.) 3.Цей елемент - газ, але зустрічається й у рідкому стані. У цьому стані його використовують у холодильних установах(3б) 4.Цей елемент використовується для виробництва азотних добрив, нітратної кислоти(2б.) 5.Цей елемент знаходиться у 2 періоді , в п’ятій групі. (1б.)
Визначте хімічний елемент за підказками 1.Доля цього елемента в повітрі дуже мала, але він є основним компонентом суміші газів атмосфери Сонця і зірок. ( 5б.) 2.Добування цього елемента в усіх випадках – це відновлення із +1 до 0. ( 4б.) 3. Легший за повітря. (3б) 4. В усіх природних сполуках має ступінь окислення +1.(2б.) 5. Переважна кількість цього існує у вигляді Н2О.(1б.)
Тематичні питання 1. Будова молекули 2. Фізичні властивості 3. Хімічні властивості 4. Добування 5. Застосування
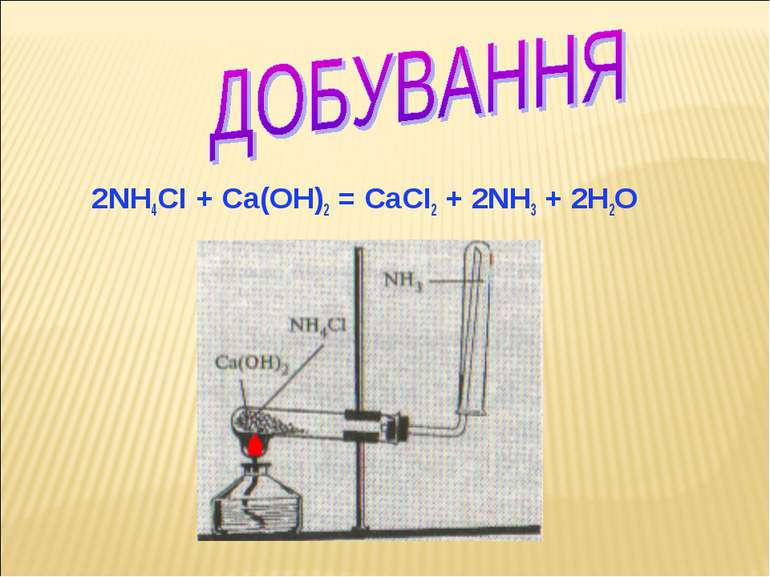
На початку ХХ ст. німецькі хіміки Фриц Габер и Карл Бош розробили процес, при якому амоніак утворюється із гідрогену і атмосферного азота (в умовах високих температур і високого тиску, а також в присутності каталізатора). .
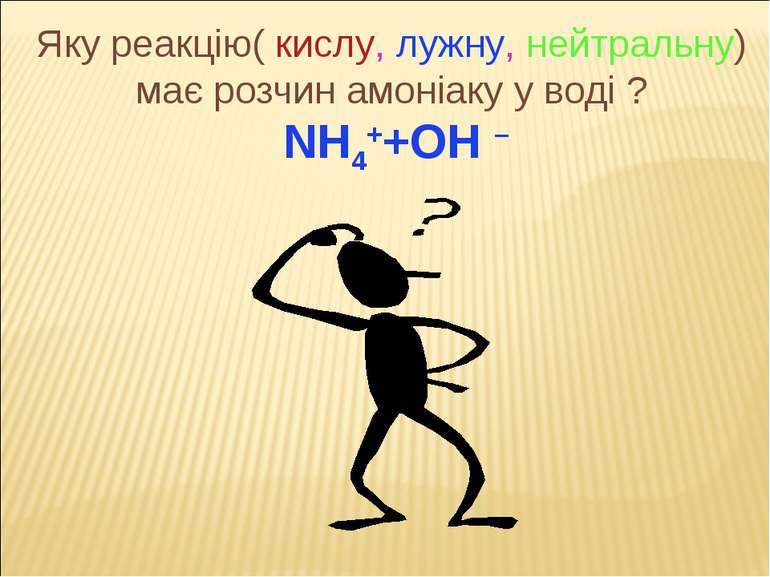
1.Окиснення (горіння) p,t 4NH3 + 5O2 = 4NO + 6H2O 2. Взаємодія з водою NH3 + H2O = NH3 • H2O = NH4++OH – (аміачна вода, гідроксид амонію, нашатирний спирт) 3. Взаємодія з кислотами NH3 + HCI = NH4CI – (амоній хлорид) 2NH3 + H2SO4 = (NH4)2SO4 NH3 +НNО3 = NH3 + Н2СО3 =
В медицині як “нашатирний спирт” (стимулює роботу серця і нервової системи) В побуті розчин амоніаку застосовується для виведення плям, чищення килимів, ювелірних виробів. Амоніак – сировина для виробництва нітратної кислоти.
. Д/з 1. Дія амоніаку на організм людини. 2.Забруднення навколишнього середовища через витоки амоніаку ( приклади) 3. Виробництво амоніаку. 4 Здійснити перетворення N→ NНз→ NH4СІ →NНз
Схожі презентації
Категорії