Презентація на тему:
"Амоніак"
Завантажити презентацію
"Амоніак"
Завантажити презентаціюПрезентація по слайдам:
Аміак Аміак, амоніак, амоняк, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді. Одержують каталітичним синтезом з азоту і водню під тиском. Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчину аміаку (нашатирний спирт) застосовується в медицині.
Фізичні властивості Аміак — безбарвний газ з характерним різким запахом і їдким смаком. Він майже у два рази легший від повітря. При —33,35°С і звичайному тиску аміак скраплюється в безбарвну рідину, а при —77,75°С замерзає, перетворюючись у безбарвну кристалічну масу. Його зберігають і транспортують у рідкому стані в стальних балонах під тиском 6—7 атм. У воді аміак розчиняється дуже добре: при 0°С і звичайному тиску в 1 об'ємі води розчиняється близько 1200 об'ємів NH3, а при 20°С — 700 об'ємів. Концентрований розчин містить 25% NH3 і має густину 0,91 г/см3. Розчин аміаку у воді називають аміачною водою або нашатирним спиртом. Звичайний медичний нашатирний спирт містить 10%: NH3. Різниця між нашатирним спритом та аміачною водою полягає у тому, що у нашатирному спирті відсоток аміаку 3-10%, а в амічній воді від 10% і більше. При нагріванні розчину аміак легко випаровується.
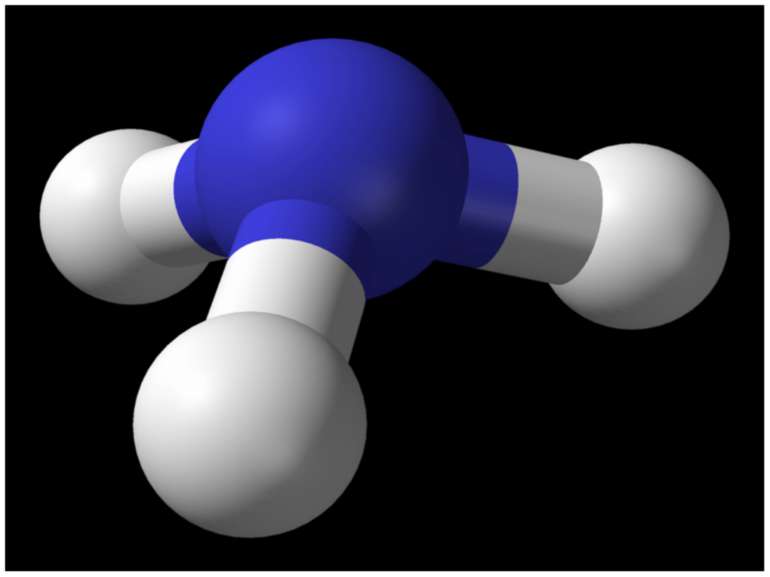
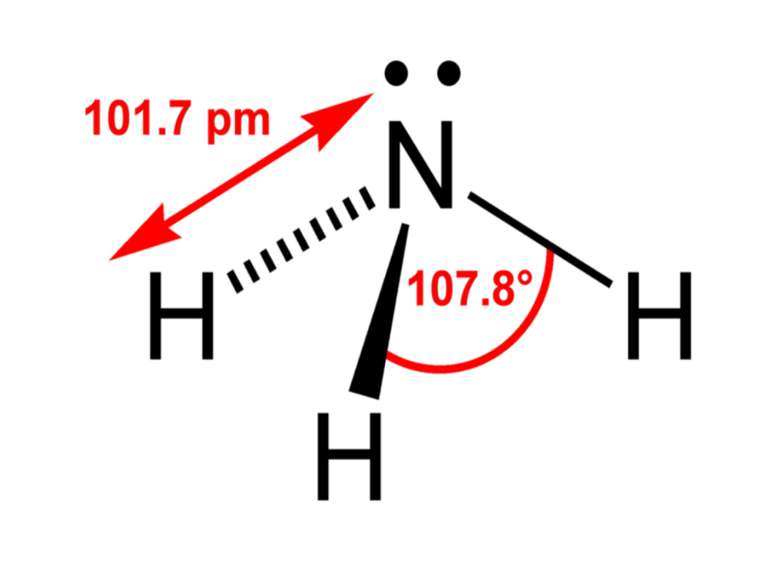
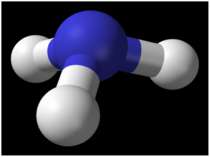
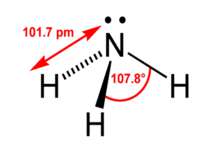
Хімічні властивості Молекули аміаку утворюються за допомогою ковалентних зв'язків. Електронна і структурна формули молекули аміаку такі: Н Н .. | :N:Н і N — Н .. | Н Н Однак зв'язки N — Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому атом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією: 4NH3 + 3O2 = 2N2 + 6H2O Амоніак також легко відновлює монооксид міді до металічної міді при високій температурі за реакцією: 3CuO + 2NH3 = 3Cu + N2 + 3H2O
Гідроксид амонію При розчиненні аміаку в воді частина його молекул взаємодіє з водневими іонами води з утворенням складного катіона амонію NH4+, який відіграє роль одновалентного металу (група амонію NH4 у вільному стані не існує, а лише у вигляді катіону NH4+). Разом з тим відповідна кількість гідроксильних груп OH- води звільняється. Цей процес рівноважний. Гідроксильні групи, у свою чергу, сполучаючись з катіоном амонію, утворюють сполуку NH4OH, яку називають гідроксидом амонію Внаслідок цих процесів у водному розчині аміаку встановлюється подвійна рівновага: з одного боку, між молекулами аміаку NH3 і молекулами води H2O та іонами амонію NH4+ і іонами гідроксилу і з другого — між молекулами гідроксиду амонію NH4OH і тими ж іонами амонію і гідроксилу Звідси виходить, що в розчині аміаку в рівновазі одночасно існують молекули аміаку, води і гідроксиду амонію та іони амонію і гідроксилу. Гідроксид амонію являє собою дуже нестійку речовину і може існувати лише в розчині. При нагріванні розчину рівновага зміщується вліво, і розчин розкладається на вихідні речовини. Цей розклад частково відбувається і при звичайній температурі, тому розчини аміаку завжди мають специфічний запах. При тривалому кип'ятінні розчину можна повністю видалити аміак. Цим інколи користуються в лабораторіях для одержання невеликих кількостей аміаку.
Розчин гідроксиду амонію має милкий смак і забарвлює червоний лакмус у синій колір. Отже, NH4OH є основа, хоч і дуже слабка. Тому лише незначна частина його молекул дисоціює на іони: NH4OH = NH4+ OH- З кислотами розчин гідроксиду амонію утворює солі, наприклад: NH4OH + HCl = NH4Cl + H2O NH4OH + HNO3 = NH4NO3 + H2O 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O Але солі амонію можуть утворюватись і при взаємодії кислот з аміаком. При цьому молекули аміаку приєднують водневі іони кислоти і перетворюються в катіони амонію: NH3 + HCl = NH4Cl NH3 + HNO3 = NH4NO3 2NH3 + H2SO4 = (NH4)2SO4
Добування аміаку В лабораторних умовах аміак добувають звичайно нагріванням суміші хлориду амонію NH4Cl з гашеним вапном Ca(OH)2. Процес утворення аміаку при цьому відбувається в дві стадії: спочатку виникає гідроксид амонію, а потім він розкладається з виділенням аміаку: 2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2 NH4OH = NH3u93; + H2O Інколи аміак добувають нагріванням до кипіння концентрованого розчину аміаку (гідроксиду амонію). При цьому NH3 утворюється за реакцією, наведеною вище. У техніці головним способом добування аміаку є прямий синтез його з азоту і водню за реакцією Ця реакція відбувається лише при дуже високих тисках (кілька сот атмосфер), високій температурі і наявності каталізатора. На сучасних заводах синтез проводять у більшості випадків при тисках 250—350 атм, а інколи навіть при 700—1000 атм. Чим більший тиск, тим більше рівновага реакції зміщується в бік утворення NH3, тобто в бік збільшення виходу аміаку. Але процес при дуже високих тисках дуже дорогий і економічно невигідний. Температуру підтримують близько 400—450°С. Нижче 400°С реакція відбувається дуже повільно, а вище 450— 500°С аміак помітно розкладається на азот і водень. Каталізатором служить губчасте залізо з домішками оксидів калію, алюмінію й інших речовин.
При цьому слід ще раз відмітити, що не вся азотоводнева суміш перетворюється в аміак навіть при найвищих тисках. Частина її залишається непрореагованою. Тому одержуваний аміак відділяють від непрореагованої суміші скрапленням його під тиском, а до решти суміші додають нові порції азото-водневої суміші і знову направляють на синтез. Значні кількості аміаку одержують як побічний продукт при коксуванні кам'яного вугілля. У кам'яному вугіллі, як уже говорилося, міститься від 1 до 2,5% азоту. При коксуванні вугілля більша частина цього азоту виділяється у вигляді аміаку. Його видаляють, з коксового газу пропусканням газу через воду. При цьому аміак розчиняється і утворює так звану аміачну воду. Цю воду нейтралізують сульфатною кислотою і одержують сульфат амонію, що використовується як азотне добриво. До кінця минулого століття цей спосіб був єдиним промисловим способом добування аміаку. Лише в 20-х роках, нашого століття, коли поширився синтетичний спосіб, він втратив своє значення.
Застосування Амоніак — один з найважливіших продуктів сучасної хімічної промисловості. Головною галуззю його застосування є виробництво нітратної кислоти і азотних добрив. Крім того, аміак використовують для виробництва багатьох інших хімічних продуктів. Останнім часом зріджений аміак і водний розчин аміаку стали широко застосовувати безпосередньо як азотне добриво.
Схожі презентації
Категорії