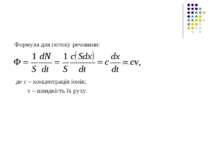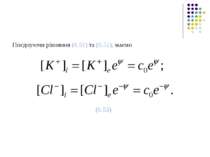Презентація на тему:
МЕДИЧНА І БІОЛОГІЧНА ФІЗИКА
Завантажити презентацію
МЕДИЧНА І БІОЛОГІЧНА ФІЗИКА
Завантажити презентаціюПрезентація по слайдам:
МЕДИЧНА І БІОЛОГІЧНА ФІЗИКА ІІ том Мова: українська Під загальною редакцією члена-кореспондента АПН України професора О.В.Чалого
Розділ 6 ЕЛЕМЕНТИ МОЛЕКУЛЯРНОЇ БІОФІЗИКИ ТА БІОФІЗИКИ МЕМБРАННИХ ПРОЦЕСІВ У КЛІТИНАХ Стор.(6 – 96)
Роботу виконала: Учениця 11- А класу Укараїнського медичного ліцею Національного медичного університету імені О.О. Богомольця Сличко Маріанна Іванівна Вчитель: Лялько Віра Іванівна
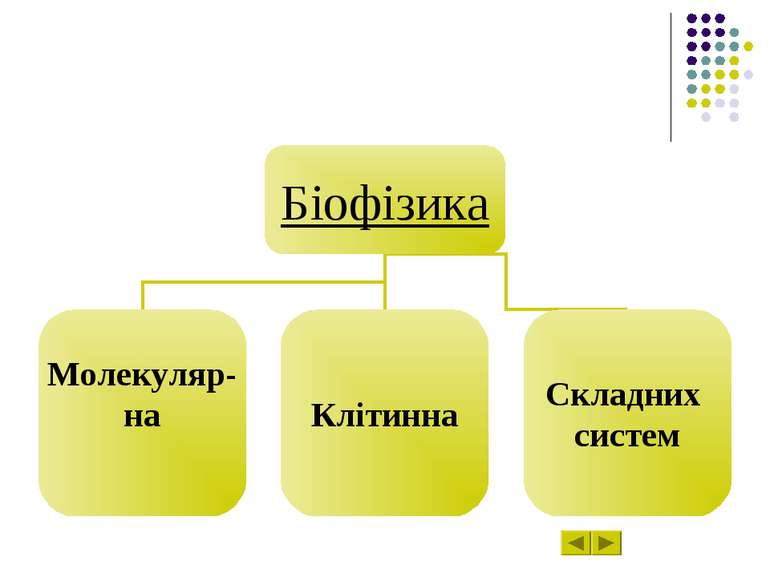
Розділ 6 Епіграф Біофізика Молекулярна біофізика Біофізика клітинних процесів Біофізика складних систем Досягнення в сучасній біофізиці
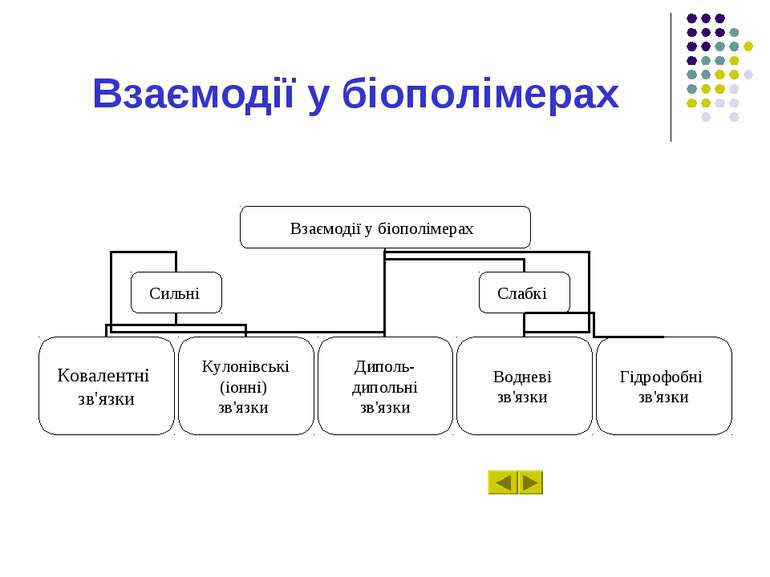
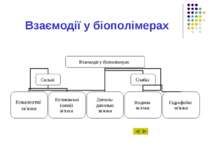
Розділ 6.1 Взаємодії у біополімерах. Міжмолекулярні взаємодії для трьох різних областей відстаней між атомами. Перша область. Друга область. Третя область. Сильні ковалентні взаємодії. Величини сильних взаємодій.
Розділ 6.1 Іонні взаємодії. Електростатичні (іон-дипольні та інші мультипольні) взаємодії. Слабкі взаємодії. Потенціали взаємодій у мультиполів. Диполь-дипольна взаємодія. Орієнтаційна диполь-дипольна взаємодія.
Розділ 6.1 Індукційна диполь-дипольна взаємодія. Енергія індукційної взаємодії. Дисперсійні (Ван-дер-Ваальсівські) взаємодії. Формула Лондона. Гідрофобні взаємодії. Структури білкових молекул.
Розділ 6.1 Амінокислотні залишки білків. Водневі зв'язки. Нейтральні міжмолекулярні водневі зв'язки. Значення температури кипіння при наявності водневих зв'язків. Аномально високі температури. Енергія міжмолекулярних взаємодій.
6.2. Структурна організація білків та нуклеїнових кислот 6.2.1. Первинна структура 6.2.2. Вторинна структура 6.2.3. Третинна структура 6.2.4. Четвертинна структура Розділ 6.2
Розділ 6.3 Біологічні мембрани; Структура клітини та її функціональних одиниць; Схематичне зображення молекули фосфоліпіду; Гідрофобний хвіст і полярна голівка молекули фосфоліпіду; Самозбірка ліпідів у водному розчині; Фосфоліпідний бішар; Міцелярні структури; Загальна схема будови біологічної мембрани; Рідкі кристали;
Розділ 6.3 Бішар; Оцінка частоти перескоків v і характерних відстаней таких перескоків при латеральній дифузії; Обчислення середньої відстані при перескоці; Перехід молекул на інший бік бішару; Фазові стани ліпідного бішару; Транс-гош-переходи; Перенос молекули внаслідок дифузії “кінка”. Властивості поверхонь клітинних мембран;
Розділ 6.3 Фактори розділу фаз в мембранах; Кооперативна реакція типу фазового переходу; Рідкокристалічна концепція С.Сингера і Дж. Нікольсена; Вивчення структури і функцій біологічних мембран, як сучасна області біофізики; Патології при порушенні структури і бар'єрної функції мембран; Контрольні питання.
Розділ 6.4 6.4.1. Пасивний транспорт незаряджених молекул 6.4.2. Пасивний транспорт іонів 6.4.3. Активний транспорт Контрольні запитання
Розділ 6.5 6.5.1. Рівноважний мембранний потенціал Нернста 6.5.2. Дифузійний потенціал 6.5.3. Потенціал Доннана. Доннанівська рівновага 6.5.4. Стаціонарний потенціал Гольдмана-Ходжкіна-Катца 6.5.5. Потенціал дії. Механізм виникнення та поширення нервового імпульсу
6.6. Лабораторний практикум 6.6.1. « Дослідження нелінійних властивостей провідності жаби» 6.6.2. « Дослідження дисперсії електричного імпедансу біологічних мембран» 6.6.3. « Вимірювання концентраційного потенціалу компенсаційним методом» 6.6.4. « Вивчення біофізики мембран за допомогою комп’ютерних програм»
Біофізика – наука про явища живої природи!!! Быть может, эти электроны Миры, где пять материков, Искусства, знанья, войны, троны И память сорока веков ! Еще, быть может, каждый атом Вселенная, где сто планет, Там все, что здесь, в объеме сжатом, Но также то, чего здесь нет.” Валерий Брюсов
Біофізика – наука про явища живої природи, які вивчають на всіх рівнях, починаючи з молекул і клітин та закінчуючи біосферою в цілому, на підставі загальних законів фізики і насамперед на уявленні про атомно-молекулярну будову речовини.
Молекулярна біофізика вивчає будову і фізико-хімічні властивості біологічно функціональних молекул, передусім – біополімерів – білків і нуклеїнових кислот. Завдання молекулярної біофізики – розкрити фізичні механізми, що відповідають за біологічні функції молекул.
Біофізика клітинних процесів вивчає структурно-функціональну організацію клітин, зокрема молекулярну організацію клітинних мембран, процеси транспорту речовин крізь мембранні структури, електрогенез та біоенергетику клітин, механізм міжклітинної взаємодії.
Біофізика складних систем вивчає моделі біологічних процесів, зокрема різноманітні сенсорні системи, проблеми біологічного розвитку, принципи регуляції внутрішнього середовища організму.
Методологія біофізики – це математичний апарат і експериментальні методи фізики. Математичні і теоретичні основи сучасної біофізики спираються насамперед на термодинаміку і статистичну фізику, молекулярну фізику і квантову механіку.
Досягнення в сучасній біофізиці Вивчена будова і властивість біологічно функціональних молекул (білків і нуклеїнових кислот). Досліджені властивості і створені надійні молекулярні моделі функціонування клітинних структур.
Успішно розвиваються фізико-математичні моделі складних біологічних процесів (зокрема, тих процесів, що відбуваються в організмі людини). Для вивчення цих процесів великого значення набувають ідеї і методи термодинаміки відкритих біологічних систем і синергетики.
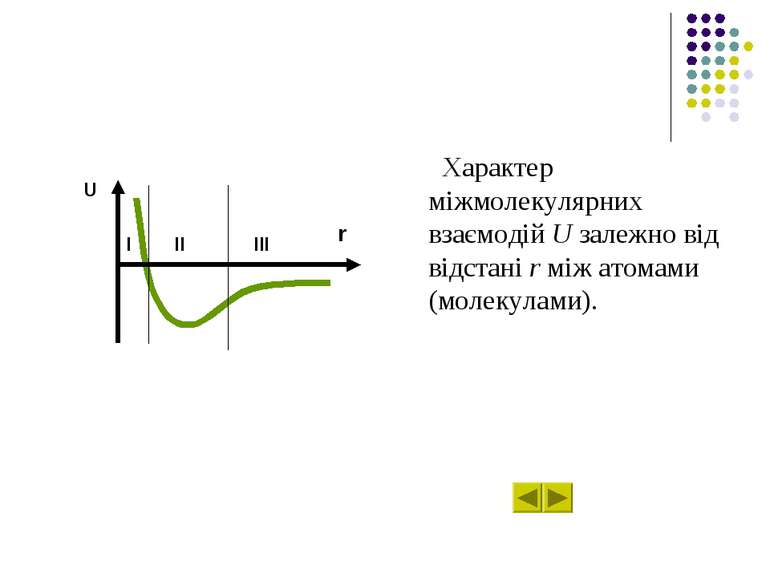
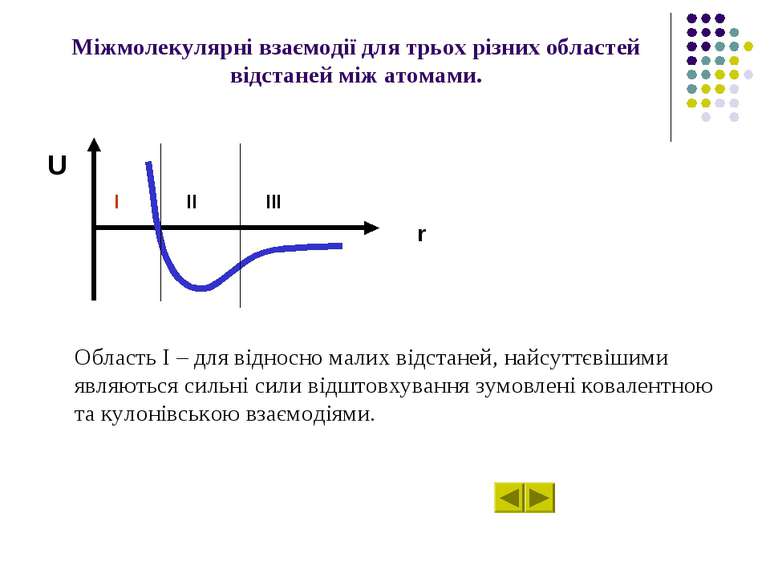
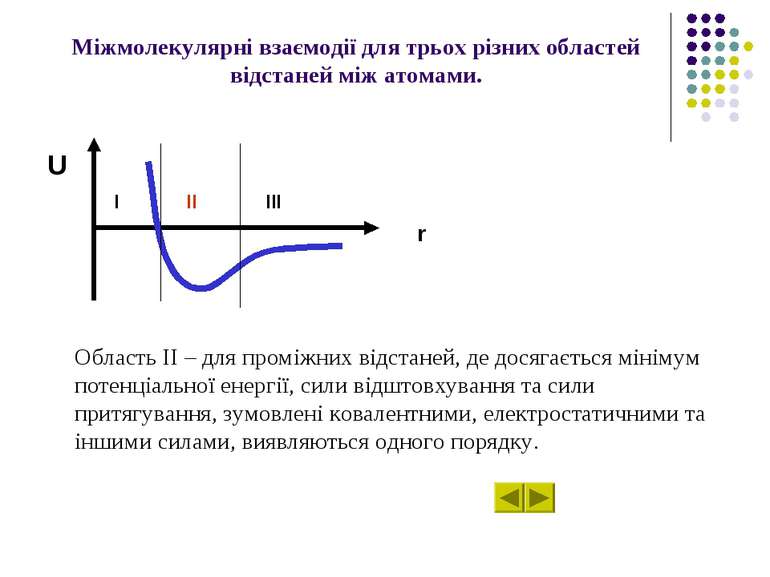
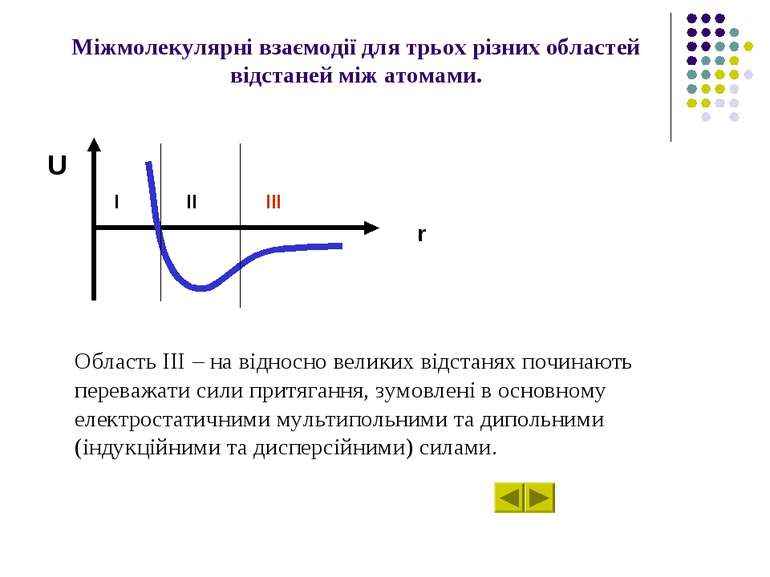
Характер міжмолекулярних взаємодій U залежно від відстані r між атомами (молекулами). U r II III I
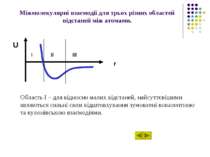
Міжмолекулярні взаємодії для трьох різних областей відстаней між атомами. Область І – для відносно малих відстаней, найсуттєвішими являються сильні сили відштовхування зумовлені ковалентною та кулонівською взаємодіями. U r I II III
Міжмолекулярні взаємодії для трьох різних областей відстаней між атомами. Область ІІ – для проміжних відстаней, де досягається мінімум потенціальної енергії, сили відштовхування та сили притягування, зумовлені ковалентними, електростатичними та іншими силами, виявляються одного порядку. U r I II III
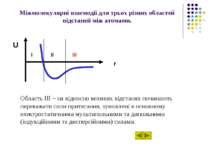
Міжмолекулярні взаємодії для трьох різних областей відстаней між атомами. Область ІІІ – на відносно великих відстанях починають переважати сили притягання, зумовлені в основному електростатичними мультипольними та дипольними (індукційними та дисперсійними) силами. U r I II III
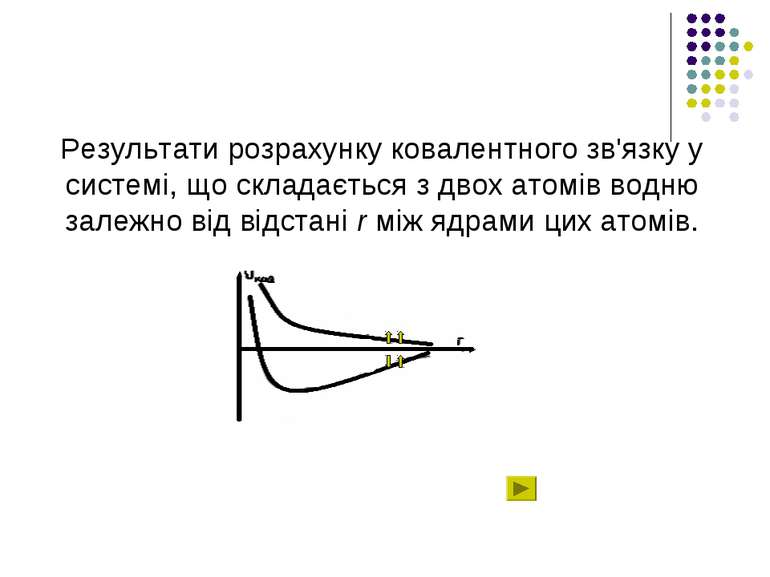
Сильні ковалентні взаємодії – це взаємодії, зумовлені зовнішніми електронами атомів. Поняття ковалентного зв'язку було запропоноване Л’юїсом у 1916 році, який пов'язав його з утворенням електронної пари, що належить одночасно двом атомам. Квантово-механічний розрахунок ковалентного зв'язку в молекулі водню на підставі рівняння Шредінгера був проведений Гайтлером та Лондоном у 1927 році.
Результати розрахунку ковалентного зв'язку у системі, що складається з двох атомів водню залежно від відстані r між ядрами цих атомів.
В залежності від орієнтації спінів може мати місце як відштовхування – спіни паралельні (крива 1), так і притягання – спіни антипаралельні (крива 2).
У випадку притягання рівноважне положення двох атомів досягається тоді, коли відстань між ними дорівнює r0. Ковалентний зв'язок у двох однакових атомах характеризується симетричною щодо обох ядер хвильовою функцією електронів та антисиметричною спіновою хвильовою функцією – неполярний зв'язок.
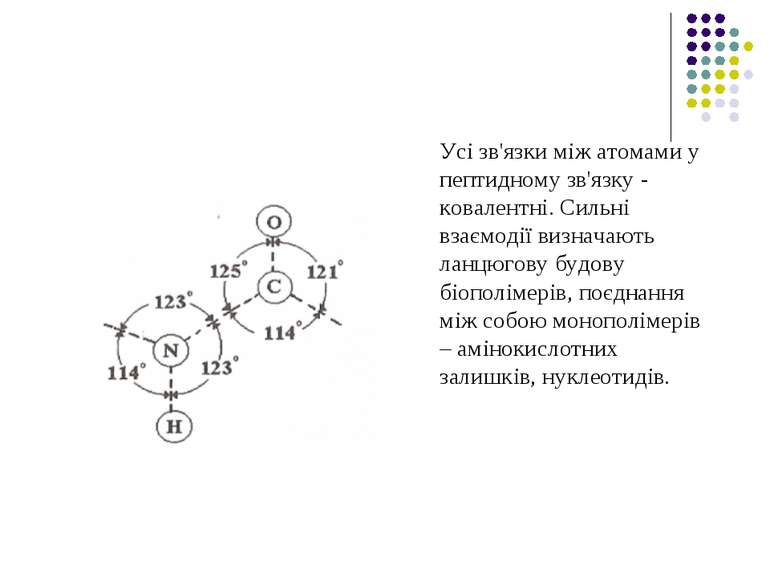
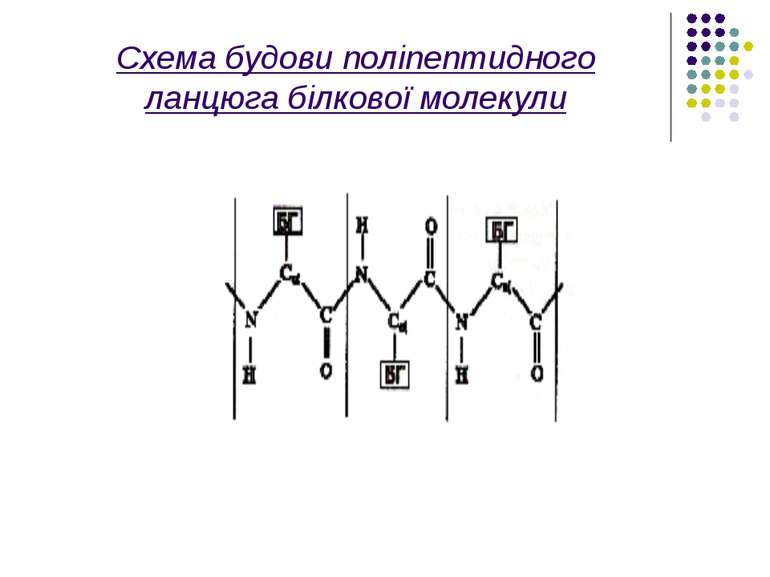
Величини сильних взаємодій Енергія, що необхідна для розриву С-С зв'язку дорівнює 349 кДж/моль, а для С-N зв'язку відповідно – 336 кДж/моль. Основний елемент зв'язку амінокислотних залишків у білках – це пептидний зв'язок – CO-NH-. Він має плоску будову як показав Л.Полінг.
Усі зв'язки між атомами у пептидному зв'язку - ковалентні. Сильні взаємодії визначають ланцюгову будову біополімерів, поєднання між собою монополімерів – амінокислотних залишків, нуклеотидів.
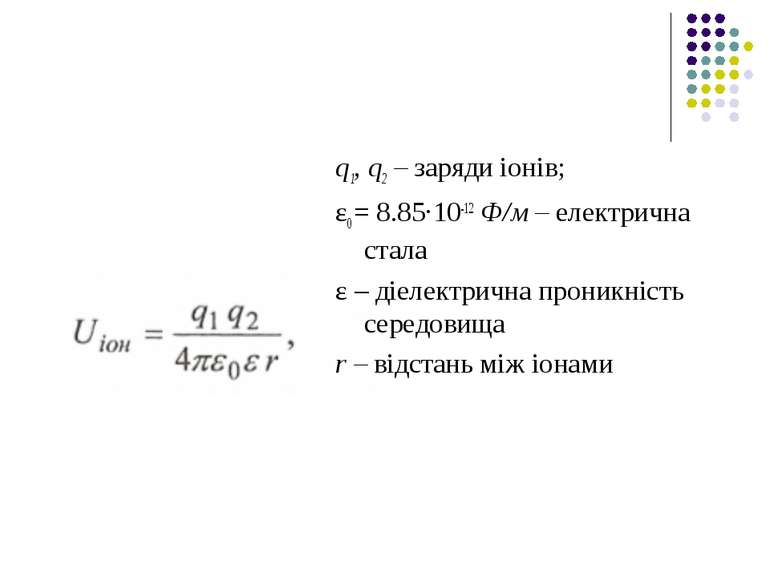
Іонні взаємодії. Сили взаємодії між іонами зумовлені законом Кулона. Енергія іон-іонної взаємодії має такий вигляд:
q1, q2 – заряди іонів; ε0 = 8.85·10-12 Ф/м – електрична стала ε – діелектрична проникність середовища r – відстань між іонами
Іонні зв'язки утворюються між фосфатними групами в нуклеїнових кислотах і катіонами. Аніонами є кислотні залишки – глутамін (Глу), тирозину (Тир), тоді як в ролі катіонів виступають основні залишки – лізин (Ліз), аргінін (Арг), гістидин (Гіс). Величина іон-іонної взаємодії має той самий порядок, як і ковалентна взаємодія, тобто сотні кДж/моль.
Електростатичні (іон-дипольні та інші мультипольні) взаємодії. Біомолекули не могли б функціонувати, якби, окрім сильних зв'язків усередині біомолекул, не існували б нековалентні зв'язки, більш слабкі сили.
Слабкі взаємодії – це взаємодії всередині клітини і їх органоїдів, це взаємодія між білками та ліпідами, вуглеводами, нуклеїновими кислотами. Слабкі взаємодії спонукають до рухомих, нежорстких конформацій, що необхідні для функціонування біоорганізмів.
Іон-дипольні взаємодії – це взаємодії між іонами та полярними групами молекул. Полярними молекулами (групами) - називаються молекули, що володіють дипольним моментом, котрий у відсутності зовнішнього електронного поля не дорівнює нулю. Потенціал іон-дипольної взаємодії залежить від заряду іона q0 і дипольного моменту p=ql полярної групи відповідно до формули
Звідки виникає залежність Uіон-диполь від відстані. В загальному випадку потенціал поля, який утворює система зарядів на відстанях, більших порівняно з розмірами системи, може бути поданий у вигляді ряду потенціальних мультиполів (зарядів-монополів, диполів, квадруполів).
Потенціальна енергія взаємодії заряду q0 в точці R з системою зарядів (Рис 6.4) , що утворюються в точці R потенціал φ(R), дається таким виразом:
Другий доданок у формулі відповідає потенціалу іон-дипольної взаємодії, що визначається формулою (6.2).
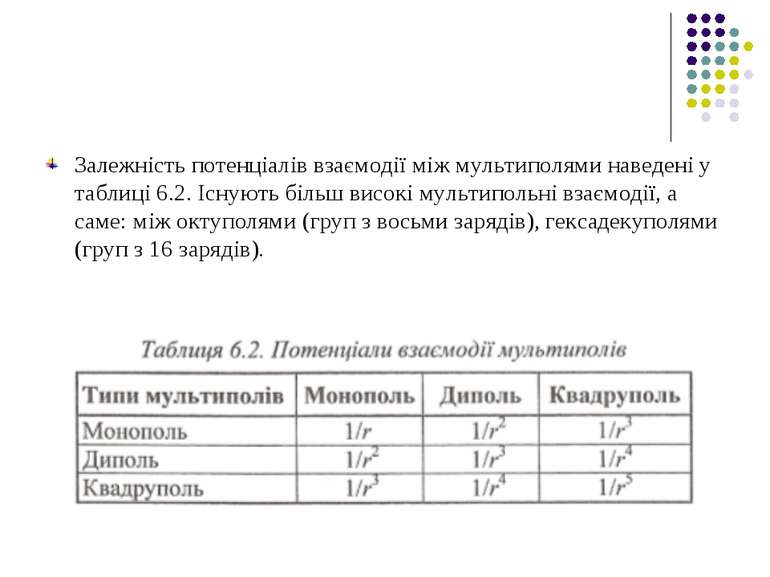
Якщо у точці R знаходиться не один заряд q0, а система зарядів, то для них можна записати також формулу для потенціалу у вигляді ряду по мультиполях. Отже, має місце мультиполь-мультипольна взаємодія двох систем зарядів, що входять до складу, наприклад, двох біомакромолекул або двох груп певної біомакромолекули.
Залежність потенціалів взаємодії між мультиполями наведені у таблиці 6.2. Існують більш високі мультипольні взаємодії, а саме: між октуполями (груп з восьми зарядів), гексадекуполями (груп з 16 зарядів).
Диполь-дипольна взаємодія – взаємодія між диполями молекул або полярними групами молекул. Типи диполь-дипольних взаємодій. Орієнтаційні взаємодії. Індукційні взаємодії Дисперсійні (Ван-дер-Ваалівські) взаємодії.
Орієнтаційна диполь-дипольна взаємодія. Формула для потенціалу цієї взаємодії має такий вигляд:
Якщо теплова енергія kT більша за Uор, то тепловий рух руйнує переважну орієнтацію і тоді усереднення за орієнтацією, як показали Рейнганум та Кеєзом, дає результат, відмінний від нуля, тільки для величини усередненої диполь-дипольної взаємодії.
Видно, що ця взаємодія обернено пропорційна температурі T і шостому степеню відстаней між диполями.
Індукційна диполь-дипольна взаємодія. Ця взаємодія викликана тим, що сталий диполь однієї молекули індукує в іншій молекулі чи групі молекул дипольний момент. Індукований електричним полем Е дипольний момент дорівнює:
Напруженість Е електричного поля, що створюється сталим диполем р0 на відстані r від нього, де знаходиться молекула (група молекул) з індуктивним диполем р має вигляд:
Дисперсійні (Ван-дер-Ваальсівські) взаємодії Ці взаємодії визначають внутрішньо- та міжмолекулярні взаємодії атомних груп і молекул, насичених валентними зв'язками. Вони не залежать від зарядів q, дипольних p і квадрупольних Qαβ моментів. Зокрема, ці взаємодії відповідають за існування молекулярних кристалів.
Ще одна назва дисперсійних взаємодій – Ван-дер-Ваальсівські взаємодії – пов'язані з тією важливою обставиною, що вони визначають поправку на тиск у рівнянні Ван-дер-Ваальса для реальних газів.
Дисперсійні сили мають квантовий характер. Теорія дисперсійних сил була створена для частинного випадку в 1927р. Вантоле, а для загального випадку в 1930р. Лондоном. У 1948 році було враховано запізнення дисперсійної взаємодії на великих відстанях, тобто будь-яка взаємодія повинна поширюватись у просторі із скінченою швидкість.
Вище наведений факт щодо скінченої швидкості взаємодій розробили Казимір і Польдер, які показали, що енергія міжмолекулярної дисперсійної взаємодії обернено пропорційна відстані між молекулами в степені 7, тобто UКП~1/r7.
У 1955 році Є.М.Ліфшиц створив загальну теорію Ван-дер-Ваальсівських сил між макроскопічними тілами.
Формула Лондона для дисперсійних (Ван-дер-Ваальсівських) сил отримується при розв’язанні рівняння Шредінгера за допомогою так званої теорії збурення. ЇЇ суть полягає у врахуванні миттєвого значення електростатичної енергії взаємно індукованих диполів двох молекул з наступним усередненням по їх орієнтаціях.
Формула Лондона ћ=h/2 = 1.05·10-34 Дж·с – стала Планка, поділена на 2 , і – поляризованість та власна частота гармонічних осциляторів, за допомогою яких можна описати рух електронів у атомі.
Величина енергії дисперсійних (Ван-дер-Ваальсівських) взаємодій має порядок кількох кДж/моль. Такий самий порядок має енергія випаровування рідини.
Гідрофобні взаємодії Біополімери – білки і нуклеїнові кислоти – знаходяться у водному середовищі. Між молекулами води і неполярними атомними групами діють сили відштовхування – гідрофобні сили.
Гідрофобні взаємодії відіграють важливу роль у формуванні структури білків, мембран. Так завдяки гідрофобним взаємодіям між водним оточенням та “хвостами” фосфоліпідних молекул, які складаються з неполярних залишків жирних кислот, а також гідрофільними взаємодіями, тобто силами притягання, між полярними “головками” фосфоліпід них молекул та молекулами води, що мають постійні диполі, відбувся процес само збірки – утворення подвійного шару фосфоліпідних молекул.
Структури білкових молекул Первинна структура – визначається послідовністю амінокислотних залишків у білковому ланцюгу. Вторинна структура – це є спіральна структура білкових молекул і нуклеїнових кислот.
Третинна структура – пов'язана з утворенням глобул. Четвертинна структура – формується за рахунок об'єднання кількох глобул Дві останні структури значною мірою існують завдяки гідрофобним взаємодіям.
Утворення структур пов'язане з дією різних сил. Єдині сильні сили у білковій глобулі – це ковалентні (хімічні) сили, які утворені, зокрема, дисульфідними зв'язками – сірчані місточки S-S. Енергія цих зв'язків дорівнює 240 кДж/моль.
Якщо б більше не було ніяких сил, то білковий ланцюг був би негнучкий, тому в біополімерах діють також і більш слабкі зв'язки – електростатичні, Ван-дер-Ваальсівські, водневі та гідрофобні взаємодії.
Молекули, що мають як полярні, так і неполярні групи, розташовуються у водному середовищі так, що полярні (гідрофільні) групи контактують з водою за рахунок диполь-дипольних сил притягання, а не полярні групи з водного середовища вилучаються через гідрофобну взаємодію.
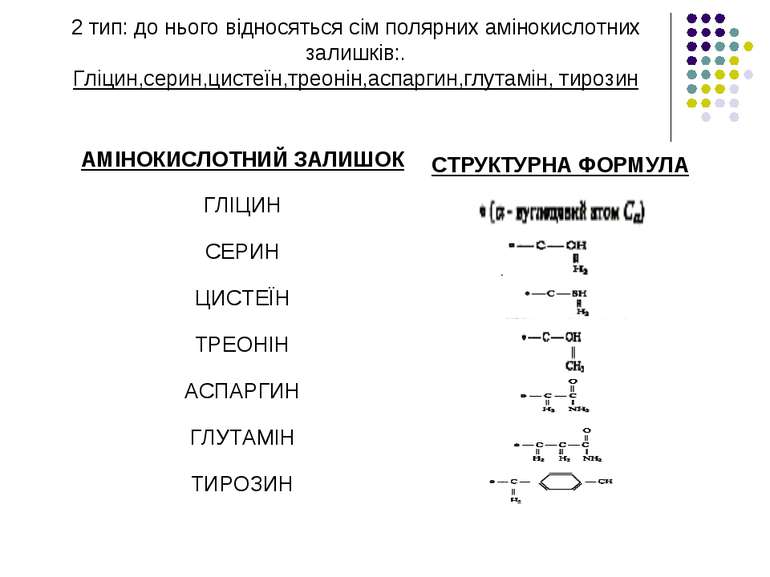
Серед амінокислотних залишків білків, існують як полярні (гідрофільні), так і неполярні (гідрофобні) ділянки. Полярні амінокислотні залишки (Асп, Тир, Гіс, Ліз, Арг, Сер, Тре) – гідрофільні. Решта 12 залишків вважаються гідрофобними.
Оскільки у білковому ланцюгу є слабкі зв'язки, то він може згорнутися у глобулу, при цьому гідрофобні ділянки будуть всередині, а гідрофільні – ззовні. Якщо концентрації гідрофільних, достатньо для покриття поверхні сферичного гідрофобного ядра, то глобула має сферичну форму.
Такий механізм визначає утворення четвертинної структури – об'єднання між собою кількох глобул. Молекула гемоглобіну містить чотири глобули, вірус тютюнової мозаїки – близько 2000 глобул.
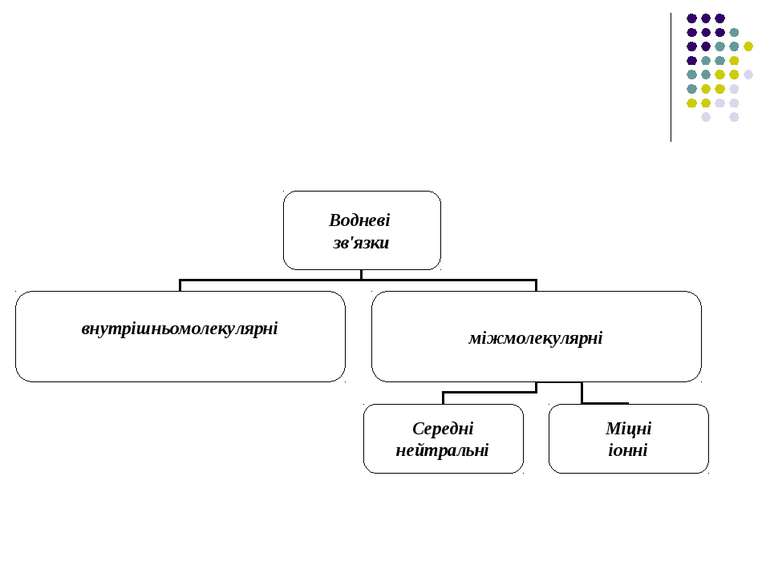
Водневі зв'язки Ряд сполук (спирти, феноли) утворюють стійкі асоціати, які мають певні аномалії в їх фізико-хімічних властивостях (наприклад, підвищення температури кипіння, зменшення міжатомних відстаней та ін.)
Подібні властивості мають сполуки, до складу яких входять атом водню в групах типу ОН та NН. Так виникла ідея про водневі зв'язки. Вперше поняття водневих зв'язків було введено у 1920 році Латимером і Родебургом для пояснення властивостей асоційованих речовин, зокрема води.
Атом водню, що міститься в групах O-H, N-H, H-F, H-Cl й інколи S-H і C-H утворює специфічний зв'язок з атомами O, N, F, Cl тієї самої або іншої молекули. В цих комплексах, які схематично можна зобразити у вигляді Х...Н-У, атом водню відіграє роль мосту між елетровід’ємними атомами.
Нейтральні міжмолекулярні водневі зв'язки існують між нейтральними молекулами і є типовим для розчинів спиртів, карбонових кислот. Такі водневі зв'язки мають енергію в інтервалі 4-60 кДж/моль, що приблизно на порядок менше за енергію ковалентних (хімічних) взаємодій. При цьому відстані між атомами Х і У складають до 0.3 нм.
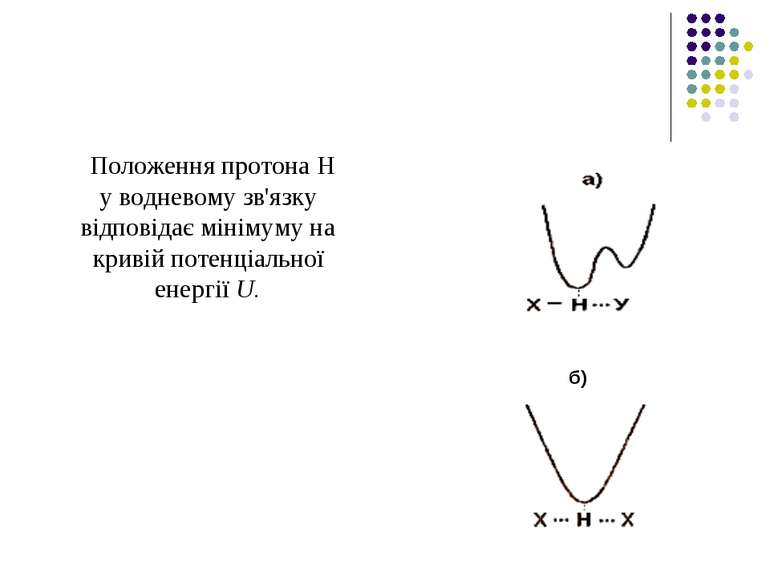
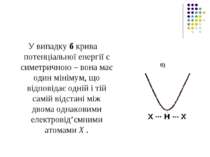
Положення протона Н у водневому зв'язку відповідає мінімуму на кривій потенціальної енергії U. б)
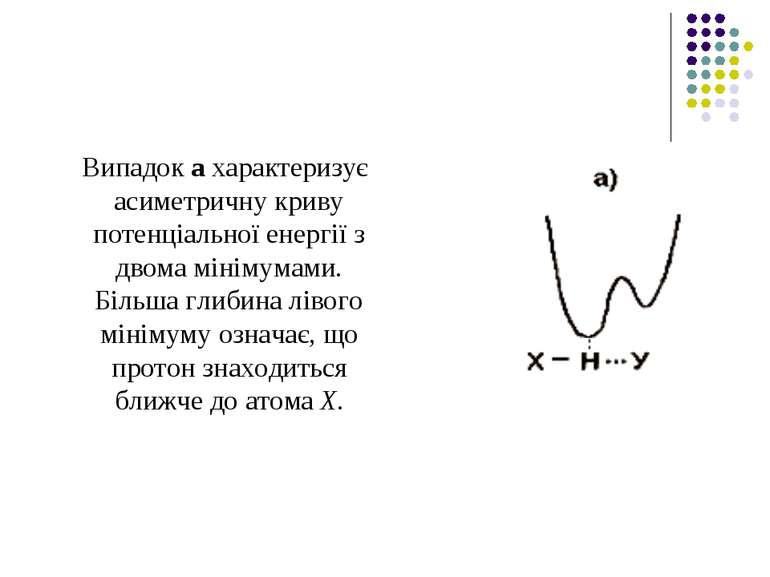
Випадок а характеризує асиметричну криву потенціальної енергії з двома мінімумами. Більша глибина лівого мінімуму означає, що протон знаходиться ближче до атома Х.
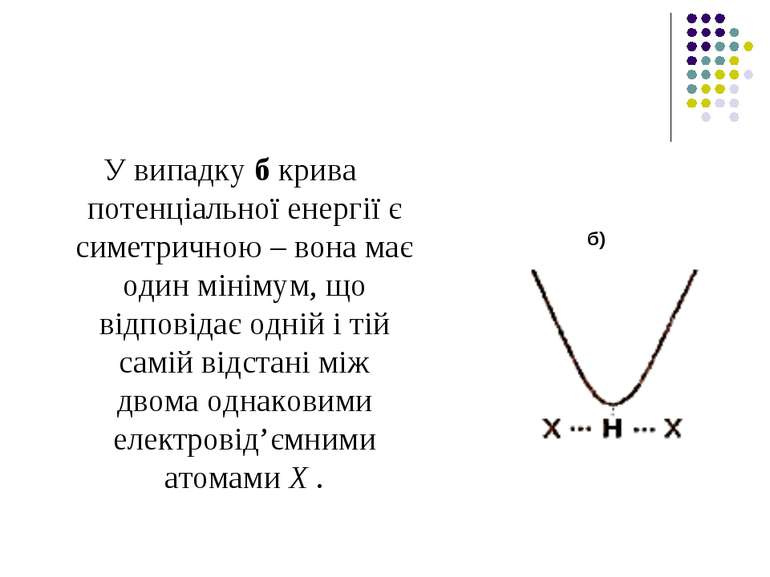
У випадку б крива потенціальної енергії є симетричною – вона має один мінімум, що відповідає одній і тій самій відстані між двома однаковими електровід’ємними атомами Х . б)
В тих випадках коли електровід’ємні іони (Cl, F та інші) утворюють водневі зв'язки з молекулами, до складу яких входять групи OH, NH, FH, H2O тощо, виникають міцні (іонні) водневі зв'язки з енергією 55-250 кДж/моль з досить короткими відстанями між атомами Х і У.
Так, водневий зв'язок у комплексі Cl-...HOH характеризується енергією 55кДж/моль, причому рівноважна відстань rxy=0.33нм, тоді як в комплексі [F...H...F]- енергія утворення цього комплексу набуває значення 252.8 кДж/моль, що є близьким до енергії ковалентних (хімічних) зв'язків.
Рівноважна відстань між іонами фтора в комплексі [F…H…F]- дорівнює 0.22 нм, тобто вона в 1.5 раза менша за відстань між іоном хлора і групою OH в комплексі Cl-…HOH.
Наявність водневих зв'язків приводить до підвищення температури кипіння та інших фізико-хімічних властивостей речовини.
Температура кипіння підвищується у ряді споріднених сполук (наприклад, H2S, H2Se, H2Te) із збільшенням молекулярної ваги.
Аномально високі температури тверднення і кипіння води – це є також результат утворення водневих зв'язків. Якщо б у воді були відсутні водневі зв'язки, то її температура тверднення Ттверд (за теоретичними оцінками) мала бути Ттверд=-100ºС, а не Ттверд=0ºС
За цими ж оцінками температура кипіння за відсутності водневих зв'язків має бути приблизно Ткип =-80ºС, тоді як в дійсності Ткип=100ºС, тобто стає на 180ºС вище саме завдяки наявності водневих зв'язків.
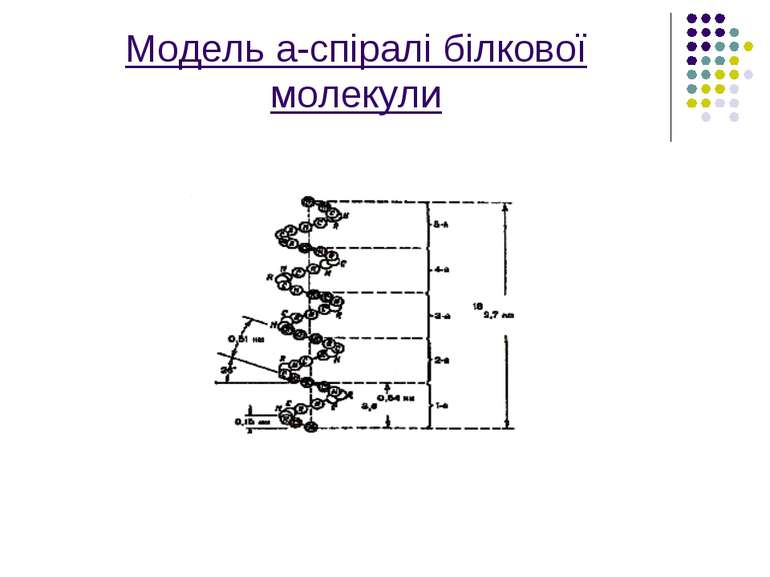
Водневі зв'язки значною мірою визначають стійкість вторинної структури білків. Саме внутрішньомолекулярні Н-зв'язки між групами поліпептидного ланцюга підтримують - спіральну структуру білка.
Прийнято вважати, що потенціальна енергія водневих зв'язків може бути апроксимована сумою двох доданків Uвод.зв. = Uміжмол + U кул де перший доданок визначає енергію міжмолекулярної взаємодії, а другий – кулонівську енергію іон-іонної взаємодії.
Енергія міжмолекулярної взаємодії задається формулою: яка відповідно до моделі Леннард-Джонса враховує як сили відштовхування, так і сили притягання (перший і другий доданки в формулі).
Досить поширеним є таке представлення для потенціалу міжмолекулярної взаємодії, в якому m=12, n=6 (потенціал Мі). Зауважимо, що значення n=6 для потенціалу сил притягання має своє обґрунтування в теорії диполь-дипольної взаємодії (дивись формули 1-2 для орієнтаційної, індукційної та дисперсійної взаємодії)
Що стосується показника m=12 для потенціалу сил відштовхування, то він обирається у вигляді m=2n з міркувань математичної зручності.
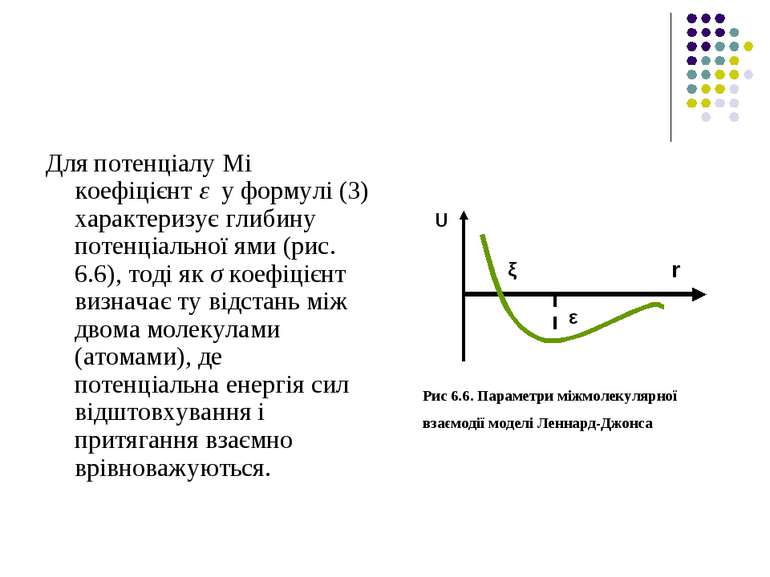
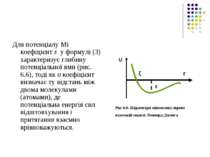
Для потенціалу Мі коефіцієнт ε у формулі (3) характеризує глибину потенціальної ями (рис. 6.6), тоді як σ коефіцієнт визначає ту відстань між двома молекулами (атомами), де потенціальна енергія сил відштовхування і притягання взаємно врівноважуються. Рис 6.6. Параметри міжмолекулярної взаємодії моделі Леннард-Джонса U r ξ ε
Контрольні питання Дати визначення – “біофізика”. Різновиди, основні завдання та досягнення в біофізиці? Сильні ковалентні взаємодії. Ковалентний зв'язок та його розрахунки у системі, що складається з двох атомів водню? Іонні взаємодії?
Електростатичні (іон-дипольні та інші мультипольні) взаємодії? Іон-дипольні взаємодії. Виникнення залежності Uіон-диполь від відстані? Дати визначення – “диполь-дипольні взаємодії”. Різновид? Орієнтаційні диполь-дипольні взаємодії? Індукційні диполь-дипольні взаємодії?
Дисперсійні (Ван-дер-Ваальсівські) взаємодії. Теорія дисперсійних сил. Формула Лондона для дисперсійних сил? Гідрофобні взаємодії. Структури білкових молекул. Амінокислотні залишки білків?
Водневі зв'язки. Різновид. Значення температури кипіння при наявності водневих зв'язків. Пояснення та формула енергії міжмолекулярної взаємодії? Формули для енергії взаємодії у біополімерах?
Структурна організація Структурна організація біополімерів - білків і нуклеїнових кислот-має першочегове значення для розуміння їх функцій в живих організмах, з’ясування молекулярної природи живого. Перейдемо безпосередньо до класифікації структурної організації білків і нуклеїнових кислот. Таблиця містить в собі відомості про чотири види структурної організації біополімерів, типи впорядкування та характер взаємодій,що їм відповідають
Первинна структура Макромолекули білків і нуклеїнових кислот характеризують чітко відповідною послідовністю мономерів,а саме:в білках-послідовністю амінокислотних залишків в поліпептидному ланцюгу,в нуклеїнових кислотах- послідовністю окремих нуклеотидів в полінуклеотидному ланцюгу.Окремі ділянки цих ланцюгів,тобто поруч розташовані амінокислоти та нуклеотиди, пов’язані між собою дуже сильними хімічними ковалентними зв’язками, величина яких може досягати 800 кДж/моль.
До речі, середня теплова енергія одноатомних молекул при кімнатній температурі(Т=300 К) має величину: Uтепл =3/2kT*NA = 3/2 RT=3.7 кДж/моль.
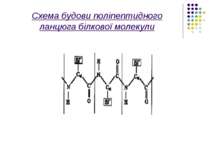
Розглянемо більш детально первинну структуру білків, що визначається послідовністю амінокислот. Амінокислоти мають дві частини: 1)однакову для всіх амінокислот пептидну групу;2)Бокову групу, від якої залежить специфіка амінокислоти. Всього таких бокових груп (і відповідно амінокислот)може бути 20 .Кожний пептидний блок поліпептидного ланцюга складається з ковалентно пов’язаних атомів –CO-NH-
Первинна структура нуклеїнових кислот визначається послідовністю мономерів в полінуклеоїдному ланцюгу. Кожний нуклеотид складається з фосфатів і сахару, які пов’язані сильними ковалентними силами і тим самим визначають міцність ланцюга,а також азотних основ двох типів-пуринових(аденін та гуанін), та піримідинових(тимін,цитозині урацил).
Є три типи амінокислотних залишків. 1 тип:до нього відноситься п’ять заряджених амінокислотних залишків. А.аргинін,гістидин,лізин. Б.аспарагінова та глутамінова кислоти
2 тип: до нього відносяться сім полярних амінокислотних залишків:. Гліцин,серин,цистеїн,треонін,аспаргин,глутамін, тирозин
Неполярні амінокислотні залишки 3 тип:до нього відноситься вісім неполярних амінокислотних залишків.Для них є характерними ефекти гідрофобної взаємодії. А.Аланін,валін,ізолейцин,лейцин,метіонін,пролін,триптофан,феніланін.
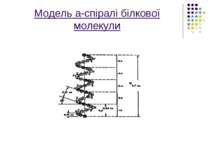
Вторинна структура Завдяки використанню прецизійного фізичного методу рентгеноструктурного аналізу,вчені вченні відкрили вторинну структуру макромолекул,яка полягає в тому,що поряд з лінійними ділянками в біополімерах були знайдені також ділянки,певним чином скручені в спіраль або якусь іншу конформацію.
На малюнку зображена модель а-спіраль поліпептидного ланцюга білкової молекули,що закручена на право за стрілкою годинника. Основна причина утворення вторинної структури-це наявність водневих зв’язків між амінокислотними залишками
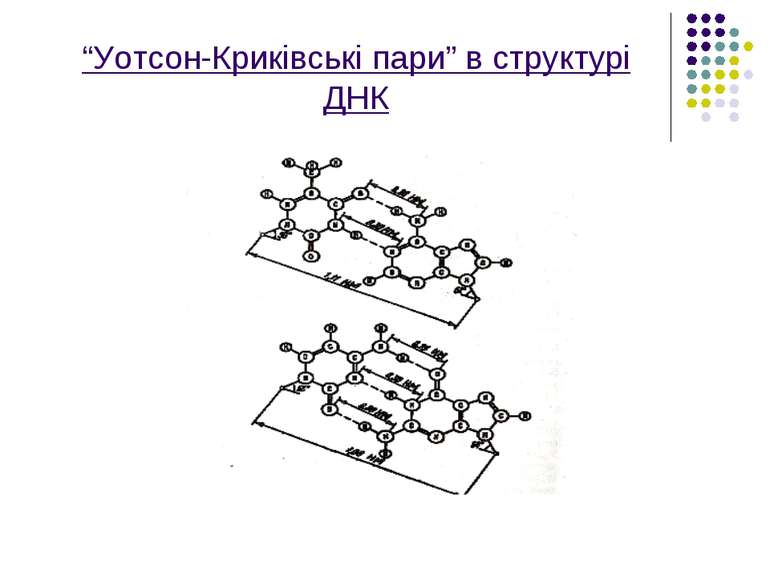
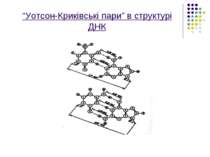
Вторинна структура нуклеїнових кислот(зокрема ДНК) пов’язана,як вже згадувалося,з наявністю подвійної спіралі,яка складається з двох полінуклеотидних ланцюгів.У цих взаємно перевитих спіральних ланцюгах пуринової азотистої основи одного ланцюга з’єднані водневими зв’язками з відповідними піримідиновими азотистими основами другого ланцюга.
З’єднання азотистих основ відбувається за таким правилом Чаргаффа: незважаючи на те ,що кількість азотистих основ А,Г,Т,Ц може змінюватися досить в широких межах від виду до виду,але завжди кількість пуринових основ в точності дорівнює кількості піримідинових основ.Точніше кажучи ,аденін і гуанін в одному ланцюгу пов’язані у строгій відповідності з тиміном і цитозином в другому ланцюгу,утворюючи так звані “уотсон-криківські пари”АТ і ГЦ.
Третинна структура Під третинною структурою білків і нуклеїнових кислот, звичайно,розуміють спосіб просторової укладки поліпептидних і полінуклеотидних ланцюгів в 3-вимірному об’ємі.
Уперше третинна структура білкової молекули була визначена Дж.Кендрю для міоглобіна кита-кашалота. Цей білок,що містить в собі 153 амінокислотних залишків,відповідає за перенос кисню в м’язах. Виявилося,що третинна структура поліпептидного ланцюга міоглобіну має вигляд скрученої трубки,що досить щільно укладена навколо гема. Це можна побачити на малюнку.
Що стосується нуклеїнових кислот,то зараз досить багато відомо щодо третинної структури певних типів ДНК та РНК.На цьому малюнку просторове впорядкування ДНК в еукаріотичних клітинах.Видно,що основний елемент третинної структури утворений своєрідним”соленоїдом”,який складається з трьох великих витків,що мають діамет близько 30нм.
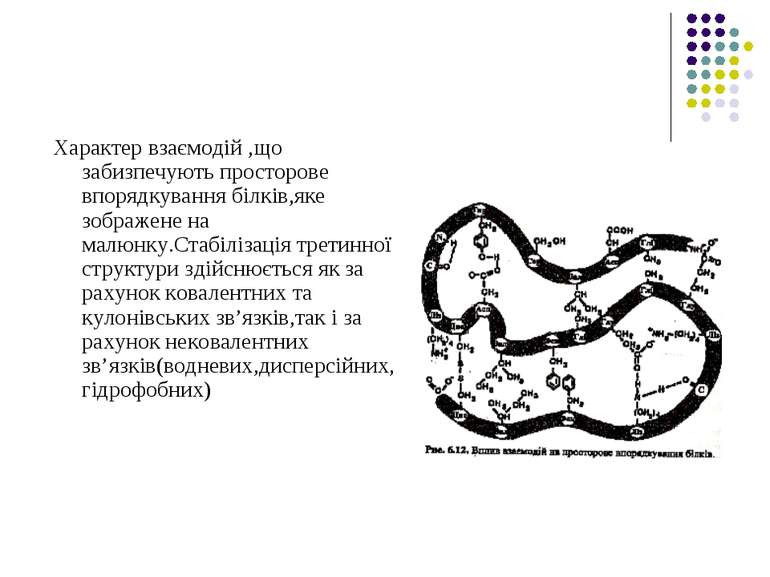
Характер взаємодій ,що забизпечують просторове впорядкування білків,яке зображене на малюнку.Стабілізація третинної структури здійснюється як за рахунок ковалентних та кулонівських зв’язків,так і за рахунок нековалентних зв’язків(водневих,дисперсійних,гідрофобних)
Четвертинна структура Окремі поліпептидні ланцюги,що входять до складу молекули та характеризуються певними первинною,вторинною,і третинною структурами,можуть мати досить слабкі (нековалентні) зв’язки між собою.
Просторове впорядкування протомерів в мультимер називається четвертинною сполукою. Звичайно при утворенні четвертинної структури відбувається асоціація парної кількості протомерів(2 або 4,рідше6,8,10,12 тощо)Класичним прикладом білкової молекули,якій притаманна четвертинна структура,є молекулою гемоглобіна,що складається з чотирьох субодиниць(функціонально активних частин білкового мультимера).
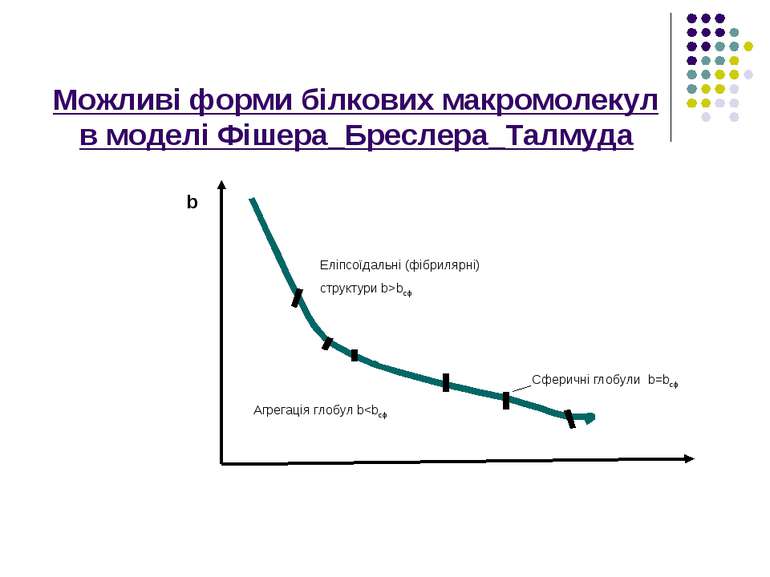
Розглянемо досить просту і водночас дуже корисну модель Фішера-Бреслера-Талмуда, яка дає змогу передбачати форму білкової макромолекули залежно від відношення гідрофільних і гідрофобних груп,що входять до її складу. спочатку знайдемо те співвідношення,виконання якого гарантує сферичну глобулярну структуру білкової молекули.Нехай радіус сферичної глобули-R,радіус внутрішнього гдрофобного ядра-r,товщина гідрофільного шару-h.
Можливі форми білкових макромолекул в моделі Фішера_Бреслера_Талмуда b Еліпсоїдальні (фібрилярні) cтруктури b>bcф Агрегація глобул b
Типовим проявом подібного механізму утворення четвертинної структури є молекула гемоглобіну,що складається з чотирьох глобул,саме завдяки гідрофобним взаємодіям.Під час об’єднання глобул і утврюється так звана четвертинна структура.
Біологічні мембрани Біологічні мембрани - тонкі напівпроникні оболонки, що відокремлюють клітину від зовнішнього середовища і функціональні одиниці клітини одну від одної.
Структура клітини та її функціональних одиниць ГлЕР – гладенький ендоплазматичний ретикулюм; ГрЕР – гранульований ендоплазматичний ретикулюм; ЕПС – ендоплазматична сітка; Ліз – лізосома; Ліп – ліпосома; М – мітохондрія; Мв – мікроворсинки; Мт – мікротрубочки; ПМ – плазматична мембрана; Риб – рибосоми; СГ – система Гольджі; Хр – хромосоми; Ц – центріоль; Я – ядро; Я – ядречко;
Схематичне зображення молекули фосфоліпіду Головним матеріалом біомембран виступають амфіфільні (амфіпатичні) молекули фосфоліпідів – сполук з гідрофобним хвостом і гідрофільною голівкою.
До складу полярної голівки, що становить приблизно одну чверть всієї довжини молекули, входить гліцерин, фосфорна кислота і полярне сполучення, характерне для кожного класу фосфоліпідів (холін, серин та інші). Гідрофобний хвіст, що становить три чверті довжини молекули фосфоліпіду, складається із залишків жирних кислот, одна з яких насичена, а інша ненасичена, з подвійними вуглецевими зв'язками.
Самозбірка ліпідів у водному розчині Молекули ліпідів здатні самодовільно об'єднуватись, утворюючи у воді протяжні бішарові структури, котрі намагаються замкнутися самі на собі, ховаючи гідрофобні ділянки від води. У результаті утворюютсья везикули (ліпосоми). Процес цей називають самозбіркою.
Фосфоліпідний бішар виконує функцію матриці для білків, гліколіпідів, глікопротеїдів, відіграючи водночас роль бар'єра для іонів та молекул водорозчинних речовин .
Внаслідок перекисного окислення одного з жирнокислотних ланцюгів або його відщеплення під дією ферменту фосфоліпази, може утворюватись фосфоліпід з розміром голівки, що перевищує розмір гідрофобної частини. Такі дефектні молекули утворюють не бішар, а міцелярні структури.
Загальна схема будови біологічної мембрани Білки мембран можуть знаходитись на поверхні ліпідного бішару (периферичні білки, ПБ), утримуючись переважно електростатичними силами або вбудовуватись до ліпідного бішару, іноді пронизуючи його наскрізь (інтегровані білки, ІБ). Інтегральні білки, опинившись поряд можуть утворювати білковий канал (БК).
Рідкі кристали Рідкі кристали - це особливий стан деяких речовин, переважно органічних, якому притаманна плинність (як рідини), але молекули при цьому зберігають впорядкованість у розташуванні, що спонукає до анізотропії ряду фізичних властивостей (як у кристалів).
Бішар - це рідка структура, в якій молекули ліпідів здатні здійснювати сегментальну рухливість, обертальні рухи і латеральну дифузію, що являє собою послідовний обмін місцями у межах одного шару.
Оцінка частоти перескоків v і характерних відстаней таких перескоків при латеральній дифузії Час перескоку оцінюється за формулою t=S/D, де S - площа, яку займає одна фосфоліпідна молекула, D - коефіцієнт латеральної дифузії Згідно з цією формулою: а частота перескоків:
Середню відстань при перескоці оцінимо за формулою Тоді за рахунок латеральної дифузії молекула ліпіду пройде за час t=1с відстань мкм, тобто досить велику відстань. Такий розбір має бактерія типу E.coli.
Перехід молекул на інший бік бішару (перехід “flip-flop”). Цей перехід відбувається зі швидкістю одна молекула за декілька годин. Білки в ліпідному бішарі також досить рухливі. Період обертального руху білка становить Латеральна рухливість білка визначається не тільки його властивостями, але й мікров'язкістю ліпідного оточення, тобто фазовим станом ліпідного бішару.
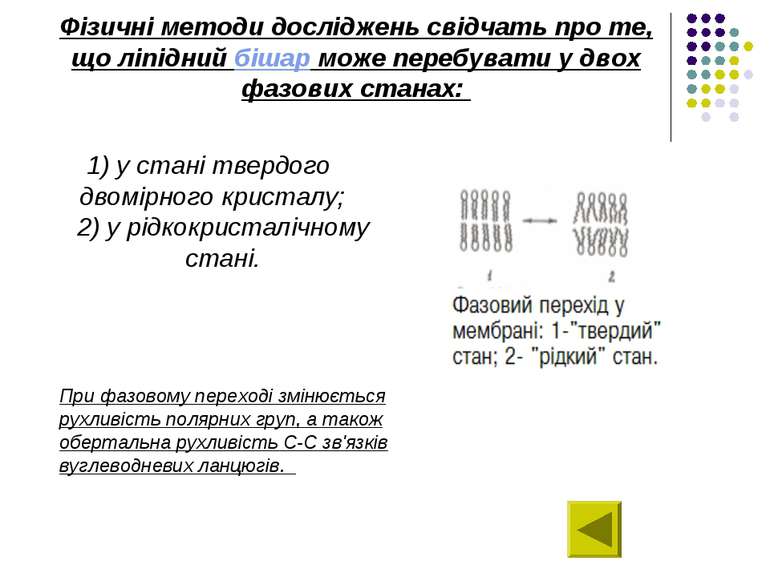
Фізичні методи досліджень свідчать про те, що ліпідний бішар може перебувати у двох фазових станах: 1) у стані твердого двомірного кристалу; 2) у рідкокристалічному стані. При фазовому переході змінюється рухливість полярних груп, а також обертальна рухливість С-С зв'язків вуглеводневих ланцюгів.
Якщо мембрана знаходиться у твердій фазі, то в ній існують ліпіди лише у стані трансконформерів.
У фазі з'являються транс-гош-переходи. Після плавлення бішар становить динамічну суміш транс- та гош-конформерів. Гош-конформери, розташовані поряд, утворюють порожнини в бішарі чи так звані “кінки”. Синхронні транс-гош переходи можуть бути представлені як рух “кінків” вздовж вуглеводневих ланцюгів.
Вся поверхня мембрани клітин має різні властивості. За ліпідним складом, включенням білків мембрани є гетерогенними. Це означає, що у мембранах спостерігаються дільниці з різною рухливістю: рідкі фази; більш структуровані фази.
Кооперативна реакція типу фазового переходу – важлива властивість ліпідів, бо саме на ній базуються механізми відбирання іонів із середовища, посилення зовнішнього сигналу, мембранної пам'яті клітини.
Основу сучасних уявлень про будову мембрани складає рідкокристалічна концепція, створена у 1972 році С.Сингером та Дж. Нікольсеном і вдосконалена у 1981 році С.Сингером.
Вивчення структури і функцій біологічних мембран – сучасна область біофізики, яка має надзвичайно важливе значення для теоретичної і клінічної медицини.
Порушення структури і бар'єрної функції мембран призводить до багатьох патологій, ракового переродження тканин, тканинної гіпоксії, пошкоджень, що виникають при інтоксикаціях, під впливом іонізуючої радіації тощо.
Контрольні питання Що таке біологічні мембрани? Яку роль вони відіграють в складі клітини? Опишіть структуру клітини та назвіть її основні функціональні одиниці. Що таке амфіфільні (амфіпатичні) молекули фосфоліпідів? Яку функцію вони виконують для біомембран? З яких компонентів складається молекула фосфоліпіду? Що таке везикули (ліпосоми)? Як вони утворюються?
Які функції в біологічних мембранах виконує фосфоліпідний бішар? Внаслідок чого молекули утворюють міцелярні структури? Опишіть загальну схему будови біологічної мембрани. Що таке рідкі кристали? Що таке бішар? За якою формулою визначається частота перескоків фосфоліпідних молекул при латеральній дифузії?
За якою формулою можна визначити час перескоку фосфоліпідних молекул при латеральній дифузії? Як можна визначити середню відстань перескоку фосфоліпідних молекул? Що таке перехід “flip-flop”? В яких фазових станах може перебувати ліпідний бішар? Які властивості має поверхня мембран клітин? Під впливом яких основних факторів може відбуватись розділ фаз? На якій властивості ліпідів базуються механізми відбирання іонів із середовища?
Назвіть які фізичні характеристики мають біологічні мембрани? Що вивчає біофізика? Назвіть хвороби, які виникають при порушенні структури і бар’єрної функції мембран.
Розділ 6.4. Пасивний та активний транспорт речовин крізь мембранні структури клітин ( ст. 41-53)
У нормально функціонуючих клітинах присутні сотні різних молекул та іонів у концентраціях, значно менших або значно більших, ніж у навколишньому середовищі. Так, наприклад, концентрація іонів калію у клітині людини у десятки разів перевищує їх концентрацію в крові. Для іонів натрію співвідношення таких концентрацій обернене. Таким чином, існує певна вибірковість у розподілі цих іонів між клітиною і міжклітинним середовищем. Однією з основних функцій біологічних мембран є забезпечення вибіркової (селективної) проникності для речовин, що транспортуються у процесі життєдіяльності із клітини у середовище та з середовища у клітину.
Розрізняють пасивний і активний перенос (транспорт) молекул та іонів крізь мембрани Пасивний транспорт здійснюється за допомогою дифузії, що зумовлена різницею концентрацій у разі незаряджених молекул і різницею електрохімічних потенціалів для іонів. Дифузія – це самодовільний процес проникнення молекул речовини з області з більшою концентрацією в область з меншою її концентрацією.
Деякі молекули (іони) примусово накачуються в клітини або викачуються з клітин у напрямі збільшення концентрації (електрохімічного потенціалу). Таке переміщення молекул (іонів) називають активним транспортом. Активний транспорт здійснюється під час витрати хімічної енергії, що виділяється при гідролізі АТФ чи переносі електронів по дихальному ланцюгу мітохондрій.
6.4.1. Пасивний транспорт незаряджених молекул Математичний опис процесу дифузії було дано Фіком. Згідно з рівнянням Фіка потік Ф дифундуючої речовини визначається таким виразом: Ф = -Ddc/ dx. (6.11) Вираз (6.11) – це закон Фіка для вільної дифузії, де Ф = 1/ S * dN / dt – кількість частинок речовини (молекул), що перетинають одиничну площину за одиницю часу; D - коефіцієнт дифузії; dc/ dx – градієнт концентрації дифундуючої речовини. Для газів і розбавлених розчинів коефіцієнт дифузії може бути визначений за формулою D= V * λ / 3, де V – середня швидкість руху молекул; λ – середня довжина вільного пробігу молекул. Знак «-» вказує на те, що потік речовини Ф напрямлений в бік зменшення її концентрації (рис.6.23).
Розглянемо пасивний транспорт незаряджених молекул крізь мембрану. Розподіл концентрацій молекул дифундуючої речовини при переході через мембрану показано на рис. 6.24, де використані такі позначення: се, сі – концентрації дифундуючих частинок у водному середовищі зовні і в клітині; сме і смі - концентрації частинок у самій мембрані біля зовнішньої і внутрішньої її поверхонь.
З рис. 6.24 видно, що концентрація зовні клітини се перевищує концентрацію у клітині сі, а в самій мембрані змінюється за лінійним законом, тобто градієнт концентрації dc/dx = const і становить: dc/dx = - ( сме – смі)/ L, (6.12) де L – товщина мембрани. Це є, звичайно, припущенням. Концентрація частинок на поверхнях мембрани зазнає стрибок внаслідок різної розчинності речовини у водній фазі і пристінному шарі всередині мембрани. Звичайно існує пропорційний зв’язок: сме/ се = смі /сі = К, (6.13) де К - коефіцієнт розподілу речовини між мембраною та водною фазою. Рис. 6.23. Співвідношення напрямків градієнта концентрації та потоку дифундуючої речовини Рис. 6.24. Розподіл концентрації при пасивному транспорті незаряджених молекул через мембрану
Концентрація частинок на поверхнях мембрани зазнає стрибок внаслідок різної розчинності речовини у водній фазі і пристінному шарі всередині мембрани. Звичайно існує пропорційний зв’язок: сме/ се = смі /сі = К, (6.13) де К - коефіцієнт розподілу речовини між мембраною та водною фазою.
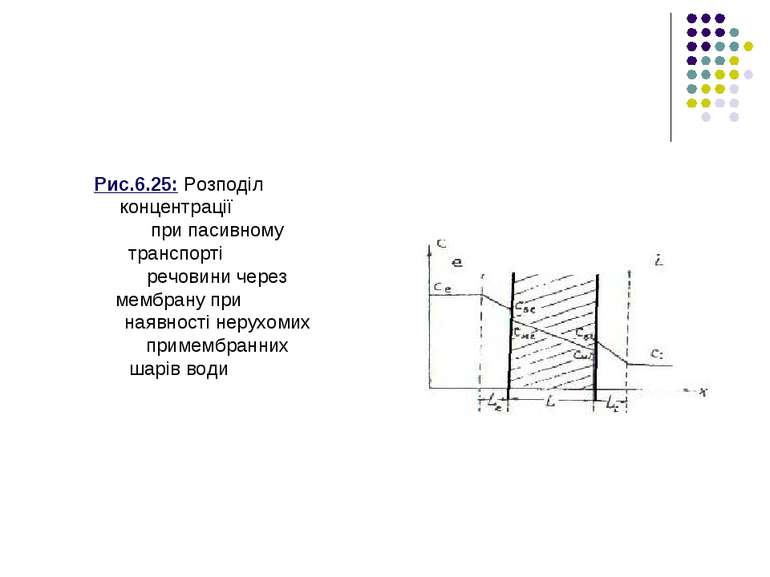
Рівняння (6.11) з урахуванням (6.12) і (6.13) набуває вигляду де Р = D*K/L - коефіцієнт проникності мембрани. Таким чином, рівняння Ф = P (cе-сІ) описує пасивний транспорт незаряджених молекул крізь мембрану. Під час руху речовини крізь мембрану, частинки змушені долати не лише гідрофобний шар ліпідів, а й нерухомі шари води, що прилягають до мембрани (примембранні шари). Нехай речовина рухається всередину клітини з водного розчину з концентрацією с е до водного розчину з концентрацією сі. При цьому частинки повинні долати три дифузійні бар’єри: зовнішній примембранний шар води, саму мембрану і внутрішній примембранний шар води (рис. 6.25).
Рис.6.25: Розподіл концентрації при пасивному транспорті речовини через мембрану при наявності нерухомих примембранних шарів води
Потоки через кожний з перелічених шарів: Фе = Ре (се – све ); Фм = Рм (све – сві ); (6.15) Фі = Рі (с ві - сі ), де Ре, Рмі, рі – коефіцієнти проникності відповідних бар’єрів. Поділимо рівняння (6.15) для потоків Фе, Фме, Фі на відповідні коефіцієнти проникності і додамо праві і ліві частини, що дає (6.16) У стаціонарному стані не відбувається накопичення речовини, тобто с = f (t), а тому всі потоки рівні між собою: Фе = Фм = Фі = Ф. З іншого боку, для всієї системи в цілому Ф = Р (се – сі ), (6.17) де Р – коефіцієнт проникності всієї системи. З рівняння (6.17) маємо (6.18)
Тоді з рівнянь (6.16) і (6.18) випливає, що Величина 1/Р – опір потоку речовини, що дорівнює сумі опорів складових шарів. Опір примембранних шарів пропорційний до товщини цих шарів, оскільки де К = 1 для водних шарів; Dі - коефіцієнт дифузії речовини у воді. Таким чином, проникність мембрани залежить від руху протоплазми у міжклітинному середовищі і всередині клітини, який спричиняє перемішування рідини і зменшення товщини примембранних нерухомих шарів. Пригнічування процесів життєдіяльності клітин призводить до збільшення опору і, як наслідок, до гальмування процесів пасивного переносу речовин крізь мембранні системи.
6.4.2. Пасивний транспорт іонів У відсутності градієнта концентрації перенос заряджених частинок (іонів) може відбуватися при наявності електричного поля, тобто градієнта електричного потенціалу. Густина електричного струму іонів за законом Ома: де γ – коефіцієнт електропровідності середовища. Як відомо, густина електричного струму де с- кількість носіїв заряду (іонів) в одиниці об’єму середовища; v – швидкість, з якою рухаються носії (іони) під впливом електричного поля; q – заряд носія (іона). j = γ E = -γ j = qcv
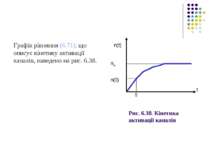
Процес простої (або звичайної) дифузії відбувається повільно і слабо контролюється клітиною. За таким механізмом здійснюється транспорт кисню, вуглекислого газу та шкідливих для клітини речовин (наприклад, ядів). При звичайній дифузії молекула дифундуючої речовини рухається крізь мембрану без утворення комплексів з іншими молекулами. Для більш швидкого переносу речовин, необхідних для життєдіяльності клітин, в ході еволюції виробились інші типи пасивної дифузії: перенос через канали (пори) і перенос за допомогою переносників. Ці типи дифузії відомі під назвою полегшеної дифузії. Рис. 6.26. Види пасивного і активного транспорту через мембрану: 1 - проста дифузія через мембрану; 2 - дифузія через канали; 3 – дифузія за допомогою переносників; 4 – активний транспорт. Розглянемо більш детально пасивний транспорт речовин крізь канали. Канали – це білкові утворення, що мають діаметр 6-10 А (1 А (ангстрем) = = 10-10м). Згідно з деякими даними білкові канали покривають ~ 0.1%поверхні мембрани. Слід підкреслити, що канали – не статичні, а
Один з механізмів їх утворення – процес латеральної дифузії. Коефіцієнт проникності мембрани при пасивному транспорті через канали де n – кількість каналів на одиницю площі мембрани; r – радіус каналу; L – довжина каналу (товщина мембрани); D – коефіцієнт дифузії речовини у воді. Згідно з гіпотезою Мулінза найкраще проходять крізь канали ті іони, радіус яких в оточенні одного шару молекул води близький до радіуса каналу.
Швидкість пасивного транспорту крізь мембрани збільшується на кілька порядків у присутності переносників – молекул, що володіють дуже високим рівнем селективності. Наприклад, переносник який полегшує транспорт глюкози крізь мембрану, ніяк не впливає на транспорт амінокислот. Найбільш детально полегшений транспорт крізь біологічні мембрани було вивчено на прикладі переносу іонів іонофорними антибіотиками типу ваніломіцину.
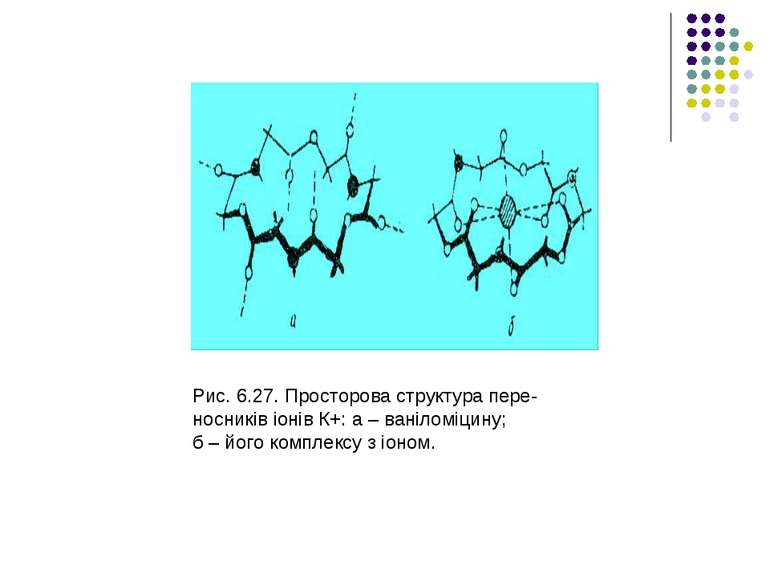
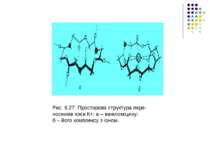
Перенос іонів антибіотиками типу ваніломіцину Було встановлено, що ваніломіцин вибірково збільшує проникність мембран для іонів К+. Шість карбонільних груп ваніломіцину формують порожнину, в яку потрапляє іон К+. У вільній молекулі ваніломіцину атоми складноефірних карбонільних груп спрямовані до зовнішньої поверхні молекули. При утворенні комплексу з іонами К+ у молекулі виникають додаткові іон – дипольні взаємодії з атомами кисню карбонільних груп. Молекула набуває форми браслета діаметром близько 8 А, у центрі якого розташовуються іон К+. На рис. 6.27 показано конформаційну зміну молекули ваніломіцину при створенні комплексу з іоном К+. Іони Na+ надто великі для порожнини у молекулі ваніломіцину, внаслідок чого різниця у проникностях для іонів К+ і Na+ становить РK/ РNa = 104. Таким чином, основою селективності при переносі іонів за допомогою переносників, так само, як і при переносі через канали, є принцип структурної відповідності.
Рис. 6.27. Просторова структура пере- носників іонів К+: а – ваніломіцину; б – його комплексу з іоном.
Транспорт за допомогою переносників може відбуватись внаслідок дифузії переносника разом з речовиною (рухомий переносник) ,а також і шляхом естафетної передачі від однієї молекули переносника до іншої
Для пасивного транспорту за допомогою переносників характерний ефект концентраційного насичення швидкості переносу: зі збільшенням концентрації швидкість переносу сповільнюється, тому що всі переносники виявляються пов’язаними з певною частиною іонів.
6.4.3. Активний транспорт Поряд з пасивним транспортом у життєдіяльності клітини важливу роль відіграє активний транспорт – примусовий перенос молекул ті іонів з області малих концентрацій до області високих концентрацій. Завдяки активному транспорту підтримуються концентраційні градієнти, які необхідні для нормального функціонування клітини. Транспортні системи, які створюють необхідні концентраційні градієнти, називають насосами, або АТФазами. Відомо 4 основні системи активного транспорту: 1. Na+ - K+ - насос 2. Са2+ - насос 3. Н+ - насос 4. Перенос протонів під час роботи дихального ланцюга мітохондрій. Активний транспорт, як і пасивний, забезпечується спеціальними структурами: каналами, переносниками, ферментами. При активному транспорті (на відміну від пасивного) вектор переміщення іонів співпадає за напрямком з вектором концентраційного градієнта, тобто з напрямком збільшення концентрації. Активний транспорт відбувається з рахунок енергії, що виділяється при гідролізі АТФ (комплексу Mg – АТФ2-) з утворенням молекул АДФ і неорганічного фосфату (Фн).
Гідроліз АТФ здійснюється ферментом АТФазою. Джерелом молекул АТФ є процеси окислювального фосфорилювання, що відбуваються в мітохондріях. Розглянемо основні етапи найбільш дослідженого Na+ та К+ - насоса (рис.6.29). Як відомо, в нормально функціонуючій клітині концентрація іонів К+ перевищує їх концентрацію в міжклітинному середовищі, а для іонів Na+ це співвідношення обернене. Наприклад, у нервовому волокні кальмара [K+]e = 0.010 моль/л, [K+]i = 0.340 моль/л; [Na+]e = 0.463 моль/л, [Na+]i =0.049 моль/л; [K+]i >[K+]e, [Na+]i
Na+ - K+ - АТФаза локалізована у зовнішніх плазматичних мембранах клітин. Через те, що Na+ - K+ - АТФаза є гідрофобним білком, вона створює комплекси з ліпідами бішару. Саме тому активність інтегрального білка Na+ - K+ - АТФази залежить від фізико – хімічного стану мембрани. Встановлено, що для функціонування Са2+ - АТФази важливо, щоб ліпідне оточення було рідким, на відміну від Na+ - K+ - АТФази, для якої важлива впорядкованість бішару. Перенос 2 іонів К+ всередину клітини і трьох іонів Na+ зовні спричиняє перенос одного позитивного заряду із цитоплазми в навколишнє середовище. Внаслідок цього всередині клітини виникає негативний електричний потенціал. Тому К+ - Na+ - насос називають електрогенним.
Основні етапи роботи Na+ -K+ - насосa. (Блакитні кільця–АТФаза) На першому етапі відбувається приєднання до АТФази трьох іонів Na+іфосфорилювання ферменту. На другому етапі – перенос центрів зв’язування Na+ зовні (транслокація 1) На третьому етапі - відокремлення трьох іонів Na+і заміна їх двома іонами К+ На четвертому етапі – відщеплення залишків фосфорної кислоти На п’ятому етапі – перенос центрів зв’язування іонів К+ всередину клітини (транслокація 2) На шостому етапі – фосфорилювання ферменту 2К+ 3Na+ 2K+ 3Na+ 3Na+ АТФ і е 3Na+ 2K+ Фн Фн Рис. 6.29
Контрольні запитання 1. Яка основна функція біологічних мембран? 2. Закон Фіка для вільної дифузії. 3. Формула, що описує густину електричного струму іонів за законом Ома. 4. Електродифузійне рівняння Нернста – Планка. 5. Яка формула описує електрохімічний потенціал μ? Який його фізичний зміст? 6. Що є основою селективності при переносі іонів за допомогою переносників і при переносі через канали? 7. Які основні етапи роботи Na+ -K+ - насосa?
Генерація і поширення електричних потенціалів – найважливіше явище в живих клітинах і тканинах, яке лежить в основі збудження клітин, регуляції внутрішньо-клітинних процесів, м’язового скорочення, роботи нервової системи. Порушення електричних характеристик окремих клітин, нервових волокон, тканин призводить до захворювання.
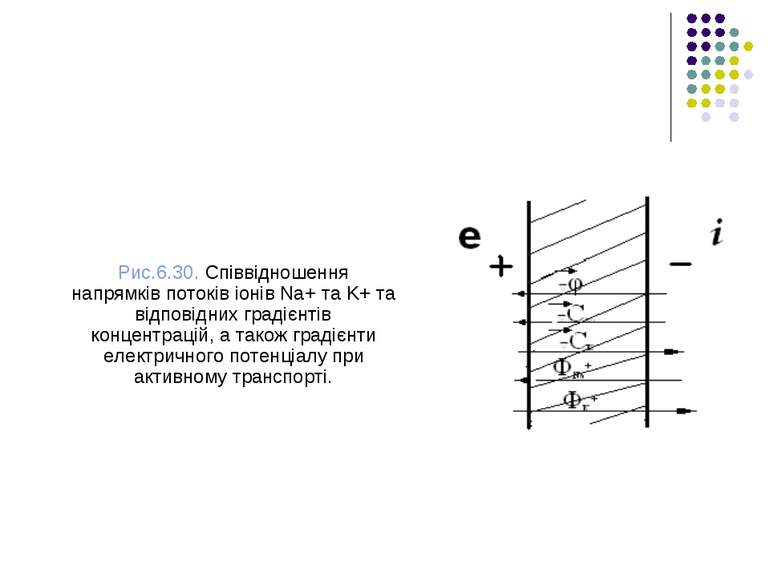
Різниця потенціалів між водними фазами по обидва боки мембрани (або мембранний потенціал) виникає внаслідок переносу, тобто процесів пасивного і активного транспорту.
Рис.6.30. Співвідношення напрямків потоків іонів Na+ тa K+ та відповідних градієнтів концентрацій, а також градієнти електричного потенціалу при активному транспорті.
Потенціал спокою – різниця потенціалів між цитоплазмою і навколишнім середовищем у нормально функціонуючій не збудженій клітині, що зумовлена відміною у концентраціях іонів по Потенціал дії – різниця потенціалів, що виникає при збуджені клітини і зумовлена зміною проникності у мембрани для іонів.
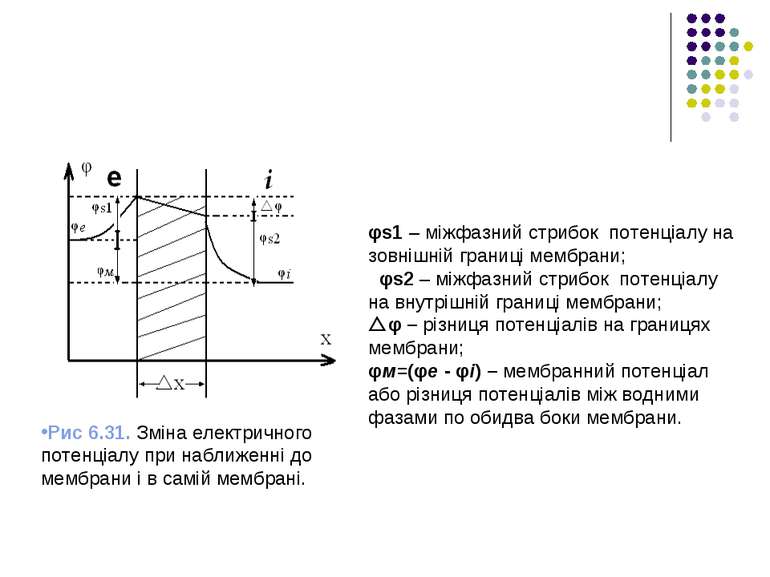
Загальна картина розподілу потенціалів на межах мембрани з водними фазами (внутрішньоклітинній і позаклітинній) подана на рис.6.31. З цього рисунка випливає існування чотирьох характерних різниць потенціалів:
Рис 6.31. Зміна електричного потенціалу при наближенні до мембрани і в самій мембрані. φs1 – міжфазний стрибок потенціалу на зовнішній границі мембрани; φs2 – міжфазний стрибок потенціалу на внутрішній границі мембрани; φ – різниця потенціалів на границях мембрани; φм=(φе - φі) – мембранний потенціал або різниця потенціалів між водними фазами по обидва боки мембрани.
При цьому φм + φs1 = φ + φs2 . Для симетричної мембрани φs1 = φs2 , тоді φм = φ , тобто φе – φі = φ .
Міжфазні стрибки потенціалу (φs1, φs2) зумовлені поверхневим зарядом, що його створюють “голівки” фосфоліпідів, та здатність мембрани пов’язувати іони з навколишньою водною фазою. Спадає потенціал за таким законом: φ = φ0е-х/δ, де δ – радіус Дебая, що дорівнює тій відстані від границі мембрани, на якій потенціал змешується в е разів. Радіус Дебая залежить від концентрації іонів у водній фазі і складає приблизно 0,8нм, тобто 10% від товщини мембрани.
Мембрана за своїми електричними властивостями подібна до конденсатора. Потенціал змінюється всередині мембрани приблизно за лінійним законом, тобто напруженість поля є майже сталою величиною:
Розглянемо мембрану, проникну для певних іонів (скажімо, іонів K+). Як випливає з формули (6.30), рушійною силою пасивного транспорту іонів крізь мембрану є градієнт електрохімічного потенціалу. Дифузія крізь мембрану певних іонів буде продовжуватись доти, доки величина обернеться в нуль, тобто електорохімічні потенціали по обидва боки мембрани стануть рівними між собою: (6.31)
При цьому на мембрані виникає різниця електричних потенціалів, яка перешкоджатиме подальшому рухові іонів. Встановиться рівновага, струм іонів крізь мембрану припиниться (j=0). З умови (6.31) знайдемо такий вираз для рівноважної різниці потенціалів: (6.32)
Оскільки хімічний потенціал розчинника залишається незмінним , то з рівняння (6.32) отримаємо шукану формулу: (6.33)
Це і є рівноважний потенціал Нернста. Зауважимо, що при рівності концентрацій цей потенціал стає рівним нулеві, саме тому рівноважний потенціал ще називають концентраційним потенціалом Нернста.
У 1902 році Дж. Бернштейн висунув гіпотезу, згідно з якою потенціал спокою зумовлений проникністю цитоплазматичної мембрани лише для іонів K+ , внаслідок чого виникає потенціал, що описується таким рівнянням Нернста: (6.36)
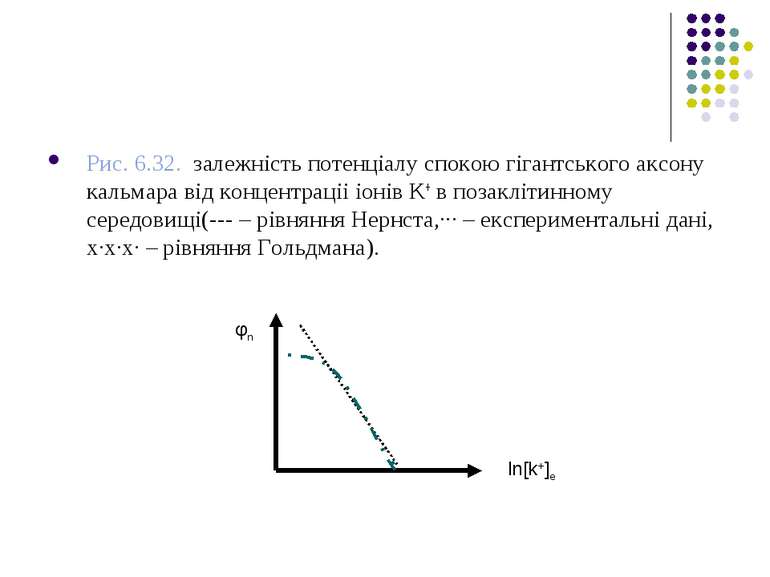
На рис. 6.32 подані графіки φм=f[K+]е, побудовані за експериментальними даними, а також розраховані за рівнянням (6.36). Розходження між розрахованими за рівнянням Нернста і експериментальними даними при малих значеннях [K+]е свідчать про недосконалість калієвої теорії потенціалу спокою.
Рис. 6.32. залежність потенціалу спокою гігантського аксону кальмара від концентраціі іонів K+ в позаклітинному середовищі(--- – рівняння Нернста,··· – експериментальні дані, х·х·х· – рівняння Гольдмана). φn ln[k+]e
Порівнюючи вираз (6.37) з рівнянням Нернста-Планка, одержимо рівняння для швидкості іонів (6.38)
Нехай швидкості руху негативних і позитивних іонів зрівнялися, тобто v+=v-. У результаті маємо (6.41) або (6.42)
Враховуючи співвідношення Ейнштейна між коефіцієнтами дифузії та рухливості остаточно маємо (6.43)
Таким чином, дифузійний мембранний потенціал зумовлений різними значеннями рухливості (b+≠b-) та концентрації (се≠сі ) для дифундуючих крізь мембрану іонів.
У відсутності одного з іонів формула (6.43) для дифузійного потенціалу перетворюється в формулу (6.33) для рівноважного потенціалу Нернста. Крім того, при рівності рухливостей (так само, як і при рівності концентрацій) дифузійний потенціал стає рівним нулеві.
Якщо всередині і зовні клітини знаходяться іони протилежних знаків, то умова рівноваги між водними фазами по обидва боки мембрани зводиться до умови електронейтральності середовищ, що означає:
Розглянемо випадок, коли всередині і зовні клітини ми маємо іони двох типів, що несуть протилежні заряди, скажімо іони K+ і Cl-. Умова електронейтральності для цього випадку матиме вигляд (6.44) Звідки (6.45)
Коефіцієнт r називають відношенням Доннана. Зрівняння (6.48) маємо (6.49) Умова доннанівської рівноваги.
Тепер врахуємо, що у внутрішньоклітинному середовищі присутні в певних концентраціях аніони білкового походження [Р-], для яких мембрана майже непроникна.
Умови електронейтральності у внутрішньоклітинному і позаклітинному середовищах відповідно матимуть вигляд (6.50) (6.51) де n – кількість зарядів на кожній білковій молекулі.
Використовуючи безрозмірний потенціал Нернста (6.35), відношення Доннана (6.48) можна подати у вигляді (6.52)
Враховуючи (6.53), умова електронейтральності у внутрішньоклітинному середовищі (6.50) матиме такий вигляд: (6.54) або (6.55)
Розкладаючи функції еψ та е-ψ в ряди і обмежуючись першими двома членами цих розкладів, маємо або, враховуючи (6.34), (6.56)
Таким чином, доннанівський потенціал прямопропорційний концентрації заряджених макромолекул всередині клітини і обернено пропорційний концентрації електроліту в позаклітинному середовищі.
Розбіжності між експериментальними значеннями потенціалу спокою на мембрані і розрахованими за рівнянням Нернста для рівноважного потенціалу (див. рис. 6.32) пов’язані насамперед з тим, що мембрана проникна лише для іонів К+, а й для інших іонів.
У теорії стаціонарного потенціалу розвиненої Д. Гольдманом, А. Ходжкіним і Б. Катцевим, враховувалися внески в сумарний потік лише одновалентних іонів натрію, калію і хлору.
Розраховуючи мембранний потенціал, що виникає за цих умов, автори виходили з таких положень: 1) здійснюється умова стаціонарності
3) потік кожного сорту іонів підпорядковується рівнянню Нернста-Планка (6.57) де i – індекс сорту іонів, i= Na+, K+, Cl-.
Інтегрування рівнянь (6.57) з урахуванням умови стаціонарності ФNa+ФK-ФCl=0 дає змогу одержати такий вираз для мембранного потенціалу: (6.58) де РNa, РK, РCl, - проникності мембрани для відповідних іонів. Це і є формула для стаціонарного потенціалу Гольдмана-Ходжкіна-Катца, яку ще називають рівнянням Гольдмана.
Вираз для стаціонарного мембранного потенціалу можна одержати, використовуючи безрозмірний мембранний потенціал
Для цього дещо перетворимо рівняння Нернста-Планка, використавши умову сталості градієнта потенціала в мембрані де L – товщина мембрани, а саме: звідки або (6.59)
Оскільки сім=Ксі, сем=Ксе, то рівняння (6.60) набуває вигляду або (6.61) де P=DK/L – проникність мембрани.
Враховуючи внесок потоку іонів Cl-, одержимо з (6.64) вираз (6.58): тобто шукану формулу для стаціонарного потенціалу.
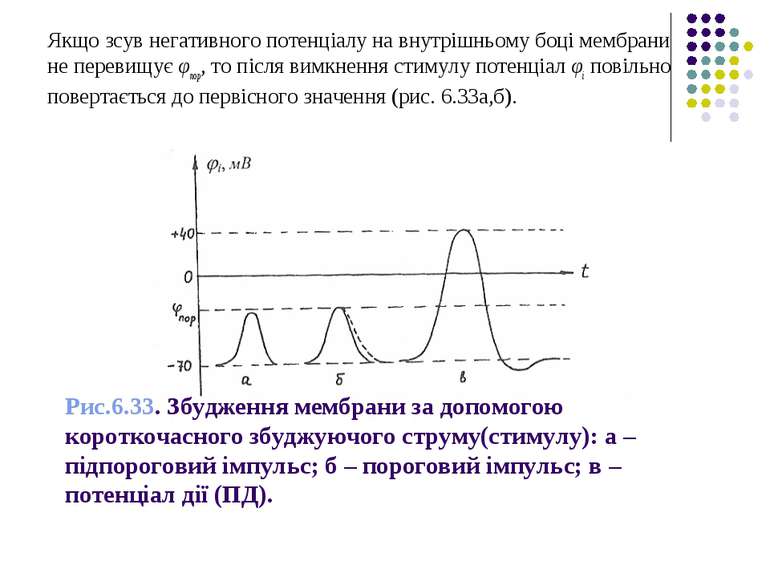
Для виникнення потенціалу дії (ПД), необхідно викликати локальний зсув потенціалу φі, на внутрішній поверхні мембрани до значення, яке перевищувало б значення, що називається пороговим (тобто φі>φпор).
Рис.6.33. Збудження мембрани за допомогою короткочасного збуджуючого струму(стимулу): а – підпороговий імпульс; б – пороговий імпульс; в – потенціал дії (ПД). Якщо зсув негативного потенціалу на внутрішньому боці мембрани не перевищує φпор, то після вимкнення стимулу потенціал φі повільно повертається до первісного значення (рис. 6.33а,б).
Якщо ж зсув φі перевищив φпор, то виникне подальше спонтанне зростання φі і після припинення стимулу. При цьому значення φі досягає нуля і продовжує швидко мінятися у додатному напрямку (рис. 6.33в). Таким чином, виникає обернення знака φі (деполяризація мембрани).
Виникнення потенціалу дії спричинене різким збільшенням проникності мембрани для іонів Na+, що виникає за умови зростання потенціалу φі вище φпор.
Іони Na+, входячи всередину клітини, призводять до ще більшого зростання потенціалу φі на внутрішньому боці мембрани, що викликає, в свою чергу, подальше зростання проникності мембрани для іонів Na+ і, як наслідок, - зростання їх проникнення всередину клітини.
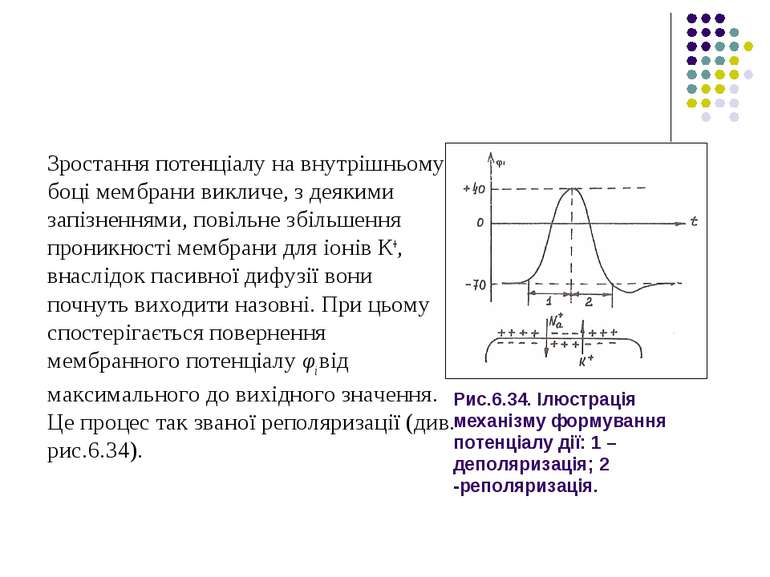
Рис.6.34. Ілюстрація механізму формування потенціалу дії: 1 – деполяризація; 2 -реполяризація. Зростання потенціалу на внутрішньому боці мембрани викличе, з деякими запізненнями, повільне збільшення проникності мембрани для іонів К+, внаслідок пасивної дифузії вони почнуть виходити назовні. При цьому спостерігається повернення мембранного потенціалу φі від максимального до вихідного значення. Це процес так званої реполяризації (див. рис.6.34).
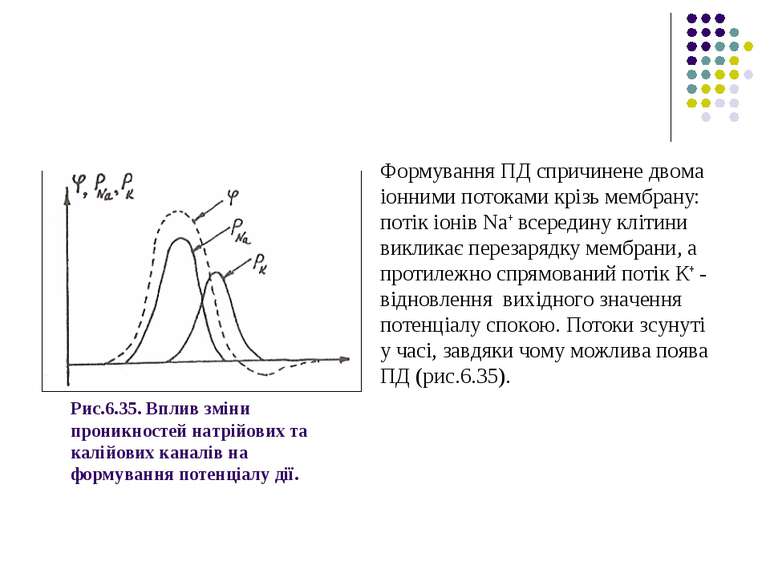
Рис.6.35. Вплив зміни проникностей натрійових та калійових каналів на формування потенціалу дії. Формування ПД спричинене двома іонними потоками крізь мембрану: потік іонів Na+ всередину клітини викликає перезарядку мембрани, а протилежно спрямований потік К+ - відновлення вихідного значення потенціалу спокою. Потоки зсунуті у часі, завдяки чому можлива поява ПД (рис.6.35).
Рис.6.36. Ілюстрація теорії локальних струмів: 1 – немієлізоване волокно; 2 – мієлінізоване. Потенціал дії, що виник на певній ділянці нервової клітини, швидко розповсюджується вздовж її поверхні завдяки локальним струмам між збудженими і незбудженими ділянками нервового волокна (рис.6.36)
Теорію генерації ф поширення потенціалу дії запропонували у 1948-1952 рр. А. Ходжкін і А. Хакслі. Згідно з моделлю Ходжкіна і Хакслі зміна іонних провідностей при зсувах мембранних потенціалів спричинена впливом електричного поля на просторовий розподіл у мембрані заряджених активуючих частинок.
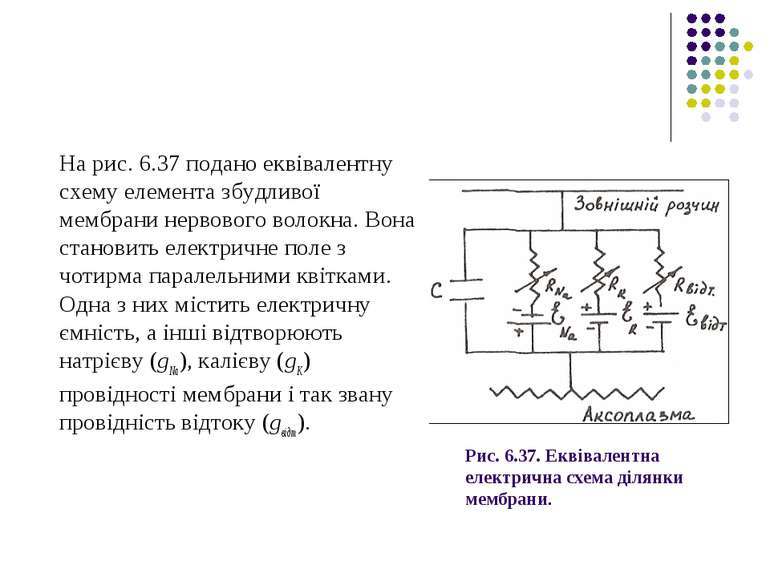
Рис. 6.37. Еквівалентна електрична схема ділянки мембрани. На рис. 6.37 подано еквівалентну схему елемента збудливої мембрани нервового волокна. Вона становить електричне поле з чотирма паралельними квітками. Одна з них містить електричну ємність, а інші відтворюють натрієву (gNa), калієву (gK) провідності мембрани і так звану провідність відтоку (gвідт).
У кожну з цих віток включені джерела електрорушійної сили (εNa, εK, εвідт), які дорівнюють відповідним рівноважним потенціалам Нернста:
Вираз для електричного струму крізь мембрану можна подати у такому вигляді: (6.65) де Δφ=φе - φі. Перший доданок у рівнянні (6.65) – це ємнісний струм, пов’язаний зі зміною різниці потенціалів на мембрані, а другий доданок – іонний струм.
Експериментально Ходжкін і Хакслі довели, що іонні струми jі прямо пропорційні різниці потенціалів на мембрані Δφ і рівноважному мембранному потенціалу Нернста для відповідного сорту іонів: (6.66)
Коефіцієнти gі в (6.66) характеризують провідності каналів. Провідність каналів може змінюватись внаслідок їх активації. Активація каналу – процес імовірнісний, котрий можна описувати за допомогою рівнянь хімічної кінетики за схемою де αn і βn – константи швидкостей активації та інактивації відповідно.
Нехай С0 – загальна кількість каналів, а С – кількість активованих каналів, тоді С0–С – кількість неактивованих каналів. Швидкість виникнення активованих каналів буде такою: (6.67)
Поділимо рівняння (6.67) на С0 і позначимо через С/С0=n частку активованих каналів. Тоді рівняння (6.67) набуде вигляду (6.68) або (6.69)
Константу А визначимо з такої початкової умови: n=0, якщо t=0, що дає Остаточно маємо (6.70)
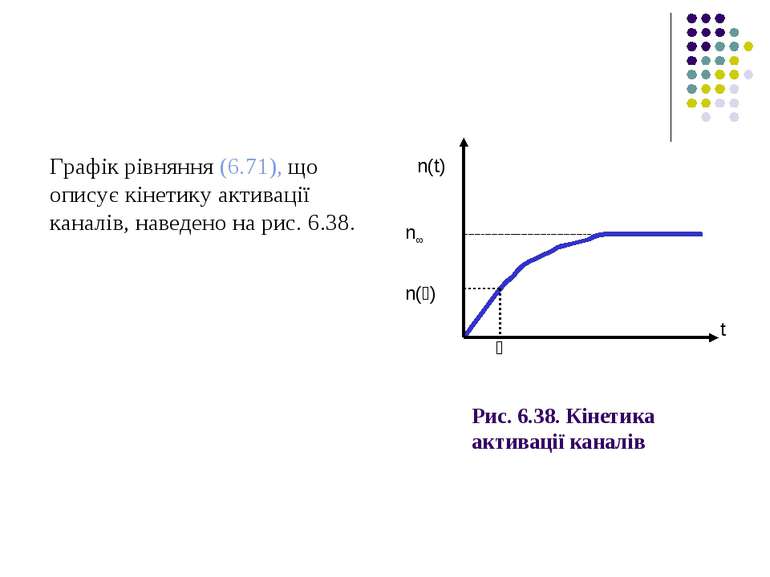
Коли t→∞, n→αn/(αn+ βn)=n∞. У результаті (6.71) де υn=1 /(αn+ βn) – постійна часу встановлення рівноваги в каналі.
Рис. 6.38. Кінетика активації каналів Графік рівняння (6.71), що описує кінетику активації каналів, наведено на рис. 6.38. n(t) n∞ n(זּ) t זּ
Експериментально було встановлено, що для калієвого каналу (6.72) де gК – максимальне значення провідності. Для натрієвого каналу (6.73) де m – частка активованих, а h – інактивованих каналів.
Рівняння, які описують зміну в часу активованих та інактивованих Na+-каналів, мають той самий вигляд (6.68), що й для К+-каналів, а саме: (6.74)
Таким чином, рівняння для сили струму крізь мембрану (6.65) з урахуванням (6.66), (6.72) та (6.73) набуває такого вигляду: (6.75)
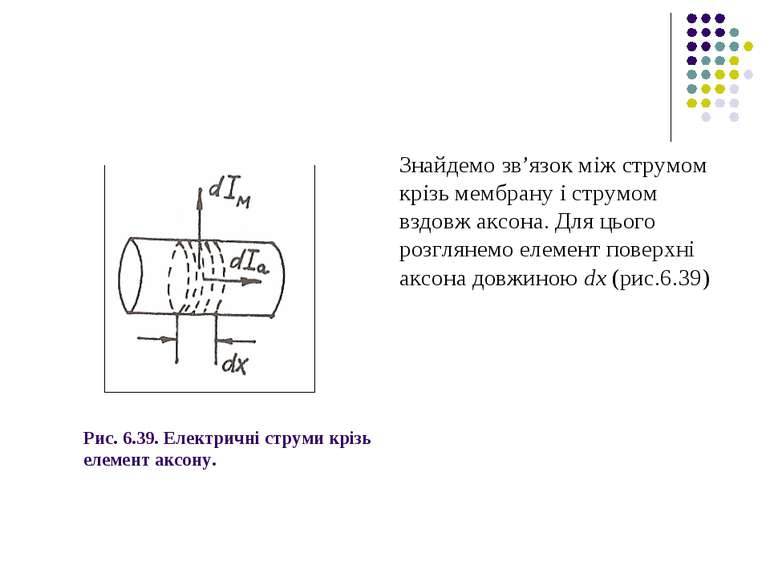
Рис. 6.39. Електричні струми крізь елемент аксону. Знайдемо зв’язок між струмом крізь мембрану і струмом вздовж аксона. Для цього розглянемо елемент поверхні аксона довжиною dx (рис.6.39)
Площа поверхні цього елемента dS=2πrdx, де r – радіус аксона. Сила струму крізь мембрану аксона (6.76)
Збільшення мембранного струму Ім буде призводити до зменшення струму Ім вздовж аксона, тобто (6.77)
Отже, сила струму в аксоплазмі згідно законом Ома становить де dRa – опір аксоплазми, причому де ρа – питомий опір аксоплазми. Тоді рівняння (6.78) набуває такого вигляду: (6.79)
У ліву частину рівняння Ходжкіна-Хакслі введемо швидкість поширення нервового імпульсу, беручи до уваги, що поширення нервового імпульсу вздовж аксона можна описати хвильовим рівнянням:
Як відомо, швидкість поширення ПД залежить від того, чи має аксон мієлінову оболонку, чи така оболонка відсутня. У першому випадку розповсюдження нервового імпульсу відбувається стрибками через перехвати Ранв’є і тому має значно більшу швидкість, ніж у другому випадку.
6.6.1 ЛАБОРАТОРНА РОБОТА: « ДОСЛІДЖЕННЯ НЕЛІНІЙНИХ ВЛАСТИВОСТЕЙ ПРОВІДНОСТІ ЖАБИ» ( ст.74-79)
Мета роботи: Вивчити основи транспорту речовин через багатошарові клітинні структури; провести дослідження нелінійних властивостей провідності шкіри жаби (зняти її вольт-амперну характеристику).
Завдання 1. Зняти ВАХ шкіри. Зібрати електричну схему для вимірювання струму та різниці потенціалів. Розташувати на електродах вимірювальної схеми шматок шкіри жаби. Шкіра повинна повністю покривати електроди. Запам’ятати положення електродів (плюс-мінус) щодо шкіри. Підготувати таблицю для занесення результатів вимірів. Змінюючи напругу, виміряти величину струму в ланцюгу. Результати занести до таблиці. Характеристику слід знімати, обираючи визначені значення струму (бажано через 25-30 мА) до досягнення величини порядку 150 мА. При більш високих значеннях струму може статися електричний “пробій” шкіри та суттєві зміни мембранних процесів.
Змінити полярність струму, що проходить крізь шкіру. Провести вимірювання відповідно до пункту 4. Шматочок шкіри занурити на 10-15 хвилин у розчин оубаіна або взяти спеціально оброблений шматочок шкіри. Розташувати цей шматочок шкіри на електроді та здійснити вимірювання за пунктами 4-5. За даними таблиці побудувати вольт-амперні характеристики “живої” та “мертвої” шкіри. Зробити висновки за результатами дослідів.
Завдання 2. Дати відповіді на контрольні питання щодо структури та транспортної функції мембран (програма bmq_/exe) у дисплейному класі.
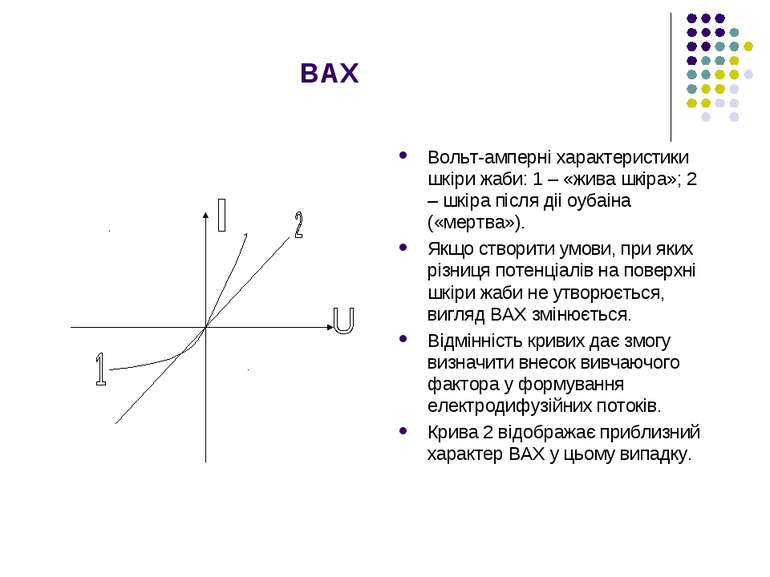
ВАХ Вольт-ампернi характеристики шкiри жаби: 1 – «жива шкiра»; 2 – шкiра пiсля дii оубаiна («мертва»). Якщо створити умови, при яких рiзниця потенцiалiв на поверхнi шкiри жаби не утворюється, вигляд ВАХ змiнюється. Вiдмiннiсть кривих дає змогу визначити внесок вивчаючого фактора у формування електродифузiйних потокiв. Крива 2 вiдображає приблизний характер ВАХ у цьому випадку.
Жаби – родина безхвостових земноводних. Довжина від 2 до 25 см. Більше 300 видів. Поширені в усіх частинах світу. Наземний нічний спосіб життя. У більшості відсутні зуби. Шкірні виділення викликають подразнення слизових оболонок інших тварин. Винищують комах. 6 видів у Червоній книзі.
Контрольні питання Сучасні уявлення про будову мембрани. Пасивний транспорт (дифузія) незаряджених частинок. Проникність мембран. Електродифузійні рівняння Нернста-Планка. Особливості пасивного транспорту через мембрани. Активний транспорт. Види. Вольт-ампернi характеристики шкiри жаби.
6.6.2. ЛАБОРАТОРНА РОБОТА: «ДОСЛІДЖЕННЯ ДИСПЕРСІЇ ЕЛЕКТРИЧНОГО ІМПЕДАНСУ БІОЛОГІЧНИХ МЕМБРАН» ( ст.79-86)
Мета роботи: вивчити особливості електричної провідності біологічних тканин у колі змінного електричного струму; дослідити залежність електричного імпедансу від частоти змінного струму длі різних біологічних об’єктів (м’язів, листка рослини …); побудувати криві дисперсії імпедансу; визначити відмінність імпедансу для “живої” та ушкодженої тканини.
Підготувати таблицю для занесення результатів вимірів. Приєднати макет з опором R для звукового генератора (ЗГ) та до осцилографа (ЕО). На голкоподібних штирях макета розташувати об’єкт дослідження. Увімкнути в електричну мережу ЗГ і ЕО. Встановити на ЗГ частоту 200 кГц. Амплітуда вихідного сигналу не повинна перевищувати 100 мВ. Підібрати чутливість осцилографа таким чином, щоб амплітуда сигналу АR на опорі R була близько 10 мм. Підключити контакти до об’єкта і поміряти (не змінюючи чутливості осцилографа) амплітуду сигналу Аz на об’єкті. Якщо вона близько 10-15 мм, то чутливість достатня для проведення вимірювань. У разі амплітуди напруги на об’єкті (менше 5 мм) необхідно збільшити сигнал падіння напруги на опорі R вдвічі (до 20 мм).
Дані про амплітуди АR і Аz занести до відповідних граф таблиці. Повторити аналогічні процедури для всіх частот, що вказані в таблиці. Замінити об’єкт дослідження та виконати аналогічні операції з дослідження дисперсії імпедансу. Побудувати графіки залежності Z від частоти для різних об’єктів. Зробити висновки з проведених досліджень. Оформити протокол лабораторної роботи. Протокол має містити: мету роботи та стислі теоритичні відомості; таблицю вимірювань та розрахунків; графіки залежності імпедансу Z від частоти для різних об’єктів; висновки за результатами досліджень.
Осцилограф Осцилограф (від лат. oscillo — качаюсь і grapho - пишу) електроннопроменевий прилад для дослідження функціонального зв’язку між двома чи кількома величинами (параметрами і функціями; електричними чи перетвореними на електричні). Для цієї мети сигнали параметра і функції подають на взаємно перпендикулярні відхиляючі пластини осцилографічної електроннопроменевої трубки і спостерігають, вимірюють і фотографують графічне зображення залежності на екрані трубки. Це зображення називають осцилограмою. Найчастіше осцилограма зображає форму електричного сигналу у часі. За нею можна визначити полярність, амплітуду і продовженість сигналу.
Імпеданс Імпеданс електричний • - повний опір електричного ланцюга (органа, організма) змінному струму. Iмпеданс електричний живих тканин – Z, де Z = R + Xc + Ri, де R - резистанс, Xc - опір ємносний живих тканин, Ri - опір індуктивний живих ткани), залежить від ступеня життєдіяльност живої тканини й відображає широке коло електромагнітних процесів. Дисперсія імпеданса Залежність електричного імпедансу від частоти
Контрольні питання Що таке електричний iмпеданс? Векторні діаграми для повного кола змінного струму з послідовним та паралельним увімкненням R, L, C. Повний опір кола змінного струму. Узагальнений закон Ома для кола змінного струму. Особливості проходження постійного та змінного струмів крізь біологічні мембрани тканин. Еквівалентні електричні схеми тканин організму. Залежність імпедансу біологічних тканин від частоти змінного струму. Дисперсія імпедансу. Коефіцієнт дисперсії.
6.6.3 ЛАБОРАТОРНА РОБОТА: « Вимірювання концентраційного матеріалу компенсаційним методом» ( ст.86-92)
План Мета роботи: Додаткові теоретичні відомості Порядок виконання роботи Результати вимірівювань Контрольні питання
Мета роботи: Вивчити природу виникнення концентраційного потенціалу. оЗнайомитись з роботою концентраційного елемента і виміряти електрорушійну силу (ЕРС) концентраційного елемента компенсаційним методом.
Додаткові теоретичні відомості Концентраційний потенціал відноситься до типу рівноважних потенціалів. Розглядаючи різні умови руху іонів у просторі, можна одержати різні типи електричних потенціалів. Рівноважний потенціал Нернста. Доннанівський потенціал. Дифузійний рівноважний потенціал. Концентраційний потенціал.
Рівноважний потенціал Нернста. Виникає при нерівномірному розподілі концентрації певних іонів у разі, коли мембрана проникла лише для цих іонів, описується формулою: Dfn = (RT/Fz)In(c1/c2)
Доннанівський потенціал. Виникає на мембрані, що проникна для малих іонів різних знаків (Na+, K+, Cl-) та непроникна для великих заряджених молекул (білків...), розташованих всередині клітинного простору. Формула для нього: Dfd = RTn[P-]/ Fz 2co де P – концентрація білкових аніонів всередині клітини, co - концентрація неорганічних іонів ззовні.
Дифузійний рівноважний потенціал. Встановлюється в середовищі при наявності градієнта концентрацій іонів різного знака, що мають різну рухливість, відповідно Dfdf = (RTb+-b-/ Fz b++b- )In c1/c2
Виникає при зануренні будь-якого металу у водний розчин власної солі певної концентрації. Така структура становить концентраційний елемент. Концентраційний потенціал.
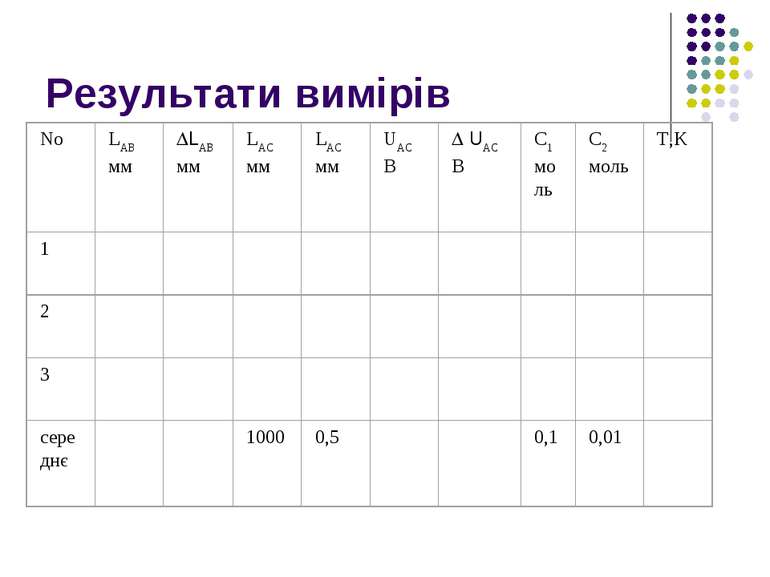
Зібрати електричне коло за схемою. 2. Накреслити таблицю для результатів вимірювання і занести до неї необхідні відомості. Пересуваючи повзунок реохорді і замикаючи вмикач ВМ1, досягти нульового відхилення стрілки гальванометра G-
3. Дані про положення реохорда (довжину ділянки АВ та поеазання вольтметра UAC ) занести до таблиці (вимірювання провести не менше 3-х разів).
4. Розрахувати середнє значення ЕРС концентраційного елемента Dfx , використовуючи середні значення величин, що входять до формули. Визначити теоретичне значення Dfx за формулою для концентраційних потенціалів fкп = -(RT/Fz )In(c1/c2) і порівняти експериментальний та теоретичний результати.
5. Зробити висновок про відповідність експериментального і теоретичного результатів, а також про можливі причини їх розходження.
Контрольні питання і задачі Чому концентраційний потенціал є рівноважним? Що таке Дифузійний рівноважний потенціал? Коли виникає Доннанівський потенціал? Формула для доннанівського потенціалу. Чи відповідні експериментальний і теоретичний результат?
6.6.4. ПРАКТИЧНЕ ЗАНЯТТЯ: « Вивчення біофізики мембран за допомогою коп’ютерних програм» ( ст. 92-96)
План Завдання 1. Завдання 2. Завдання 3. Завдання 4. Завдання 5. Завдання 6 Завдання 7. Гіперполяризація Мембранні потенціали Контрольні питання
Вивчення структури мембрани і мембранного транспорту. Запустити для виконання програму bm_.exe, bmq_.exe. Вийти у головне меню програми та вибрати курсором блок “Структура мембрани”, ознайомитися з теоретичним матеріалом. Після закінчення роботи з цим блоком перейти до наступного блоку “Транспорт речовин крізь мембрану”, натиснувши клавішу F2 та ознайомитись з матеріалом цього блоку.
Вивчення мембранних потенціалів. Запустити для виконання програму чи вибрати блок №3 “Вивчення мембранних потенціалів” при роботі з програмою m_.exe. Ознайомитись з теоретичним матеріалом цього блоку.
Вивчення потенціалу дії (ПД) і дослідження зміни його форми”. Запустити до виконання програму bmp_.exe чи перейти до виконання програми “Дослідження потенціалу дії”, запустивши її натиском клавіші F4. Вивчити теоретичний матеріал теми “Потенціал дії”, після чого перейти до виконання завдань.
Дослідити зміну потенціалу дії при зміні активності лише однієї частинки, яка активує чи інактивує іонні канали. Діапазон зміни активності частинок 0.05-25 (нормі відповідає значення активності, що дорівнює 1). Змінюючи активність від мінімальної до максимальної, отримати на екрані потенціал дії (ПД). Намалювати у зошиті отримані графіки зміни ПД. Зробити висновок про вплив активності цих частинок на зміну форми ПД.
Дослідити змінуформи ПД при одночасній зміні проникності Na+- та K+ -каналів (зміні активностей і частинок). Дослідити зміну форми ПД для таких режимів: а) n=1 (активність n-часток залишити постійною), одночасно збільшуючи активності m-частинок (діапазон зміни 1-2б5) та зменшуючи активність h-частинок (діапазон зміни 1-0.05); б) n=1, одночасно змінюючи активності m-частинок від 1 до 0.05 та збільшуючи активність n-частинок від 1 до 25; в) одночасно збільшуючи m-, n-, h- активності за вказаними діапазонами зміни цих активностей; г) одночасно зменшуючи m-, n-, h-активності.
Одержати ПД з чіткою фазою гіперполяризації. Враховуючи досвід роботи по зміні форми ПД залежно від активності частинок, одержати потенціал дії з чіткою фазою гіперполяризації.
Одержати ПД з чітким плато, розташованим вище лінії потенціалу, який дорівнює нулю. Змінюючи активності частинок, виконати це завдання. Після закінчення роботи відповісти на контрольні запитання, запустивши програму bmq_.exe.
Гіперполяризація – збільшення існуючої у спокої різниці потенціалів на поверхневих мембранах нервових і м’язових клітин (волокон) при зменшенні їхньої проникності для іонів натрію й кальцію. Найпоширеніший механізм гальмування.
Мембранні потенціали Рівноважний потенціал Нернста: Дифузійний потенціал Доннановський потенціал Стаціонарний потенціал Гольдмана-Ходжкіна-Катца
Рівноважний потенціал Нернста: Мембранний потенціал, різниця електричних потенціалів між розчинами електролітів a і b, розділених проникною мембраною m: Dabj = ja - jb. В окремому випадку, коли мембрана проникна лише для якогось іона Вzв (zB - зарядовое число), загального для розчинів електролітів a і b, М.п. (іноді його наз. потенціалом Нернста) розраховують за формулою: де F-число Фарадея, R-газова стала, Т-абс. температура, aBb, aBa - активності йона В в розчинах b і a, DabjB-стандартний потенціал розподілення іона В, рівний де m0,bB, m0,aB-стандартні хім. потенціали іона В в р-нах b і a відповідно. В такій системі М.п. не залежить від товщини мембрани й її структури, механізму переноса йона і його рухомості
Дифузійний потенціал . Внутрімембранний потенціал має кінетичну природу і визначається переносом іонів через товщу мембрани. В найпростішому випадку при дифузійно-міграційному переносі бінарного електроліта виникає дифузійний потенціал (наближення Планка): де uА, uB-рухомості іонів в мембрані, cmBA(0), cmBA(d)-концентрації електроліта в мембрані у лівої і правої міжфазних границь.
Доннановський потенціал У випадку макроскопічих мембран повний М.п. складається з трьох компонентів: двох граничних потенціалів, локалізованих в подвійних електрич. шарах на межі мембрана-р-в електролітів, і внутримембранного, локалізованого в електронейтральному об’ємі мембрани. Крім того, при пропусканні електричного струму через мембрану всередині її виникає падіння напруги. Для системы, в якої у фазі a є бінарний електроліт В+ А-, присутній і в мембрані, а мембрана містить іон R з зарядовим числом zR, не проникаючий через міжфазні межі, граничний потенціал визначається формулою Доннана і називається доннановським: Тут cmR - концентрація іонів R в мембрані, gi- і Рi-коефіцієнти активності й розподілення іонів відповідно, визначені співвідношенням
Стаціонарний потенціал Гольдмана-Ходжкіна-Катца У випадку біологічних і бішарових ліпідних мембран, товщина яких настільки мала, що в них не реалізується область електронейтральності, для знаходження внутримембранного потенціалу використовують уявлення про постійність напруження електричного поля (наближення Гольдмана):
Алан Ллойд Ходжкін Англійський біофизик Алан Ллойд Ходжкін народився у Бенбері (Оксфордшир). Ходжкін і Хакслі отримали Нобелівську премію з фізіології і медицини 1963 г. «за відкриття, що стосуються іонних механізмів, які приймають участь у збудженні і гальмуванні у периферичній і центральній ділянках мембрани нервової клітини».
Контрольні питання Що таке гіперполяризація? Дати пояснення рівноважному потенціалу Нернста Дати поянення дифузійному потенціалу Що таке Доннановський потенціал? Поясніть стаціонарний потенціал Гольдмана-Ходжкіна-Катца
Схожі презентації
Категорії









































































![Рівноважна відстань між іонами фтора в комплексі [F…H…F]- дорівнює 0.22 нм, т... Рівноважна відстань між іонами фтора в комплексі [F…H…F]- дорівнює 0.22 нм, т...](https://svitppt.com.ua/images/11/10079/770/img87.jpg)



































































































![На рис. 6.32 подані графіки φм=f[K+]е, побудовані за експериментальними даним... На рис. 6.32 подані графіки φм=f[K+]е, побудовані за експериментальними даним...](https://svitppt.com.ua/images/11/10079/770/img199.jpg)



















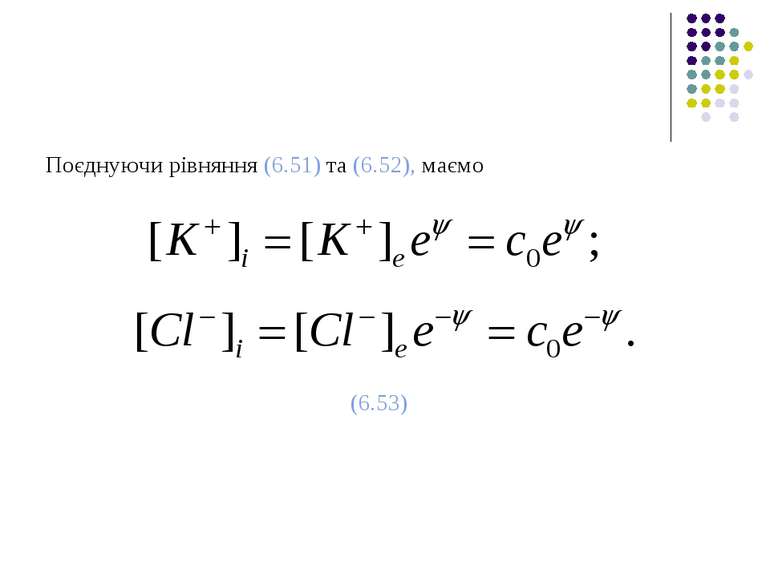














































































































































































![Рівноважна відстань між іонами фтора в комплексі [F…H…F]- дорівнює 0.22 нм, т... Рівноважна відстань між іонами фтора в комплексі [F…H…F]- дорівнює 0.22 нм, т...](https://svitppt.com.ua/images/11/10079/210/img87.jpg)









































































































![На рис. 6.32 подані графіки φм=f[K+]е, побудовані за експериментальними даним... На рис. 6.32 подані графіки φм=f[K+]е, побудовані за експериментальними даним...](https://svitppt.com.ua/images/11/10079/210/img199.jpg)