Презентація на тему:
Основні характеристики ковалентного зв’язку. Одинарні, подвійні, потрійні зв’язки
Завантажити презентацію
Основні характеристики ковалентного зв’язку. Одинарні, подвійні, потрійні зв’язки
Завантажити презентаціюПрезентація по слайдам:
Який зв’язок називається σ-зв’язком? π-зв’язком? Чим пояснити стійкість зв’язків у молекулі метану?
1) Обмінний механізм Кожен атом віддає по одному неспареному електрону в загальну електронну пару:
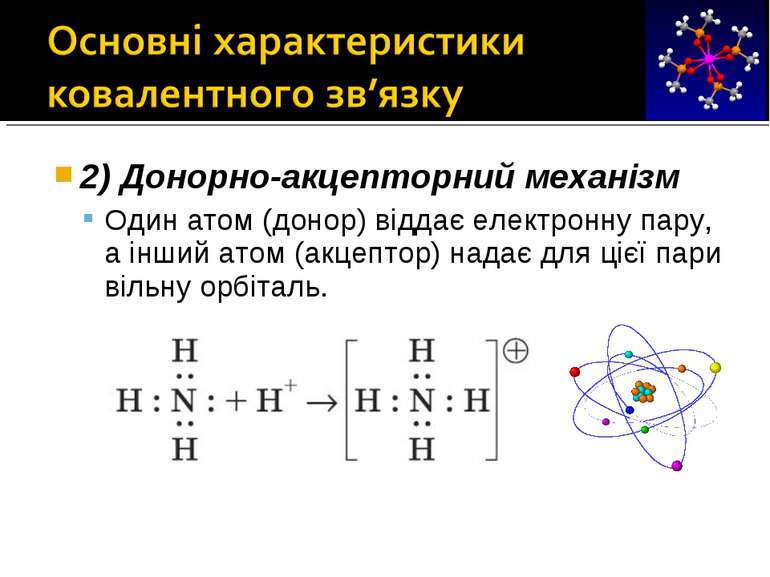
2) Донорно-акцепторний механізм Один атом (донор) віддає електронну пару, а інший атом (акцептор) надає для цієї пари вільну орбіталь. 2) Донорно-акцепторний механізм Один атом (донор) віддає електронну пару, а інший атом (акцептор) надає для цієї пари вільну орбіталь.
2) Донорно-акцепторний механізм Два атоми можуть усуспільнювати кілька пар електронів. У цьому випадку говорять про кратні зв’язки:
Йонний зв’язок Йони — це заряджені частинки, на які перетворюються атоми в результаті віддачі або приєднання електронів. (Натрій флуорид складається з йонів Натрію Na+ та флуорид-іонов F− .)
Енергія зв’язку — це енергія, що виділяється під час його утворення або необхідна для роз’єднання двох зв’язаних атомів. Енергія зв’язку характеризує його міцність.
Довжина зв’язку — це відстань між центрами зв’язаних атомів. Чим менша довжина, тим більш міцним є хімічний зв’язок. Дипольний момент зв’язку (μ) — векторна величина, що характеризує полярність зв’язку.
Визначте тип гібридизації атомів Карбону в сполуках і вид хімічного зв’язку між атомами в цих молекулах:
Схожі презентації
Категорії