Презентація на тему:
Оцтова кислота
Завантажити презентацію
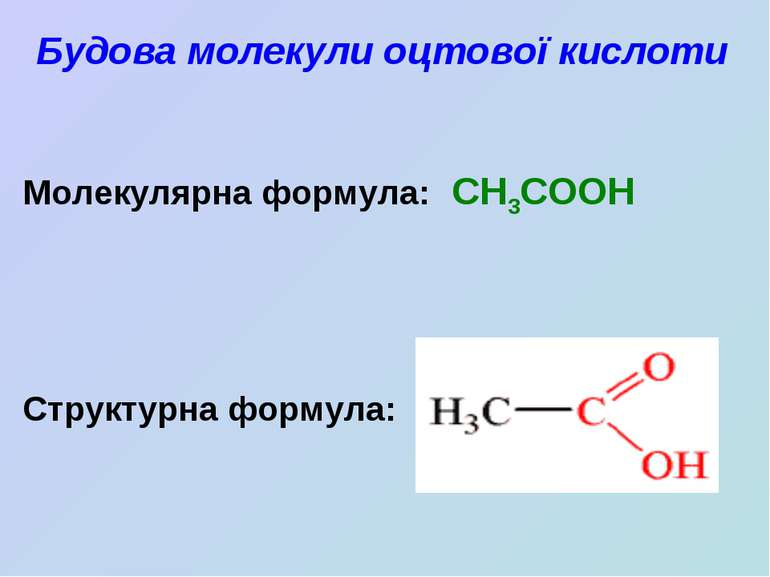
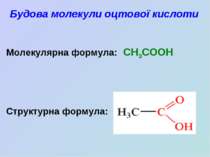
Оцтова кислота
Завантажити презентаціюПрезентація по слайдам:
Оцтова кислота Школьна Людмила Борисівна, вчитель хімії Черкаської загальноосвітньої школи I-III ступенів №6
Мета розглянути: - поняття “карбонові кислоти”, “карбоксильна група”; - особливості будови молекули оцтової кислоти та її властивості; з’ясувати застосування оцтової кислоти.
План 1. Поняття про карбонові кислоти. 2. Склад і будова оцтової кислоти. 3. Фізичні властивості оцтової кислоти. 4. Хімічні властивості оцтової кислоти. 5. Застосування.
Очікувані результати Знати: молекулярну, структурну і електронну формули оцтової кислоти, функціональну карбоксильну групу. Вміти: складати рівняння хімічних реакцій оцтової кислоти; виявляти кислотні властивості оцтової кислоти дослідницьким шляхом. Розуміти: суть реакції естерифікації.
Дайте відповіді на запитання: Які речовини називаються кислотами ? Які кислоти називаються оксигеновмісними і безоксигеновими ? Які кислоти називаються одно- і багатоосновними? Які кислоти називаються слабкими й сильними ? Які загальні хімічні властивості мають кислоти ?
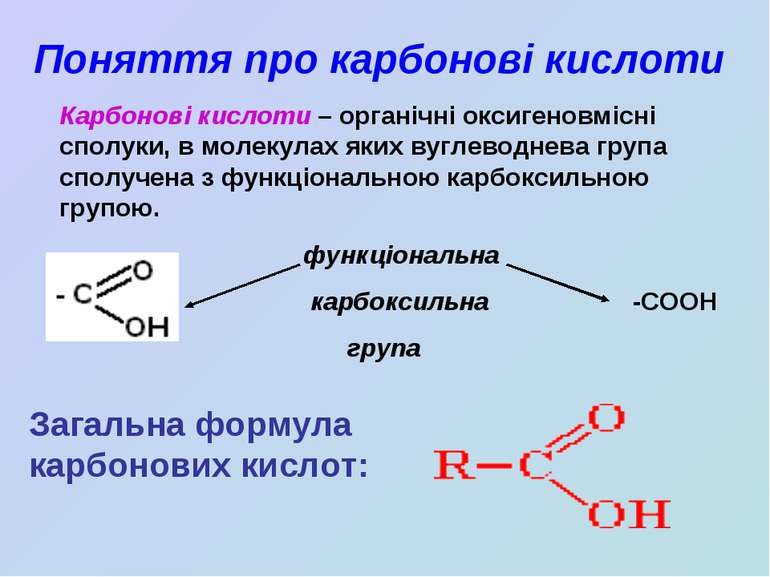
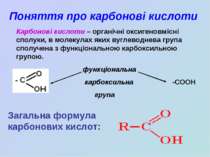
Поняття про карбонові кислоти Карбонові кислоти – органічні оксигеновмісні сполуки, в молекулах яких вуглеводнева група сполучена з функціональною карбоксильною групою. функціональна карбоксильна -COOH група Загальна формула карбонових кислот:
Карбонові кислоти HCOOH – мурашина кислота (метанова) CH3COOH – оцтова кислота (етанова) CH3 – (CH2)2 – COOH – масляна кислота Вищі карбонові кислоти: C15H33COOH – пальмітинова кислота C17H35COOH – стеаринова кислота C17H33COOH – олеїнова кислота
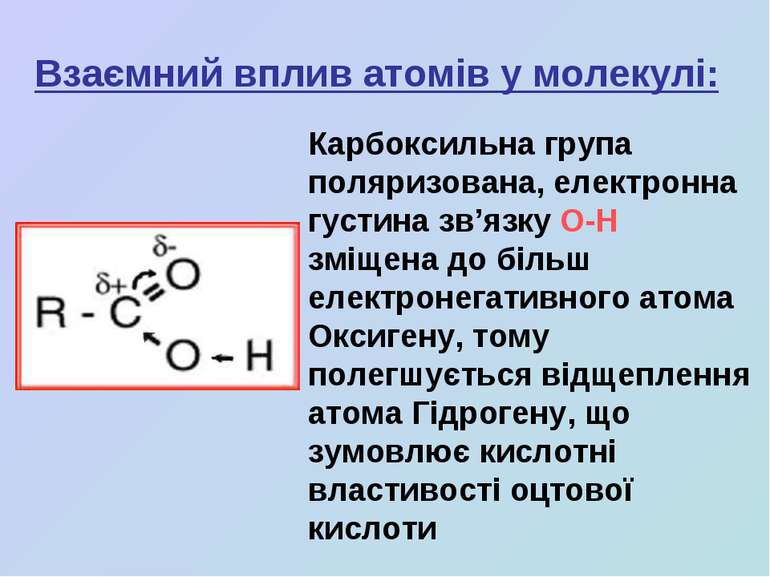
Взаємний вплив атомів у молекулі: Карбоксильна група поляризована, електронна густина зв’язку О-Н зміщена до більш електронегативного атома Оксигену, тому полегшується відщеплення атома Гідрогену, що зумовлює кислотні властивості оцтової кислоти
Фізичні властивості Оцтова кислота – безбарвна рідина, летка, має різкий специфічний запах, змішується з водою в будь-яких пропорціях, розчин кислий на смак; за t < 170 С кристалізується (“крижана кислота “); 3-9% водний розчин – столовий оцет; 86% водний розчин - оцтова есенція
Хімічні властивості 1) електролітична дисоціація: CH3COOH CH3COO1- + H1+ ацетат - йон Оцтова кислота – слабкий електроліт. Зміна забарвлення індикаторів в кислому середовищі оцтової кислоти: метилоранжевий – рожевий лакмус – червоний 2) Взаємодія з металами: 2СН3СООН + Мg Mg(CH3COO)2 + H2 магній ацетат 3) Взаємодія з оксидами металів: 2СН3СООН + СаО Са(СН3СОО)2 + Н2О кальцій ацетат 4) Взаємодія з лугами: СН3СООН + NaOH NaCH3COO + H2O натрій ацетат
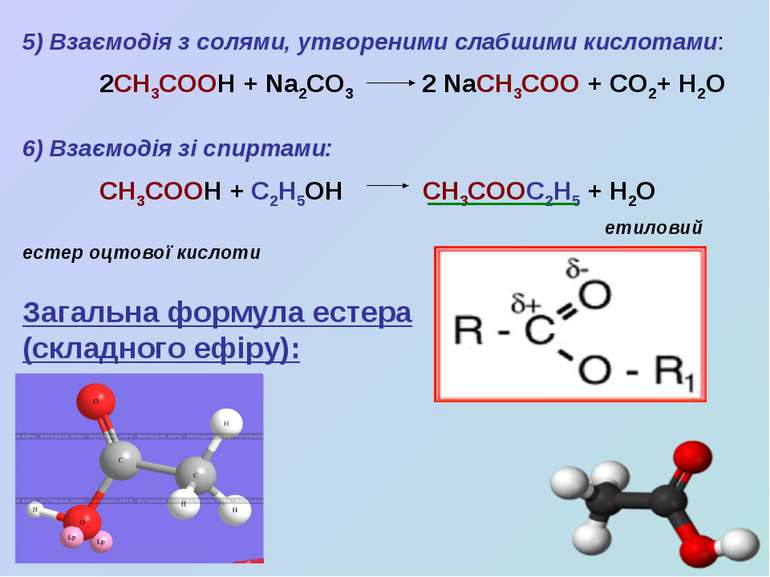
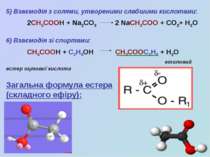
5) Взаємодія з солями, утвореними слабшими кислотами: 2СН3СООН + Na2CO3 2 NaCH3COO + CO2+ H2O 6) Взаємодія зі спиртами: СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О етиловий естер оцтової кислоти Загальна формула естера (складного ефіру):
Застосування оцтової кислоти органічний синтез виробництво штучного волокна хімічні засоби захисту рослин харчова промисловість побутова хімія лікарські препарати
Тест 1. Вкажіть функціональну групу карбонових кислот: а) –ОН; б) –СООН; в) -NH2; г) –СОН 2. Вкажіть формулу оцтової кислоти: а) НСООН; б)СН3СООН; в)С15Н35СООН; г)С17Н33СООН 3. Вкажіть колір індикатора лакмусу в розчині оцтової кислоти: а) рожевий; б) синій; в) прозорий; г) червоний 4. Вкажіть назву солей оцтової кислоти: а) ацетати; б) метаноати; в) сульфати; г)стеарати 5. Вкажіть продукт реакції взаємодії оцтової кислоти і спирту: а) солі; б) естери; в) жири; г) основи
Схожі презентації
Категорії