Презентація на тему:
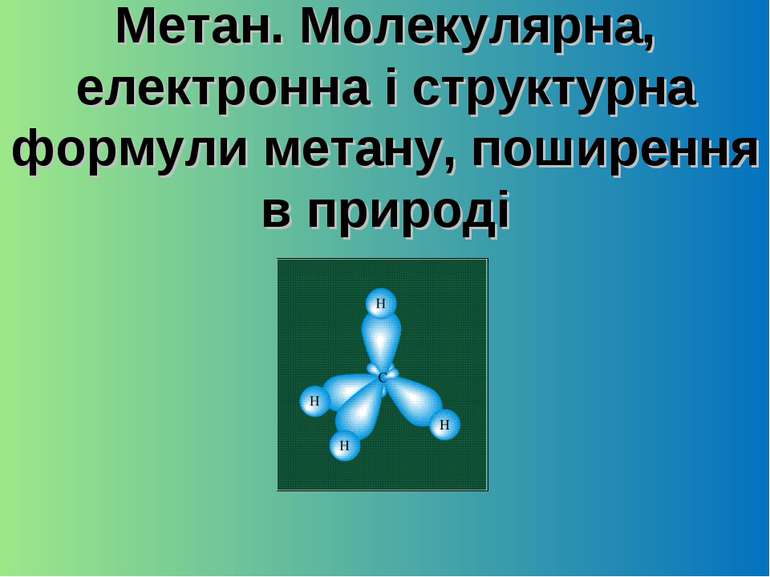
Метан. Молекулярна, електронна і структурна формули метану, поширення в природі
Завантажити презентацію
Метан. Молекулярна, електронна і структурна формули метану, поширення в природі
Завантажити презентаціюПрезентація по слайдам:
Запитання Яку валентність проявляє в органічних сполуках атом Карбону? Наведіть схему будови атома Карбону. З якими особливостями будови атома Карбону пов’язане розмаїття органічних сполук?
Атоми Карбону здатні: з’єднуватися один з одним у ланцюги різної будови — відкриті (нерозгалужені, розгалужені), замкнені; утворювати не лише прості (одинарні), але й кратні (подвійні, потрійні) зв’язки: H2C −CH3 H2C = CH2 H − C ≡ C − H утворювати міцні зв’язки майже з будь-яким іншим елементом.
Ці унікальні властивості Карбону пояснюються сполученням двох факторів: наявністю на зовнішньому енергетичному рівні (2s і 2p) чотирьох електронів (тому атом Карбону не схильний ні віддавати, ні приєднувати вільні електрони з утворенням йонів); дрібний розмір атома (порівняно з іншими елементами IV групи).
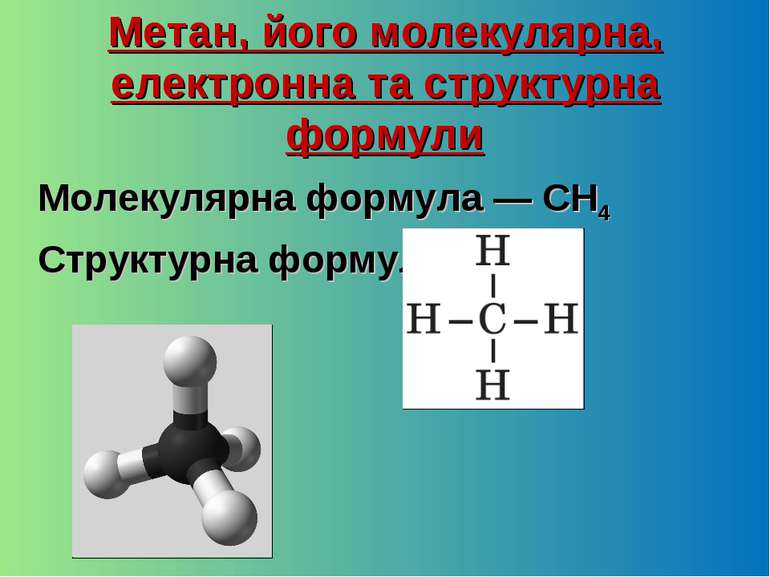
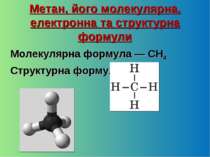
Метан, його молекулярна, електронна та структурна формули Молекулярна формула — CH4 Структурна формула
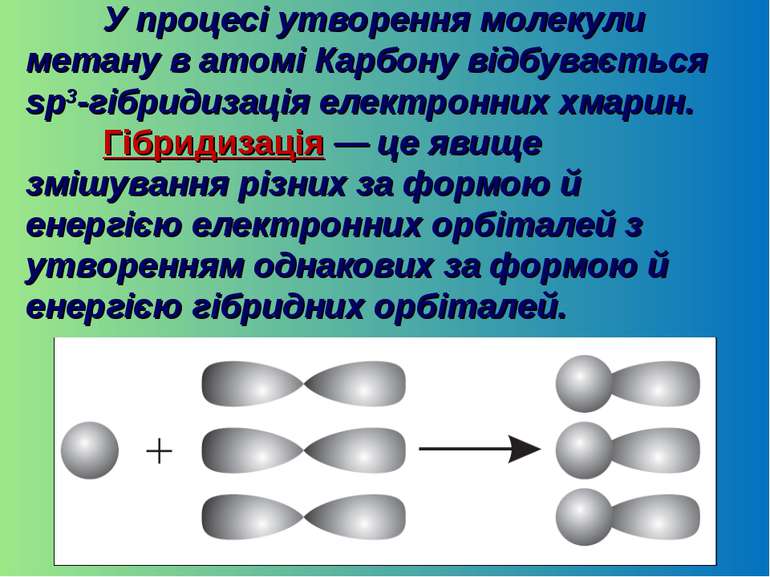
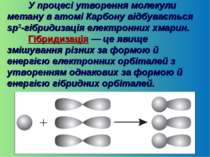
У процесі утворення молекули метану в атомі Карбону відбувається sp3-гібридизація електронних хмарин. Гібридизація — це явище змішування різних за формою й енергією електронних орбіталей з утворенням однакових за формою й енергією гібридних орбіталей.
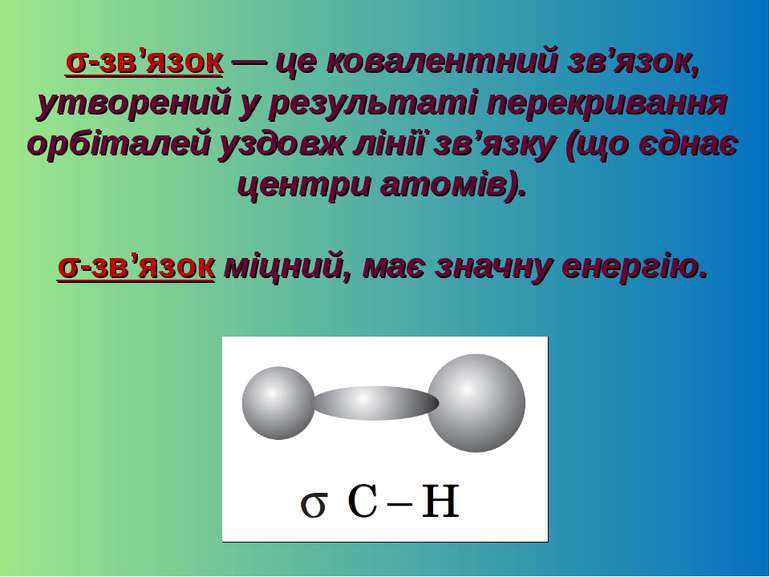
σ-зв’язок — це ковалентний зв’язок, утворений у результаті перекривання орбіталей уздовж лінії зв’язку (що єднає центри атомів). σ-зв’язок міцний, має значну енергію.
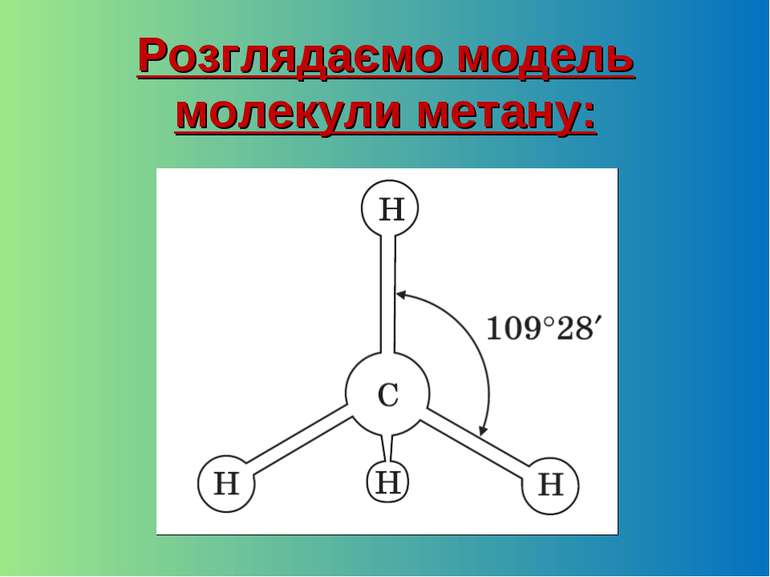
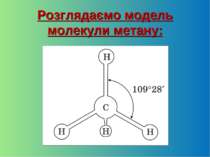
Запитання 1) Зобразіть структурну формулу метану. 2) Подумайте, чим відрізняються структурна формула на рисунку й модель молекули метану? 3) Яку просторову форму має молекула метану? 4) Скільки загальних електронних пар у молекулі метану? 5) Зобразіть електронну формулу молекули метану.
6) Які фізичні властивості проявлятиме молекула метану? Фізичні властивості метану Метан — газ, без кольору, без запаху, без смаку, легший за повітря (Dповiтря = 16/29), практично не розчинний у воді, tкип = –161,6 °С, tпл = –182,5 °С, горючий.
Розвиток сучасної теорії хімічної будови 7) Поширення метану в природі — Назвіть природні джерела метану. 8) Запишіть рівняння горіння метану. Укажіть тип реакції за різними ознаками. 9) Чому під час роботи в шахтних виробках необхідно застосовувати спеціальне устаткування для контролю за рівнем метану?
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Творче завдання. Підготувати повідомлення про застосування метану. Пояснити, на яких властивостях метану ґрунтується ця сфера його застосування.
Схожі презентації
Категорії