Презентація на тему:
Лужноземельні метали
Завантажити презентацію
Лужноземельні метали
Завантажити презентаціюПрезентація по слайдам:
s-елементи ІІА групи. Берилій, Магній і лужноземельні елементи. р-Елементи ІІІА групи. Бор і Алюміній. Загальна характеристика. Відновні властивості простих речовин елементів. Порівняльна характеристика властивостей берилію, магнію та кальцію. Характер взаємодії простих речовин з водою, розчинами кислот та основ. Берилій. Хімічна активність. sр-Гібридизація атомних орбіталей Берилію. Амфотерність берилію, його оксиду та гідроксиду. Аква- та гідроксокомплекси Берилію. Розчинність у воді та гідроліз солей Берилію. Подібність Берилію з Алюмінієм (діагональна подібність), її причини. Магній. Оксид та гідроксид Магнію. Розчинність солей Магнію у воді та їх гідроліз. Йон Магнію як комплексоутворювач. Хлорофіл. Лужноземельні метали. Загальна характеристика. Фізико-хімічні властивості та характеристика найважливіших сполук. Основний характер оксидів та гідроксидів. Розчинність гідроксидів та солей у воді. Реакції виявлення катіонів Mg2+, Ca2+, Sr2+, Ba2+. Реакції катіонів IIА групи з комплексонами (на прикладі ЕДТА). Твердість води, одиниці її вимірювання. Методи її усунення. Сполуки Кальцію в кістковій тканині, подібність йонів Кальцію і Стронцію, ізоморфне заміщення (проблема стронцій-90). Токсичність Берилію і Барію. Біологічна роль Кальцію та Магнію. Хімічні основи застосування сполук Магнію, Кальцію і Барію в медицині й фармації. Загальна характеристика елементів ІІІА групи. Електронна дефіцитність, її вплив на властивості елементів та їх сполук. Зміна стійкості сполук зі зміною ступеня окиснення +3 і +1 в групі. Загальна характеристика Бору. Проста речовина та її хімічна активність. Бориди. Сполуки з Гідрогеном (борани), особливості стереохімії і природа зв’язку. Гідридоборати. Галогеніди Бору, гідроліз і комплексоутворення. Бор(ІІІ) оксид і боратні кислоти, рівновага у водному розчині. Борати як похідні різних простих і полімерних кислот Бору. Тетраборат натрію. Естери боратної кислоти. Борорганічні сполуки. Біологічна роль Бору. Антисептичні властивості боратної кислоти та її солей. Алюміній. Загальна характеристика. Проста речовина та її хімічна активність. Амфотерність алюмінію, його оксиду та гідроксиду. Алюмінати. Йон алюмінію як комплексоутворювач. Безводні солі Алюмінію і кристалогідрати. Особливості будови. Галогеніди. Гідрид алюмінію. Фізико-хімічні основи застосування Алюмінію та його сполук у медицині, фармації та косметології.
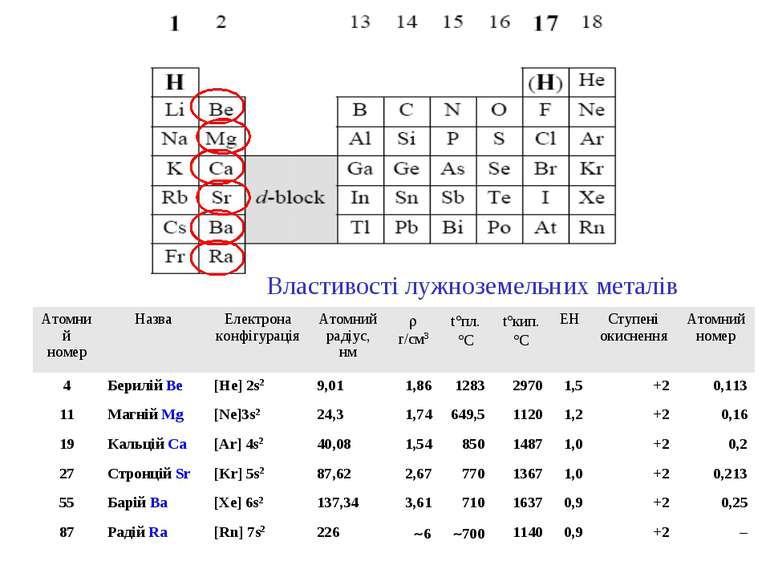
Властивості лужноземельних металів Атомний номер Назва Електрона конфігурація Атомний радіус, нм r г/см3 t°пл. °С t°кип. °С ЕН Ступені окиснення Атомний номер 4 Берилій Be [He] 2s2 9,01 1,86 1283 2970 1,5 +2 0,113 11 Магній Mg [Ne]3s2 24,3 1,74 649,5 1120 1,2 +2 0,16 19 Кальцій Ca [Ar] 4s2 40,08 1,54 850 1487 1,0 +2 0,2 27 Стронцій Sr [Kr] 5s2 87,62 2,67 770 1367 1,0 +2 0,213 55 Барій Ba [Xe] 6s2 137,34 3,61 710 1637 0,9 +2 0,25 87 Радій Ra [Rn] 7s2 226 ~6 ~700 1140 0,9 +2 –
Фізичні властивості Лужноземельні метали (в порівнянні з лужними металами) володіють вищими t°пл. і t°кип., потенціалами іонізації, щільністю і твердістю. Знаходження в природі Be 3BeO • Al2O3 • 6SiO2 – берил Mg MgCO3 – магнезит CaCO3 • MgCO3 – доломіт KCl • MgSO4 • 3H2O – каїніт KCl • MgCl2 • 6H2O – карналіт Ca CaCO3 – кальцит (вапняк, мармур і ін.) Ca3(PO4)2 – апатит CaSO4 • 2H2O – гіпс CaSO4 – ангідрит CaF2 – плавиковий шпат (флюорит) Sr SrSO4 – целестин SrCO3 – стронціаніт Ba BaSO4 – барит BaCO3 – вітерит
Отримання Берилій отримують відновленням Фториду: BeF2 + Mg (t°)→ Be + MgF2 Барій отримують відновленням оксиду: 3BaO + 2Al (t°)→ 3Ba + Al2O3 Решта металів отримує електролізом розплавів хлоридів: CaCl2 → Ca + Cl2 катод: Ca2+ + 2e → Ca0 анод: 2Cl- – 2e → Cl02
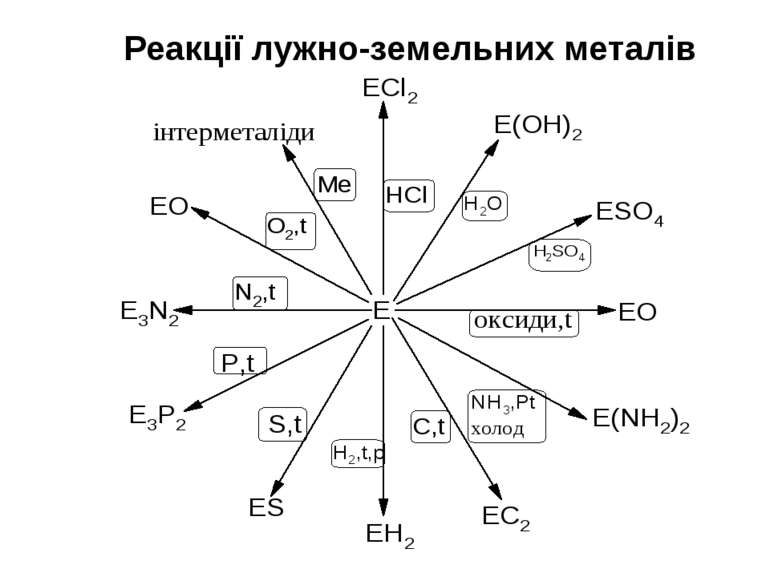
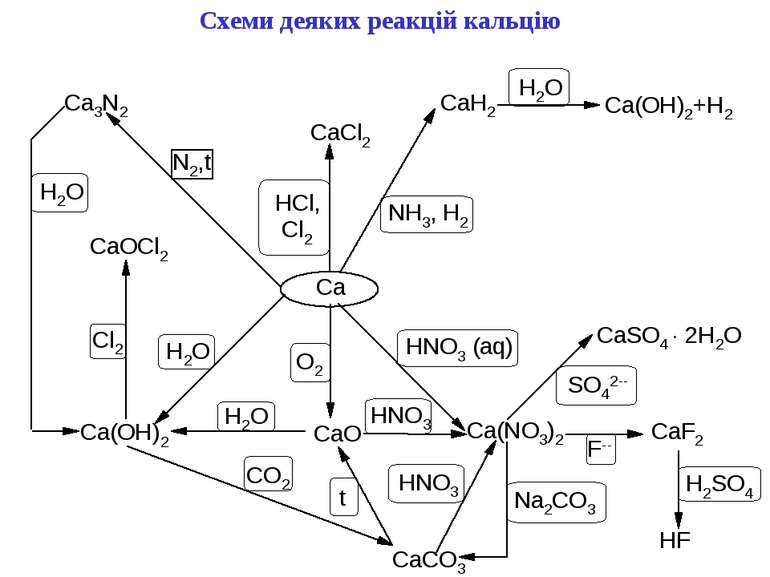
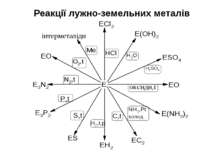
Хімічні властивості Метали головної підгрупи II групи - сильні відновники; у сполуках проявляють тільки ступінь окислення +2. Активність металів і їх відновна здатність збільшується в ряду: –Be–Mg–Ca–Sr–Ba→ 1. Реакція з водою. У звичайних умовах поверхня Be і Mg покриті інертною оксидною плівкою, тому вони стійкі по відношенню до води. На відміну від них Ca, Sr і Ba розчиняються у воді з утворенням гідроксидів, які є сильними основами: Mg + 2H2O (t°)→ Mg(OH)2 + H2 Ca + 2H2O → Ca(OH)2 + H2 2. Реакція з киснем. Всі метали утворюють оксиди RO, барій-пероксид – BaO2: 2Mg + O2 → 2MgO Ba + O2 → BaO2 3. З іншими неметалами утворюються бінарні сполуки: Be + Cl2 → BeCl2 (галогеніди) Ba + S → BаS (сульфіди) 3Mg + N2 → Mg3N2 (нітриди) Ca + H2 → CaH2 (гідриди) Ca + 2C → CaC2 (карбіди) 3Ba + 2P → Ba3P2 (фосфіди) Берилій і магній порівняно поволі реагують з неметалами.
4. Всі метали розчиняються в кислотах: Ca + 2HCl → CaCl2 + H2 Mg + H2SO4(розв.)→ MgSO4 + H2 Берилій також розчиняється у водних розчинах лугів: Be + 2NaOH + 2H2O → Na2[Be(OH)4]+ H2 5. Якісна реакція на катіони лужноземельних металів – забарвлення полум'я в наступні кольори: Ca2+ - темно-оранжевий Sr2+- темно-червоний Ba2+ - ясно-зелений Катіон Ba2+ зазвичай відкривають обмінною реакцією з сульфатною кислотою або її солями: Ba2+ + SO42- = BaSO4↓(білий осад) Сульфат барію – білий осад, нерозчинний в мінеральних кислотах. Ca2+ Ba2+ Sr2+
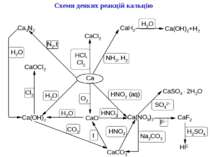
Оксиди лужноземельних металів Отримання 1) Окислення металів (окрім Ba, який утворює пероксид) 2) Термічне розкладання нітратів або карбонатів CaCO3 (t°)→ CаO + CO2 2Mg(NO3)2 (t°)→ 2MgO + 4NO2 + O2 Хімічні властивості Типові основні оксиди. Реагують з водою (окрім BеO), кислотними оксидами і кислотами MgO + H2O → Mg(OH)2 3CaO + P2O5 → Ca3(PO4)2 BeO + 2HNO3 → Be(NO3)2 + H2O BeO - амфотерний оксид, розчиняється в лугах: BeO + 2NaOH + H2O → Na2[Be(OH)4]
Гідроксиди лужноземельних металів R(OH)2 Отримання Реакції лужноземельних металів або їх оксидів з водою: Ba + 2H2O → Ba(OH)2 + H2 CаO(негашене вапно)+ H2O → Ca(OH)2(гашене вапно) Хімічні властивості Гідроксиди R(OH)2 - білі кристалічні речовини, у воді розчинні гірше, ніж гідроксиди лужних металів (розчинність гідроксидів зменшується із зменшенням порядкового номера; Be(OH)2 – нерозчинний у воді, розчиняється в лугах. Основність R(OH)2 збільшується із збільшенням атомного номера: Be(OH)2 – амфотерний гідроксид, Mg(OH)2 – слабка основа, решта гідроксидів - сильні основи (луги). 1) Реакції з кислотними оксидами: Ca(OH)2 + SO2 → CaSO3↓ + H2O Ba(OH)2 + CO2 → BaCO3 ↓ + H2O 2) Реакції з кислотами: Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O 3) Реакції обміну з солями: Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH 4) Реакція гідроксиду берилію з лугами: Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Характерні реакції іонів Mg2+ Натрій або амоній гідрогенфосфат (фармакопейна реакція) з іонами Mg2+, якщо є водний розчин аміаку і NH4Cl, утворює білий кристалічний осад MgNH4PO4 6H2O: Mg2+ + HPO42– + NH3 + 6H2O = MgNH4PO4 6H2O . Сіль амонію додають для того, щоб не випав осад Mg(OH)2. Реакції заважають іони Ba2+, Ca2+ та інших важких металів. Характерні реакції іонів Ва2+ Калій хромат або біхромат утворюють з іонами Ва2+ жовтий кристалічний осад Барій хромату, нерозчинний в ацетатній кислоті, але розчинний у мінеральних кислотах: Ва2+ + CrО42– = ВаCrО4 ; 2Ва2+ + Cr2О72– + H2O = 2ВаCrО4 + 2Н+. Розглянута реакція є характерною для іонів Ba2+, і її застосовують не тільки для виявлення Барію, але і для відокремлення його від іонів Sr2+ та Ca2+. Амоній карбонат осаджує з нейтральних або лужних розчинів солей Барію білий аморфний осад BaCO3, який під час нагрівання переходить у кристалічний: Ba2+ + CO32– = BaCО3 . Барій карбонат розчиняється в ацетатній та мінеральних (крім H2SO4) кислотах. Сульфатна кислота (розведена) і розчинні сульфати (фармакопейна реакція за ДФУ ХІ) осаджують з розчинів солей Барію білий дрібнокристалічний осад BaSO4: Ba2+ + SO42– = BaSO4 . Реакція забарвлення полум’я. Леткі солі Барію, наприклад BaCl2, Ba(NO3)2 та інші забарвлюють безбарвне полум’я в жовто-зелений колір.
Характерні реакції іонів Sr2+ Мікрокристалоскопічна реакція. Іони Sr2+ з іонами Cu2+ в ацетатному середовищі у присутності Калій нітриту утворюють синьо-зелені кристали кубічної форми: Sr2+ + Cu2+ + 6NO2– + 2K+ K2Sr[Cu(NO2)6] . Іони Ba2+ і Ca2+ дають кристали зеленого кольору іншої форми. Сульфатна кислота і розчинні сульфати утворюють білий осад SrSO4 практично нерозчинний в кислотах: Sr2+ + SO42– = SrSO4 . Виявленню іонів Sr2+ заважають іони Ba2+ та Ca2+, тому що вони осаджуються у вигляді сульфатів. Амоній оксалат з іонами Sr2+ утворює білий осад: Sr2+ + C2O42– SrC2O4 . Осад розчиняється в мінеральних кислотах, а при нагріванні – в концентрованій ацетатній кислоті. Гіпсова вода осаджує іони Sr2+ у вигляді Стронцій сульфату. Осад SrSO4 утворюється при додаванні „гіпсової води” (насичений водний розчин Кальцій сульфату) до розчину, що містить іони Стронцію, оскільки розчинність у воді SrSO4 менша ніж СаSO4. Виділенню осаду сприяє нагрівання; без нагрівання осад виділяється після тривалого стояння: Sr2+ + СаSO4 SrSO4 + Са2+.
Характерні реакції іонів Ca2+ Амоній оксалат (фармакопейна реакція) утворює з іонами Ca2+ білий кристалічний осад Кальцій оксалату: Ca2+ + C2O42– = CaC2O4 . Осад CaC2O4 розчиняється у мінеральних кислотах, але не розчиняється в ацетатній кислоті. Виявленню іонів Ca2+ заважають іони Ba2+ і Sr2+, які утворюють з (NH4)2C2O4 аналогічні осади. Реакцію виконують при pH 3.0-3.5. Мікрокристалоскопічна реакція. Сульфатна кислота, взаємодіючи з розчинними солями Кальцію, утворює характерні білі кристали гіпсу CaSO4 2H2O у формі голок. Можна виявити іони Ca2+ за наявності іонів Ba2+ і Sr2+. Амоній карбонат (NH4)2CO3 осаджує іони Ca2+ у вигляді білого аморфного осаду Кальцій карбонату CaCO3; Ca2+ + CO32– = CaCO3 . Кальцій карбонат розчинний в ацетатній та мінеральних кислотах. Сульфатна кислота і сульфати лужних металів осаджують іони Ca2+ тільки з концентрованих розчинів солей Кальцію, утворюючи білий осад CaSO4: Ca2+ + SO42– = CaSO4 . Осад Кальцій сульфату легше розчиняється у кислотах, ніж осади BaSO4 і SrSO4. Він також розчиняється у надлишку (NH4)2SO4, утворюючи комплексну сполуку: CaSO4 + (NH4)2SO4 = (NH4)2[Ca(SO4)2]. Калій гексаціаноферат (ІІ) (фармакопейна реакція) осаджує іони Кальцію в присутності NH3 і NH4Cl з концентрованих розчинів або в присутності етанолу у вигляді білого осаду Кальцій-амоній гексаціаноферату (ІІ): Ca2+ + 2NH4+ + [Fe(CN)6]4- Ca(NH4)2[Fe(CN)6] Реакція забарвлення полум’я (фармакопейна реакція). Леткі солі Кальцію забарвлюють безбарвне полум’я пальника в оранжево-червоний колір.
Твердість води Твердість води визначається наявністю в ній розчинних солей, в основному сульфатів і бікарбонатів кальцію, магнію, заліза. Твердість води виражають в градусах. Один градус твердості відповідає 0.337 мг-екв/л, що в перерахунку на СаО і MgO складає 10 і 7.2мг/л відповідно. Твердість води, обумовлена гідрокарбонатами Са(ІІ), Mg(II), Fe(II), називається тимчасовою твердістю. Тимчасова твердість усувається кип’ятінням: гідрокарбонати перетворюються в середні карбонати: М(НСО3)2 МСО3 + СО2 + Н2О і випадають в осад. В результаті цього вміст солей у воді знижується. Якщо підвищити рН води, добавивши лужний реагент (Na2CO3 або Ca(OH)2) спостерігається той самий ефект. Постійну твердість води неможливо усунути простим кип’ятінням води. Вона обумовлена присутністю відносно добре розчинних сульфатів, силікатів, хлоридів, які не руйнуються при кип’ятінні. Для усунення постійної твердості води розроблені різні методи, наприклад: СaSO4 + Na2CO3 CaCO3 + Na2SO4.
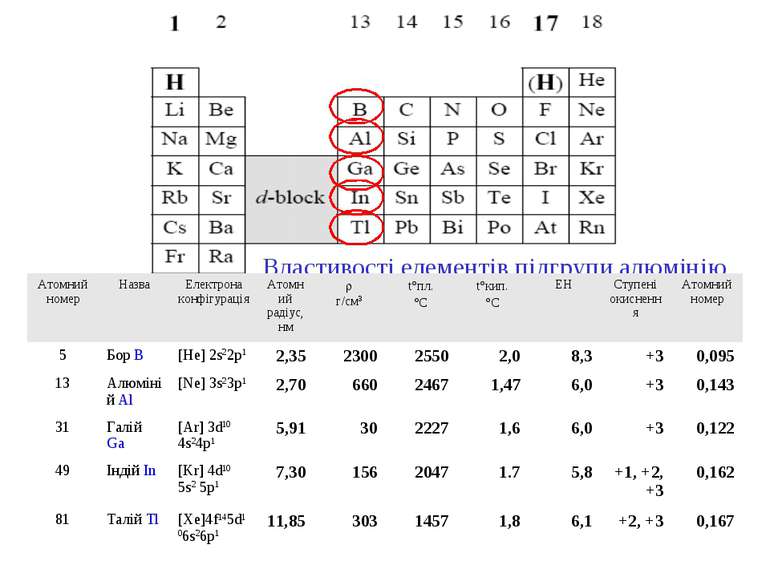
Властивості елементів підгрупи алюмінію Атомний номер Назва Електрона конфігурація Атомний радіус, нм r г/см3 t°пл. °С t°кип. °С ЕН Ступені окиснення Атомний номер 5 Бор B [He] 2s22p1 2,35 2300 2550 2,0 8,3 +3 0,095 13 Алюміній Al [Ne] 3s23p1 2,70 660 2467 1,47 6,0 +3 0,143 31 Галій Ga [Ar] 3d10 4s24p1 5,91 30 2227 1,6 6,0 +3 0,122 49 Індій In [Kr] 4d10 5s2 5p1 7,30 156 2047 1.7 5,8 +1, +2, +3 0,162 81 Талій Tl [Xe]4f145d106s26p1 11,85 303 1457 1,8 6,1 +2, +3 0,167
Фізичні властивості 1. Із збільшенням атомної маси посилюється металічний характер елементів (В – неметал; інші – метали). 2. Бор значно відрізняється за властивостями від інших елементів (високі т.пл., т.кип., твердість; інертність). Решта елементів – легкоплавкі метали, In і Tl - дуже м'які. БОР Бор очолює третю групу періодичної системи і є “типовим” для неї. Проте властивості бору відрізняються від його важких аналогів. Хімічні і фізичні властивості бору і його складних сполук, в склад яких він входить, зближують його не з алюмінієм, а з силіцієм (діагональна подібність). Тут діє правило діагоналі – спостерігається подібність у властивостях простих і складних сполук бору, який має менший розмір атома і менший ступінь окиснення (+3), і силіцію, який має більші розміри, але і більший ступінь окиснення (+4). Електронна оболонка бору має таку будову: 1s22s22p1. Як неметал, бор схильний утворювати ковалентні зв’язки. Для не збудженого атома бору характерна така електронна структура:
а б в г Бор: а – б – кристалічний бор; в – аморфний бор; г – кристалічний бор у вигляді порошку.
При утворенні хімічних сполук у атома бору проходять такі зміни – один електрон з 2s-енергетичного підрівня переходить на 2р-підрівень: Сполуки бору відомі з часів алхіміків. В ті часи застосування знаходила бура, яку, можливо, добували з озерних відкладів. Бор вперше отримав Гей-Люссак і Генар в 1808р. В залежності від умов синтезу одержують аморфний або кристалічний бор. Аморфний бор має вигляд коричневого порошку, кристалічний бор – сіро-чорний, з металічним блиском. Твердість кристалічного бору майже така як у алмазу. Аморфний бор отримують за реакціями: B2O3 + 3Mg 3MgO + 2B Na2B4O7 + 12Na 4B + 7Na2O Кристалічний бор отримують піролізом ВJ3, термолізом або відновленням BBr3 воднем на танталовій нитці при 1300-15000С, а також кристалізацією розплаву аморфного бору (наприклад, із розплаву Al)
У промисловості бор добувають із природних боратів. Переробка колеманіту або інвоїту проводять лужним методом з видобутком бури: 2Ca2B6O11 + 4Na2CO3 + H2O 3Na2B4O7 + 4CaCO3 + 2NaOH Кислотний спосіб (переробки борациту) дає в якості кінцевого продукту ортоборну кислоту: Mg3B8O15 + 6HCl + 9H2O 8H3BO3 + 3MgCl2 Бор хімічно інертний. З киснем він реагує при температурі вищій за 7000С з утворенням борного ангідриду: 4В + 3О2 2В2О3. При ще вищій температурі бор реагує з азотом: 2B + N2 2BN, з хлором: 2B + 3Cl2 2BCl3. При високих температурах В відновлює різні оксиди (СО2, Р2О5), з металами взаємодіє з утворенням боридів. Розбавлені кислоти на бор не діють. Нітратна кислота окиснює бор до ортоборної кислоти. Сплавлення бору з лугами в присутності окисника приводить до одержання боратів. Перегріта водяна пара взаємодіючи з бором дає В2О3 і Н2: 2В + 3Н2О 3Н2 + В2О3.
Гідриди бору, або борани, мають склад, подібний із складом вуглеводнів. Так, отримані борани насиченого (BnH2n+2) і ненасиченого (BnHn) рядів. Борани отримують дією кислот і води на бориди деяких металів. Наприклад, так званий метод Штока полягає в обробці Mg3B2 або Be3B2 хлоридною кислотою: Mg3B2 + 6HCl B2H6 + 3MgCl2. Борани – безколірні гази і летючі рідини, рідше тверді речовини. Вони неприємно пахнуть, отруйні. По реакційній здатності борани схожі до силанів. На повітрі суміш боранів самозапалюється з утворенням Н2О і В2О3, а при їх взаємодії утворюється борна кислота і молекулярний водень: В2Н6 + 6Н2О 2Н3ВО3 + 3Н2 Іншим важливим проявом здатності боранів до донорно-акцепторного зв’язку є отримання борнітрогенових сполук. Прикладом може бути реакція: 3В2Н6 + 6NH3 2B3N3H6 + 12H2 (в скляній запаяній ампулі)
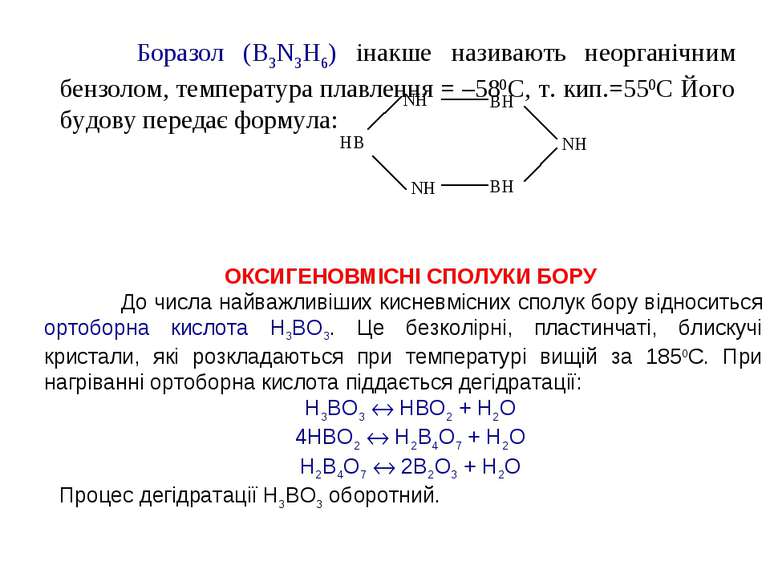
Боразол (B3N3H6) інакше називають неорганічним бензолом, температура плавлення = –580С, т. кип.=550С Його будову передає формула: ОКСИГЕНОВМІСНІ СПОЛУКИ БОРУ До числа найважливіших кисневмісних сполук бору відноситься ортоборна кислота Н3ВО3. Це безколірні, пластинчаті, блискучі кристали, які розкладаються при температурі вищій за 1850С. При нагріванні ортоборна кислота піддається дегідратації: Н3ВО3 НВО2 + Н2О 4НВО2 Н2В4О7 + Н2О Н2В4О7 2В2О3 + Н2О Процес дегідратації Н3ВО3 оборотний.
Кристалічна борна кислота 3% розчин борної кислоти (антибактеріальний засіб) Пари борної кислоти зафарбовують полум’я у зелений колір. Ортоборна кислота являє собою типовий слабкий електроліт. Кислотні властивості виражені слабко. Раніше дисоціацію Н3ВО3 розглядали, як дисоціацію трьохосновної кислоти: Н3ВО3 Н+ + Н2ВО3– 2Н+ + НВО32– 3Н+ + ВО33– Відповідно константи кислотної дисоціації: К/=7.3 10–10, К//=2 10–13, К///=2 10–14. За сучасними даними борна кислота одноосновна. Вважають, що краще її будову передає формула В(ОН)3, а не Н3ВО3. Тому що, кислотність викликана не депротонізацією (відщепленням іону водню), а приєднанням гідроксильного іону із води: В(ОН)3 + Н2О В(ОН)4– + Н+
На відміну від дуже слабкої ортоборної кислоти тетраборна кислота Н2В4О7 проявляє властивості кислоти, по силі рівній оцтовій кислоті: К/=2 10–4, К//=2 10–5. Це дозволяє розглядати кислотні властивості тетраборної кислоти як результат звичайної депротонізації: Н2В4О7 2Н+ + В4О72–. Різниця у величинах 1 і 2 констант дисоціації у Н2В4О7 складає лише один порядок. Тому відщеплення першого і другого протонів проходить майже одночасно, внаслідок чого утворюються лише двохзаміщені солі типу бури Na2B4O7. Солі борних кислот – борати – мають різний склад в залежності від мольного співвідношення в тому чи іншому борати оксидів лужного металу і бору: Ортоборати Na3ВО3, або 3Na2О В2О3 Метаборати NaВО2, або Na2О В2О3 Тетраборати Na2В4О7, або Na2О 2В2О3 Бура Бура (борат натрію) — кристали, температура плавлення бури — tпл = 60,8°С. В природі — мінерал, класу боратів, хімічний осад бороносних соляних озер. Кристали бури — прозорі, без кольору, мають жирний блиск, розчинні у воді.
Бор утворює всі чотири тригалогеніди. При звичайних умовах це газоподібні речовини або легкоплавкі рідини. Всі тригалогеніди бору мають структуру плоского трикутника з атомом бору в центрі. Тригалогеніди добувають: 2B + 3F2 2BF3 B2O3 + 3C + 3Cl2 2BCl3 + 3CO. Галогеніди бору при гідролізі утворюють дві кислоти: BCl3 + 3H2O B(OH)3 + 3HCl 2BF3 + 3H2O B(OH)3 + HBF4 + 2HF. Тетрафтороборна кислота сильніша за плавикову (HF). При спробі виділити HBF4 з розчину вона розпадається на HF і BF3. Проте солі тетрафтороборної кислоти – тетрафтороборати – стійкі.
Характерні реакції B4O72–- і BO2–-іонів. Барій хлорид утворює з тетраборат-іонами білий осад Ba(BO2)2: B4O72– + Ba2+ + 3H2O = Ba(BO2)2 + 2H3BO3. Осадження B4O72–-іона досягається лише в сильнолужному середовищі: 2H3BO3 + 2OH– + Ba2+ = Ba(BO2)2 + 4H2O. Осад Барій метаборату розчиняється в кислотах: Ba(BO2)2 + 2H+ + 2H2O = Ba2+ + 2H3BO3. Забарвлення полум’я. Леткі сполуки Бору забарвлюють безбарвне полум’я пальника в зелений колір. Тетраборат- і метаборат-іони в присутності сульфатної кислоти з етанолом утворюють борно-етиловий ефір: B4O72– + 2H+ + 5H2O = 4H3BO3; B(OH)3 + 3C2H5OH = B(OC2H5)3 + 3H2O. Борно-етиловий ефір – летка сполука і тому забарвлює полум’я в характерне зелене забарвлення.
АЛЮМІНІЙ Типовим елементом-металом ІІІ групи є алюміній. Його легкий аналог – бор відноситься до елементів-неметалів. Важкими аналогами алюмінію є скандій, ітрій, лантан і лантаніди (лантаноїди) – 17 елементів, які об’єднують під загальною назвою рідкоземельні елементи. Назва “алюміній” італійського походження: біля італійського міста Чівітавек’я знайдено поклади мінералу алуніту (Na, K)2SO4 Al2(SO4)3. Прожарюванням алуніта одержували квасці K2SO4 Al2(SO4)3 24H2O. Римляни квасці називали alumen, звідси – алюміній. Алюміній – непарний елемент, його порядковий номер 13. В алюмінію є один стабільний ізотоп 2713Al, всі інші – радіоактивні. Основним джерелом для виробництва алюмінію є мінерал боксит (гідроксид алюмінію), частково дегідратований. Боксит – осадова порода. Його склад описується формулою Al2O3 zH2O (z 2). Велика кількість алюмінію входить до складу різновидностей глини (вторинний мінерал). Основою глини є каолініт Al2O3 2SiO2 2H2O.
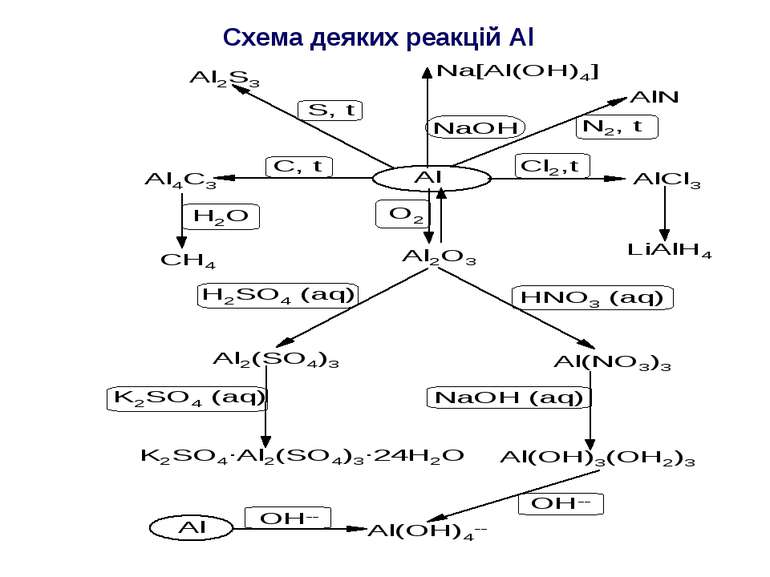
Добування металічного алюмінію електрохімічним методом Технологічна стадія підготовки сировини: 1)очищення бокситу Al2O3 zH2O від домішок заліза і SiO2; 2) очищений розчин алюмінату натрію розбавляють водою для гідролізу: Na[Al(OH)4] + H2O NaOH + Al(OH)3 і піддають “викручуванню”; 3) фільтрація кристалічного гідроксиду Al(OH)3 aq і термічна обробка при температурі 1100-12000С Al2O3; 4) електроліз Al2O3 (проводять при температурі 900-9500С; склад електроліту: 85-90% Na3AlF6, 10-15% Al2O3, сила струму 130000 А, напруга 4-5В) з метою одержання металічного алюмінію.
Фізічні властивості алюмінію Проста речовина алюміній являє собою сріблясто-білий метал, дуже легкий (питома маса = 2.7 г/см3), легкоплавкий (т.пл=6580С). Алюміній в чистому вигляді – м’який метал, який витримує навантаження 6 кг/см2. Хімічні властивості алюмінію Алюміній, взаємодіючи з водою, витісняє водень: 2Al + 6H2O 2Al(OH)3 + 3H2 На поверхні алюмінію є оксидна плівка: 4Al + 3O2 2Al2O3 Завдяки високій спорідненості металічного Al до кисню, алюміній має яскраво виражені відновні властивості. Бекетов запропонував ще в 60-х роках минулого століття використовувати порошок алюмінію для відновлення металів із оксидів (алюмотермія). Al взаємодіє з водою в присутності лугів: Al + 3H2O Al(OH)3 + 3/2H2 Утворення розчинних гідрокомплексів зміщує рівновагу такої реакції вправо і прискорює її протікання: Al(OH)3 + KOH K[Al(OH)4]
Складні сполуки алюмінію Типовими кисневими сполуками Al (III) є оксид алюмінію Al2O3; гідроксид алюмінію Al(OH)3 і алюмінати. Оксид алюмінію (ІІІ) має кілька кристалічних модифікацій. Найважливіша модифікація - Al2O3 – корунд. Він плавиться при 2070С і кипить при 35000С. За шкалою Мооса твердість корунду 9. Хімічна інертність висока, що дозволяє використовувати корундові тиглі при проведенні лабораторних експериментів в жорстких умовах. Сильно прожарений корунд майже не взаємодіє з водою. Al2O3 належить до класичних амфотерних оксидів і дає два види сполук: 1) солі, в яких Al (ІІІ) виконує роль катіона; 2) алюмінати, де Al (ІІІ) виконує роль аніоноутворювача.
Гідроксид алюмінію (ІІІ) добувають взаємодією розчинних солей Al(III) з аміаком: Al2(SO4)3 + 6NH4OH 2Al(OH)3 + 3(NH4)2SO4 Гідроксид Al(OH)3 погано розчиняється у воді, через його полімеризацію. При зберіганні відбувається “старіння” внаслідок протікання процесів оляції і оксоляції:[Al(OH)3]n [AlO(OH)]n + nH2O [AlO(OH)]n 1/2nAl2O3 + 1/2nH2O Старіння Al(OH)3 супроводжується зменшенням реакційної здатності. Гідроксид Al(OH)3 розчиняється в кислотах і лугах, що свідчить про його амфотерність. Розчинення в кислотах є наслідком процесу нейтралізації: 2Al(OH)3+3H2SO4 Al2(SO4)3+ 6H2O Розчинення в лугах є наслідком процесу комплексоутворення, причому іони гідроксилу виконують роль ліганду: Al(OH)3 + KOH K[Al(OH)4] або Al(OH)3 + 3KOH K3[Al(OH)6] Склад алюмінатів в розчині спрощено виражають формулами MеAlO2, Mе3AlO3 і т.д. Алюмінати типу МеАlO2 утворюються при спіканні гідратованого в розчині Al(OH)3 з лугами або содою: 2Al(OH)3 + Na2CO3 2NaAlO2 + CO2 + 3H2O Алюмінати, які синтезували шляхом спікання, під дією води перетворюються в гідроксоалюмінати: NaAlO2+4H2O Na[Al(OH)4(H2O)2]
Солі алюмінію (ІІІ) Безводні солі алюмінію за властивостями і будовою відрізняються від відповідних гідратів. Наприклад, хлорид Al (ІІІ), який в безводному стані більш схожий на хлорангідрид, чим на сіль; безводний AlCl3 характеризується координаційним числом 4. Розчиняючись у воді, галогеніди Al (ІІІ) піддаються гідролізу. При нагріванні відповідних гідратів відбувається гідроліз: [Al(H2O)6]Cl3 Al(OH)3 + 3HCl + 3H2O з поступовим перетворенням Al(ОН)3 в Al2О3. Солі Al (ІІІ), утворені слабкими кислотами, піддаються гідролізу, й існувати в гідратованому стані не можуть. Із водних розчинів, які містять, наприклад, AlCl3 i Na2S сульфід алюмінію добути не можливо. Дійсно, AlCl3 i Na2S, сумісно перебуваючи у водному розчині, “доводять” гідроліз один одного до кінця, і сульфід Al2S3 не утворюється: 2AlCl3 + 3Na2S + 6H2O 2Al(OH)3 + 3H2S + 6NaCl
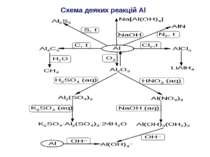
Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; Li[AlH4] + 4H2O 4H2 + LiOH + Al(OH)3; Al2O3 + 3Si 2SiO + Al2O (Al2O – газоподібна речовина, реакція проходить при 18000С); AlCl3 + 2Al 3AlCl; AlN + 2NaOH + 6H2O 2Na[Al(OH)4] + 2NH3; AlP + 3H2O Al(OH)3 + PH3;
Схожі презентації
Категорії





























![Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ... Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ...](https://svitppt.com.ua/images/10/9526/770/img34.jpg)































![Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ... Бінарні сполуки Al AlCl3 + 3LiH AlH3 + 3LiCl; 4LiH + AlCl3 Li[AlH4] + 3LiCl; ...](https://svitppt.com.ua/images/10/9526/210/img34.jpg)