Презентація на тему:
Хімічні елементи, їх класифікація. Людина і біосфера. Гідроген та його сполуки. s-елементи ІА групи. Лужні метали
Завантажити презентацію
Хімічні елементи, їх класифікація. Людина і біосфера. Гідроген та його сполуки. s-елементи ІА групи. Лужні метали
Завантажити презентаціюПрезентація по слайдам:
Хімічні елементи, їх класифікація. Людина і біосфера. Гідроген та його сполуки. s-елементи ІА групи. Лужні метали Поняття про хімічні елементи, їх класифікація за походженням, хімічними властивостями, будовою зовнішнього енергетичного рівня, поширенням у природі, значенням для організму. Класифікація біоелементів, їх вміст у організмі. Зв’язок фізико-хімічних параметрів елементів з їх положенням у періодичній системі і вмістом в організмі. Вчення В.Вернадського про біосферу і біогеохімію. Поняття про міграцію хімічних елементів. Зв’язок ендемічних захворювань з особливостями біогеохімічних провінцій. Людина і біосфера. Ноосфера. Технічний прогрес і екологія. Загальна характеристика елемента. Особливості положення в ПСЕ. Водень як проста речовина. Особливості поведінки Гідрогену в сполуках з сильно- і слабополярними зв’язками. Йони Гідрогену і гідроксонію. Реакції водню з киснем, галогенами, металами, оксидами. Характеристика і реакційна здатність зв’язку Гідрогену з іншими поширеними елементами. Вода як важлива сполука Гідрогену, її фізичні та хімічні властивості. Аквакомплекси і кристалогідрати. Дистильована, очищена та апірогенна вода, одержання та застосування у фармації. Природні води, екологічні забруднення води, типи мінеральних вод. Пероксид гідрогену. Будова молекули, одержання, кислотно-основні та окисно-відновні характеристики, використання в медицині і фармації. Загальна характеристика s-елементів ІА групи. Поширення в природі. Біологічна роль елементів у мінеральному балансі організму. Макроелементи, їх вміст у організмі. Йонофори та їх роль у мембранному перенесенні йонів Калію і Натрію. Характеристика йонного стану цих елементів. Металічний стан лужних металів. Відмінність Літію від інших лужних металів. Взаємодія з простими і складними речовинами. Бінарні сполуки лужних металів: гідриди, оксиди, пероксиди, супероксиди, озоніди. Гідроксиди лужних металів, солі та їх властивості, застосування. Хімічні основи застосування сполук Літію, Натрію і Калію в медицині.
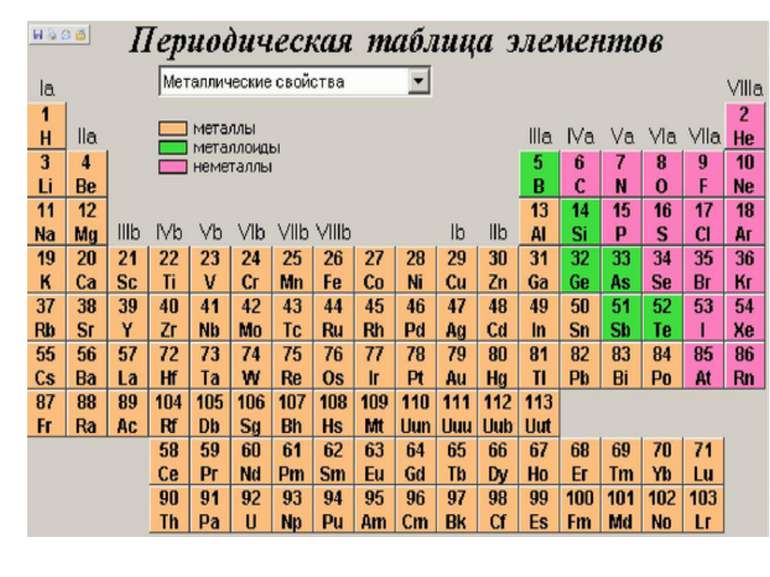
Загальні властивості металів Металічний блиск, тепло- і електропровідність ковкість, пластичність
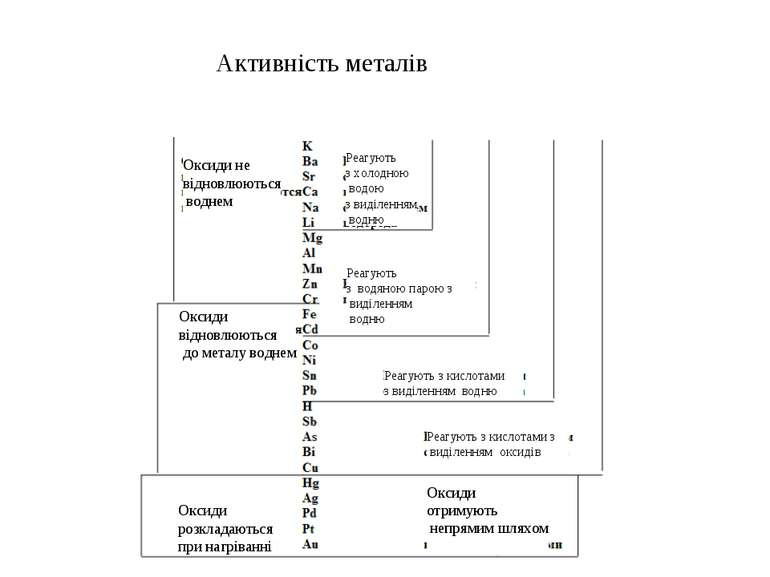
Активність металів Оксиди не відновлюються воднем Оксиди відновлюються до металу воднем Оксиди розкладаються при нагріванні Оксиди отримують непрямим шляхом Реагують з холодною водою з виділенням водню Реагують з кислотами з виділенням оксидів Реагують з кислотами з виділенням водню Реагують з водяною парою з виділенням водню
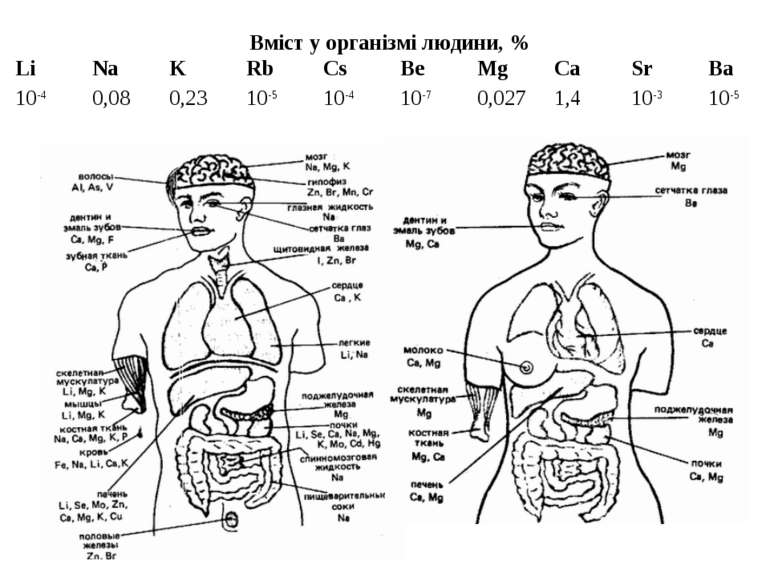
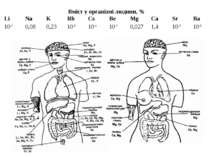
Вміст у організмі людини, % Li Na K Rb Cs Be Mg Ca Sr Ba 10-4 0,08 0,23 10-5 10-4 10-7 0,027 1,4 10-3 10-5
Гідроген H - перший елемент в періодичній системі, найпоширеніший елемент у Всесвіту (92%); у земній корі масова частка водню складає всього 1%. Вперше виділений в чистому виді Г. Кавендишем в 1766 р. У 1787г. А.Лавуазье довів, що водень - хімічний елемент. Атом водню складається з ядра і одного електрона. Електронна конфігурація - 1S1. Молекула водню двоатомна. Зв'язок ковалентний неполярний. Радіус атома - (0,08 нм); ступені окислення - (-1; +1). Ізотопи: 1Н - протій (99,98% по масі);1 2D - дейтерій (0,02%);1 3T - тритій (отриманий штучно).1
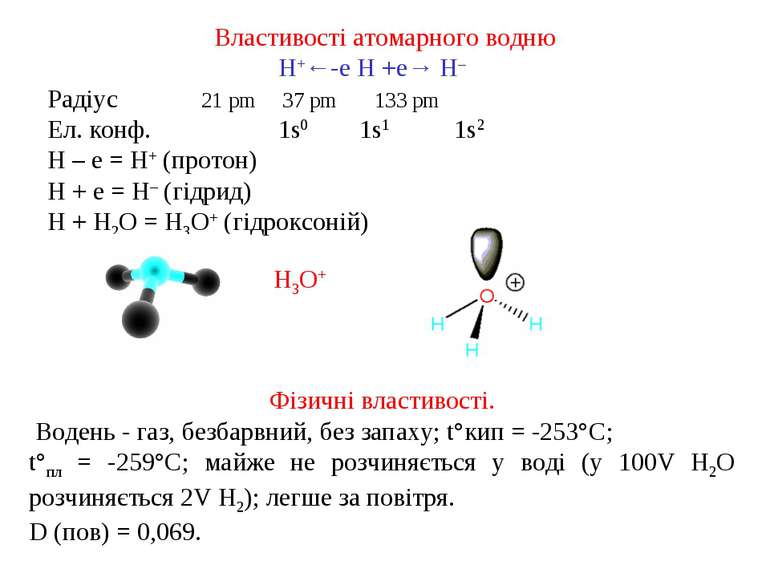
Властивості атомарного водню H+←-е H +е→ H– Радіус 21 pm 37 pm 133 pm Ел. конф. 1s0 1s1 1s2 H – e = H+ (протон) H + e = H– (гідрид) H + H2O = H3O+ (гідроксоній) Н3О+ Фізичні властивості. Водень - газ, безбарвний, без запаху; t°кип = -253°C; t°пл = -259°C; майже не розчиняється у воді (у 100V H2O розчиняється 2V H2); легше за повітря. D (пов) = 0,069.
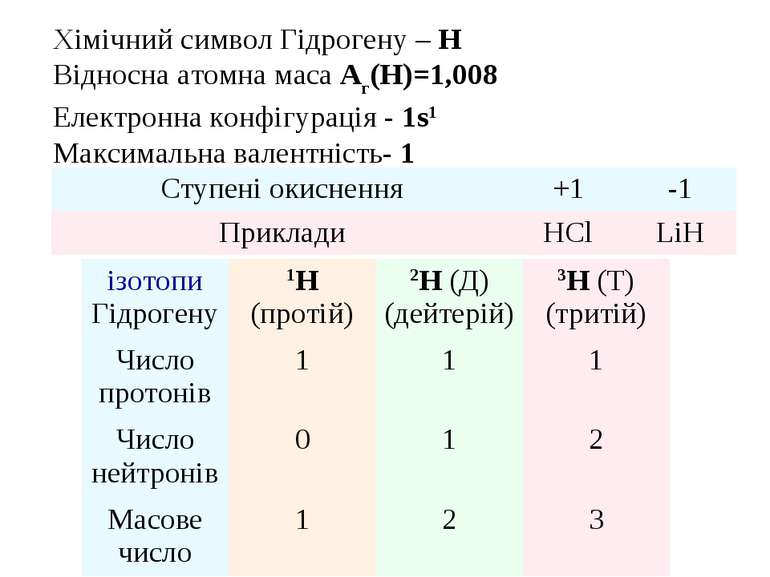
Хімічний символ Гідрогену – Н Відносна атомна маса Аг(H)=1,008 Електронна конфігурація - 1s1 Максимальна валентність- 1 Ступені окиснення +1 -1 Приклади HCl LiH ізотопи Гідрогену 1H (протій) 2H (Д) (дейтерій) 3H (Т) (тритій) Число протонів 1 1 1 Число нейтронів 0 1 2 Масове число 1 2 3
Отримання 1) взаємодія активних металів з кислотами - неокисниками: Zn + 2HCl → ZnCl2 + H2 2) взаємодія алюмінію (або цинку) з водними розчинами лугів: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4]+ 3H2 3) електроліз води і водних розчинів лугів і солей: 2H2O → 2H2 + O2 2NaCl + 2H2O → H2 + Cl2 + 2NaOH 4) пропускання пари води над розжареним вугіллям при 1000°C: C + H2O → CO + H2 5) конверсія метану при 900°C: CH4 + H2O → CO + 3H2 Методи (1,2) використовують в лабораторії, (3-5) використовують в промисловості. Способи збирання Витісненням повітря Витісненням води
Хімічні властивості За звичайних умов водень малоактивний (реагує тільки з фтором) Відновні властивості: 1) з неметалами: 2H20 + O2 → 2H2+1O (з вибухом при підпалі) H20 + S (150-250°) → H2+1S 3H20+N2(p;t°)→ 2NH3+1 (у присутності залізного каталізатора) H20 + F2 → 2HF (з вибухом) H2 + I2 (t°) → 2H+1I-1 2) з оксидами металів: H20 + СuO (t°) → Cu + H2O (метод отримання малоактивних металів Pb, Мо, W, Ni, Cu і ін. з їх оксидів) Окисні властивості 3) з лужними і лужноземельними металами: H20 + 2Li0 → 2Li+1H-1 H20 + Ca0 → Ca+2H2-1 Гідриди MeHn - сильні відновники за рахунок водню в ступені окислення (-1). Розкладаються водою і кислотами: NаH + H2O → NаOH + H2 CaH2 + 2H2O → Ca(OH)2 + 2H2 LIH + HCl → LiCl + H2
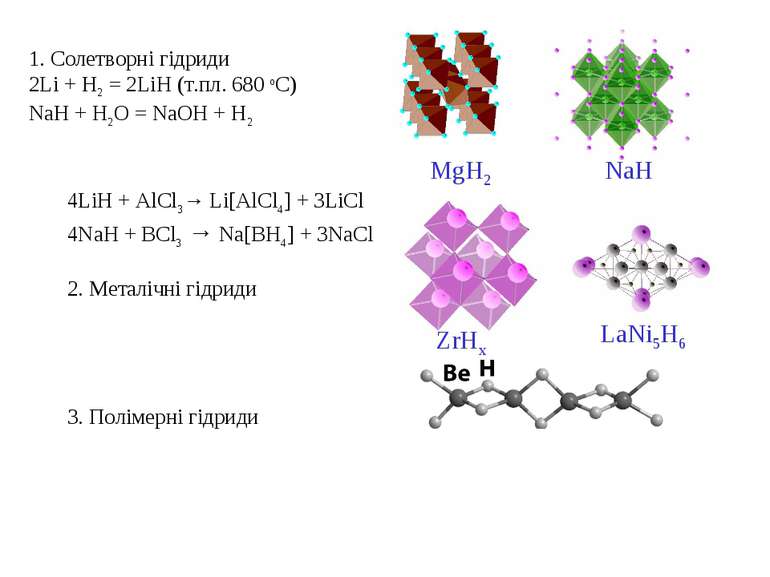
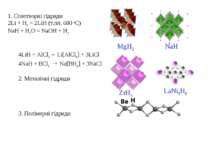
1. Солетворні гідриди 2Li + H2 = 2LiH (т.пл. 680 оС) NaH + H2O = NaOH + H2 4LiH + AlCl3→ Li[AlCl4] + 3LiCl 4NaH + BCl3 → Na[BH4] + 3NaCl 2. Металічні гідриди 3. Полімерні гідриди MgH2 NaH ZrHx LaNi5H6
Жосткий дирижабль LZ-129 "Гинденбург" (1936) Об’єм 200.000 м3, довжина 248 м, діаметр 41 м, грузопід’ємність-120 т, швидкість-135 км/год. Вибух дирижабля «Гинденбург» 06.05.1937 Застосування 1) Для промислового синтезу NH3, HCl, CH3OH (реакцією CO + 2H2 (p;t°;kat) → CH3OH) 2) Відновлення рідкісних металів з оксидів (W, Мо і ін.). 3) Гідрування органічних сполук (зокрема, гідрогенізація рослинних масел в тверді жири). 4) Для зварки і різання металів воднево-кисневим полум'ям.
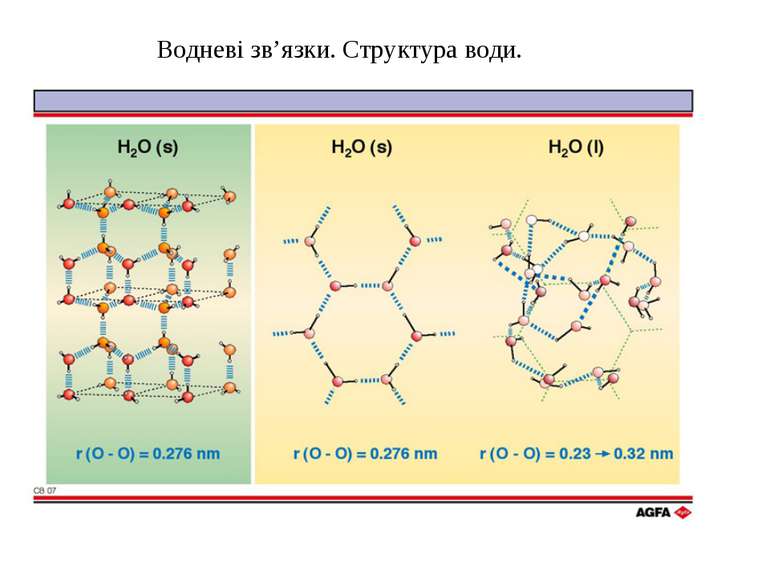
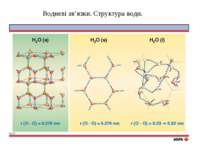
D2O “тяжка” вода sp3 гібридизація ВОДА Вода H2O - найпоширеніша в природі хімічна сполука. Запаси води на Землі: у морях і океанах - 1,4 млрд. км3 у льодовиках - 30 млн. км3 у річках і озерах - 2 млн. км3 у атмосфері - 14 тис. км3 у живих організмах - 65% Молекула полярна; кут -104,5°; зв'язок O–H ковалентний полярний. Вода є дипольним розчинником (розчиняє багато газів, рідкі і тверді речовини). Між молекулами води - водневі зв'язки:
Кислотний-основні властивості 1) Слабкий електроліт: H2O → H+ + OH- 2) Вода – амфотерна речовина. Вона реагує як з основними оксидами (оксидами лужних і лужноземельних металів), так і з кислотними оксидами (окрім SiO2): Li2O + H2O → 2LiOH MgO + H2O → → Mg(OH)2 SO3 + H2O → H2SO4 3) Гідроліз деяких солей приводить до їх повного розкладання: Al2S3 + 6H2O → 2Al(OH)3 ↓+ 3H2S Al2(CO3)3 + 6H2O → 2Al(OH)3 ↓ + 3H2O + 3CO2 4) Вода розкладає гідриди, фосфіди, карбіди, нітриди і деякі інші бінарні сполуки активних металів з неметалами: CaH2 + 2H2O → Ca(OH)2 + 2H2 Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 CaC2 + 2H2O → Ca(OH)2 + C2H2 Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3 5) Молекули води з деякими солями дають кристалогідрати: CuSO4 (білий) + 5H2O → CuSO4·5H2O (синій)
Окисно-відновні властивості 6) З активними металами (що стоять у ряді напруги металів до Mg включно) утворюється луг і водень, а з металами середньої активності (що стоять у ряді напруги металів від Mg до Pb) - оксид і водень: 2Na + 2H2O → 2NaOH + H2 Ca + 2H2O → Ca(OH)2 + H2 3Fe + 4H2O (t°) → Fe3O4 + 4H2 7) З галогенами (продукти різні): 4F2 + 3H2O → OF2+ 6HF + O2 Cl2 + H2O → HClO + HCl Аномалії води: 1) Лід плаває на поверхні водоймища, ƍ(льоду)=0,92 г/см3, max ƍ(води) при+4°С= 1г/см3 2) При замерзанні води відбувається розширення об'єму. 3) Найбільша теплоємність (у 3100 разів більше, ніж у повітря; у 4 рази більше, ніж у гірських порід).
Пероксид водню Хімічні властивості 1. Розкладання: 2H2O2 → 2H2O + O2 На світлі і при нагріванні ця реакція може протікати з вибухом; при використанні каталізаторів (MnO2, каталаза) цього можна уникнути. 2. Окисні і відновні властивості H2O2. 4Н2О2 +PbS →PbSO4+4H2O 5H2O2+2KMnO4+3H2O →5O2↑+2MnSO4+K2SO4+8H2O Пероксид (перекис) водню H2O2 відкритий в 1818 р. Л. Ж. Тенаром при дії розбавлених кислот на BaO2 і отримав назву "Окисненої води". Фізичні властивості Безбарвна рідина, яку можна перегонити без розкладання при зниженому тиску. t°пл = -0,8°C, t°кип = 152,8°С
Отримання Гідроліз його похідних: 1. BaO2 + 2H2O → H2O2 + Ba(OH)2 2. H2S2O8 + 2H2O → H2O2 + 2H2SO4 Проводиться майже завжди по другому варіанту (електрохімічним способом). Отримані слабкі розчини H2O2 концентрують в керамікових колонах. Перекис водню можна отримати грунтуючись на здатності деяких речовин окислюватися при звичайній температурі, наприклад, при пропусканні О2 в розчин гідразобензолу в бензолі виходить 94%-ний розчину H2O2 з виходом до 97%. Застосування Вибілювання шовку, шерсті, пера, хутра, воску і т. п., для реставрації картин (відновлення первинного кольору фарб), в харчовій промисловості для консервації молока, в медицині як дезінфікуючий засіб, в хімічному виробництві, в реактивній техніці. Зберігання У тарі із спеціальних пластмас або чистого алюмінію.
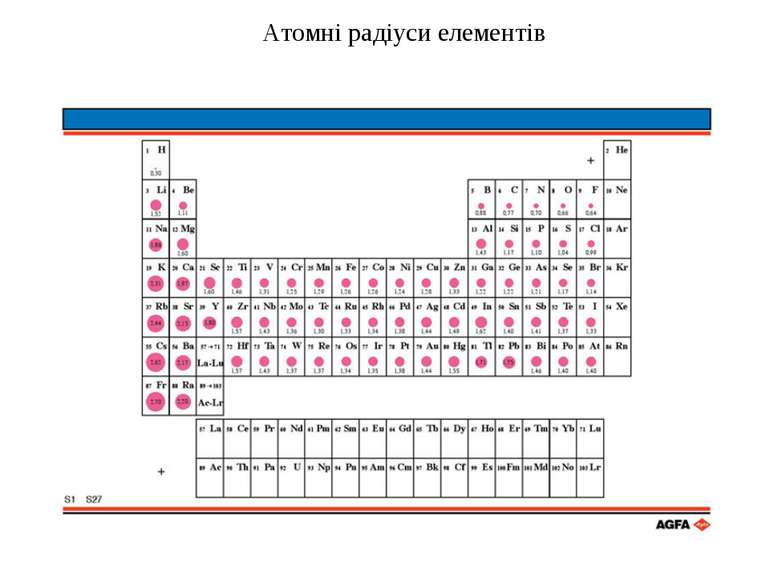
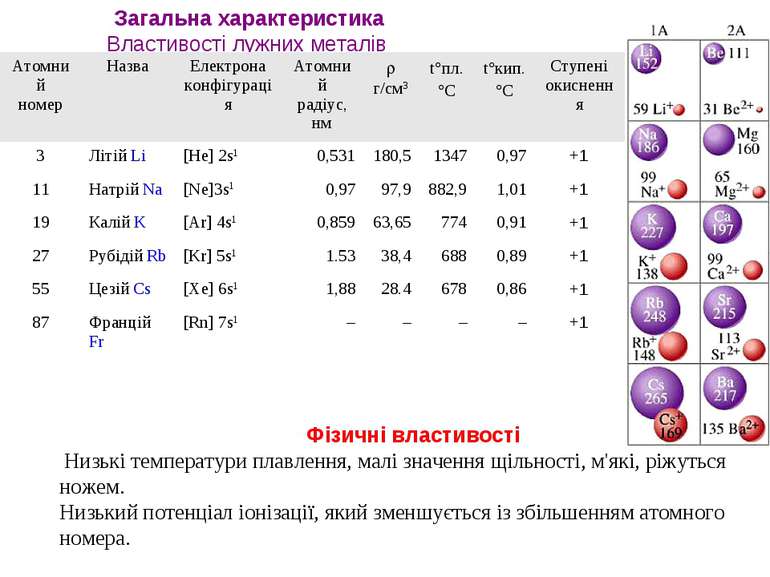
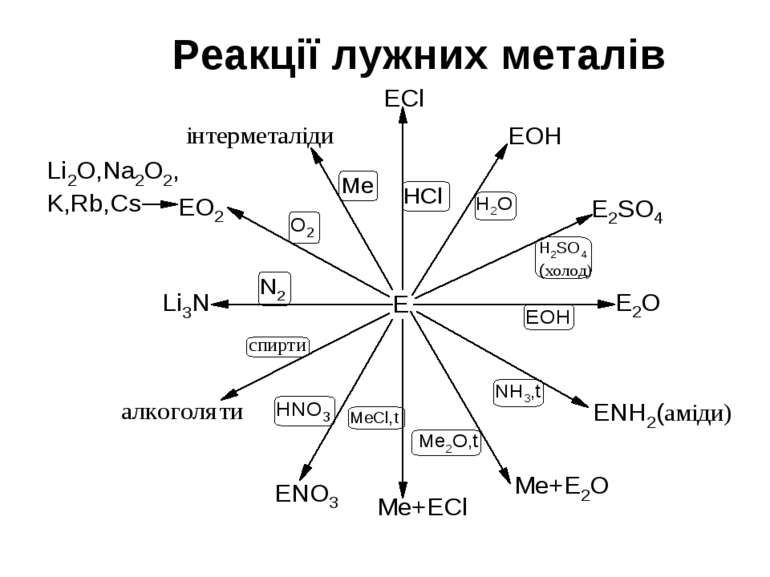
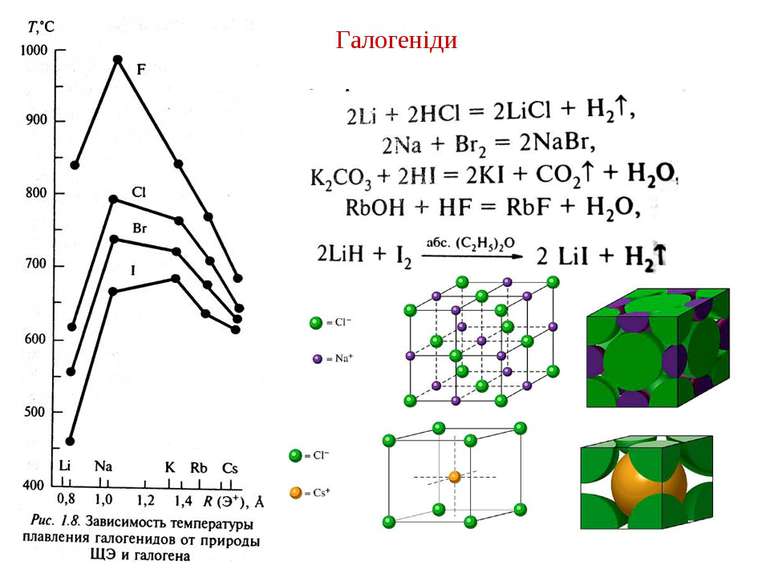
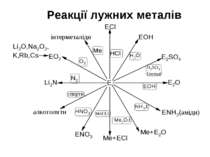
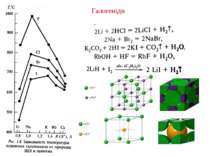
Загальна характеристика Властивості лужних металів Фізичні властивості Низькі температури плавлення, малі значення щільності, м'які, ріжуться ножем. Низький потенціал іонізації, який зменшується із збільшенням атомного номера. Атомний номер Назва Електрона конфігурація Атомний радіус, нм r г/см3 t°пл. °С t°кип. °С Ступені окиснення 3 Літій Li [He] 2s1 0,531 180,5 1347 0,97 +1 11 Натрій Na [Ne]3s1 0,97 97,9 882,9 1,01 +1 19 Калій K [Ar] 4s1 0,859 63,65 774 0,91 +1 27 Рубідій Rb [Kr] 5s1 1.53 38,4 688 0,89 +1 55 Цезій Cs [Xe] 6s1 1,88 28.4 678 0,86 +1 87 Францій Fr [Rn] 7s1 – – – – +1
Плавлення лужних металів На відміну від інших твердих металів характер плавлення натрію змінюється при накладанні додаткового тиску
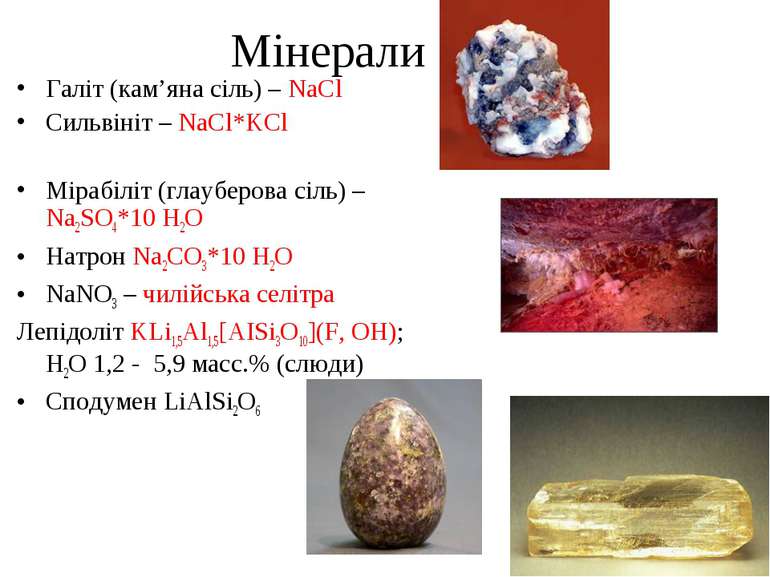
Мінерали Галіт (кам’яна сіль) – NaCl Сильвініт – NaCl*KCl Мірабіліт (глауберова сіль) – Na2SO4*10 H2O Натрон Na2CO3*10 H2O NaNO3 – чилійська селітра Лепідоліт KLi1,5Al1,5[AISi3О10](F, ОН); H2О 1,2 - 5,9 масс.% (слюди) Сподумен LiAlSi2O6
Хімічні властивості Всі лужні метали - дуже сильні відновники, в сполуках проявляють єдиний ступінь окислення +1. Відновна здатність збільшується в ряду –Li–Na–K–Rb–Cs. Всі сполуки лужних металів мають іонний характер. Практично всі солі розчинні у воді. 1. Активно взаємодіють з водою: 2Na + 2H2O → 2NaOH + H2 2Li + 2H2O → 2LiOH + H2 2. Реакція з кислотами: 2Na + 2HCl → 2NaCl + H2 3. Реакція з киснем: 4Li + O2 → 2Li2O(оксид літію) 2Na + O2 → Na2O2(пероксид натрію) K + O2 → KO2(надпероксид калію) На повітрі лужні метали миттєво окислюються. Тому їх зберігають під шаром органічних розчинників (гас і ін.). 4. У реакціях з іншими неметалами утворюються бінарні сполуки: 2Li + Cl2 → 2LiCl(галогеніди) 2Na + S → Na2S(сульфіди) 2Na + H2 → 2NaH(гідриди) 6Li + N2 → 2Li3N(нітриди) 2Li + 2C → 2Li2C2(карбіди) Реагують із спиртами і галогенопохідними вуглеводнів
Взаємодія металічного натрію з водою Na + H2O = NaOH + 0.5H2 Якщо перед взаємодією до води додати індикатора фенолфталеїну, то розчин забарвиться у фіолетовий колір, що свідчить про утворення лужного середовища.
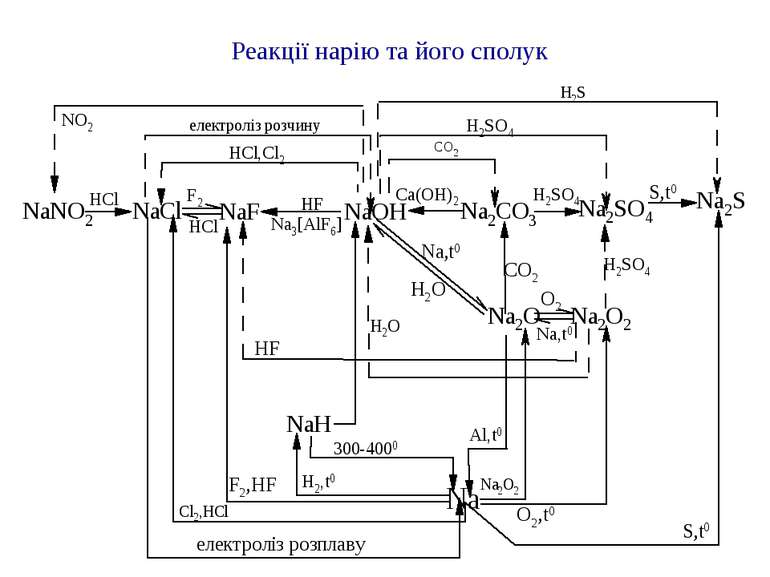
Оксиди лужних металів – R2O Отримання Окисленням металу виходить тільки оксид літію 4Li + O2 → 2Li2O (у решті випадків утворюються пероксиди або надпероксиди). Всі оксиди (окрім Li2O) отримують при нагріванні суміші пероксиду (або надпероксиду) з надлишком металу: Na2O2 + 2Na → 2Na2O KO2 + 3K → 2K2O Хімічні властивості Типові основні оксиди. Реагують з водою, кислотними оксидами і кислотами: Li2O + H2O → 2LiOH Na2O + SO3 → Na2SO4 K2O + 2HNO3 → 2KNO3 + H2O
Пероксид натрію Na2O2 Отримання 2Na + O2 → Na2O2 Хімічні властивості 1. Сильний окисник: 2NaI + Na2O2 + 2H2SO4 → I2 + 2Na2SO4 + 2H2O 2Na2O2 + 2CO2 → 2Na2CO3 + O2 2. Розкладається водою: Na2O2 + 2H2O → 2NaOH + H2O2 Надпероксид калію KO2 Отримання K + O2 → KO2 Хімічні властивості 1. Сильний окисник: 4KO2 + 2CO2 → 2K2CO3 + 3O2 2. Розкладається водою: 2KO2 + 2H2O → 2KOH + H2O2 + O2
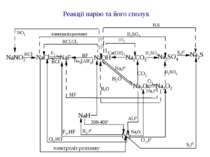
Гідроксиди лужних металів – ROH Білі, кристалічні речовини, гігроскопічні; добре розчинні у воді (з виділенням тепла). У водних розчинах без залишку дисоціюють. Отримання 1. Електроліз розчинів хлоридів: 2NaCl + 2H2O → 2NaOH + H2 + Cl2 катод: 2H+ + 2е → H02 анод: 2Cl- – 2е → Cl02 2. Обмінні реакції між сіллю і основою: K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH 3. Взаємодія металів або їх основних оксидів (або пероксидів і надпероксидів) з водою: 2Li + 2H2O → 2LiOH + H2 Li2O + H2O → 2LiOH Na2O2 + 2H2O → 2NaOH + H2O2 Хімічні властивості R–OH – сильні основи (луги) (основність збільшується у ряді LіOH – NaOH – KOH – RbOH –CsOH); реагують з кислотними оксидами і кислотами: 2NaOH + CO2 → Na2CO3 + H2O LiOH + HCl → LiCl + H2O При сплавлянні NаOH з ацетатом натрію утворюється метан: NaOH + CH3COONa (t°)→ Na2CO3 + CH4
Соди а) кальцинована сода, безводна сода або просто сода – натрій карбонат Na2CO3; б) кристалічна сода – кристалогідрат натрій карбонату Na2CO3·10H2O; в) питна сода– натрій гідрокарбонат NaHCO3; г) каустична сода або каустик (від грецького “їдкий”) – натрій гідроксид NaOH. Отримання соди Соду у промисловості отримують за методом Сольве (1863р): NaCl + NH4HCO3 = NaHCO3 + NH4Cl 2NaHCO3 = Na2CO3 + CO2 + H2O Аміак видаляють додаванням гашеного вапна: 2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
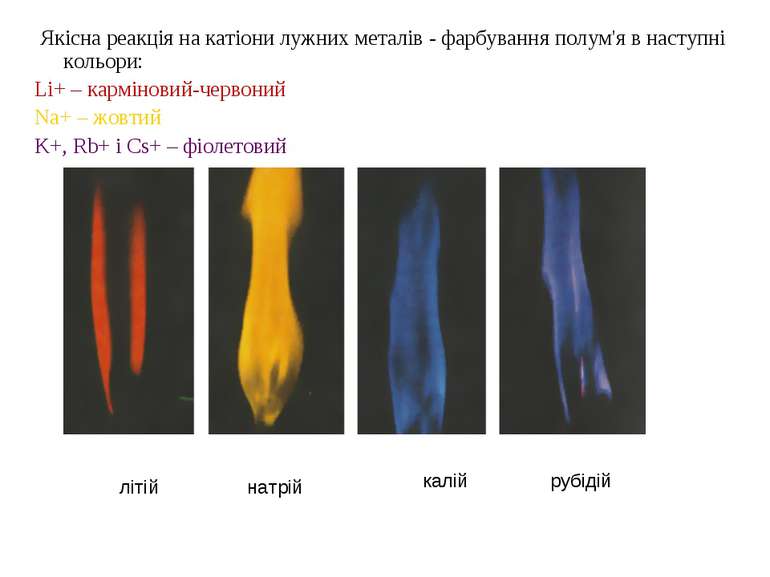
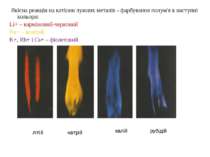
літій натрій калій рубідій Якісна реакція на катіони лужних металів - фарбування полум'я в наступні кольори: Li+ – карміновий-червоний Na+ – жовтий K+, Rb+ і Cs+ – фіолетовий
В сучасних системах регенерації дихального повітря, поглинання СО2 і виділення кисню для дихання зібрані в один процес, який протікає без енергетичних затрат: Na2O2 + 2CO2 + 2КО2 Na2CO3 + К2СО3 +2O2 ,
Схожі презентації
Категорії