Презентація на тему:
Комплексні сполуки
Завантажити презентацію
Комплексні сполуки
Завантажити презентаціюПрезентація по слайдам:
Комплексні сполуки. Комплексоутворення в біологічних системах. Лектор асистент кафедри фармацевтичної хімії Бурмас Наталія Іванівна e-mail: Natashenka-Burmas@rambler.ru
План лекції 1. Поняття про комплексні сполуки. Теорія Вернера. 2. Номенклатура комплексних сполук. 3. Класифікація та ізомерія комплексних сполук. 4. Хімічний зв’язок у комплексних сполуках. Поведінка комплексних сполук у розчинах. 5. Використання комплексних сполук у медицині.
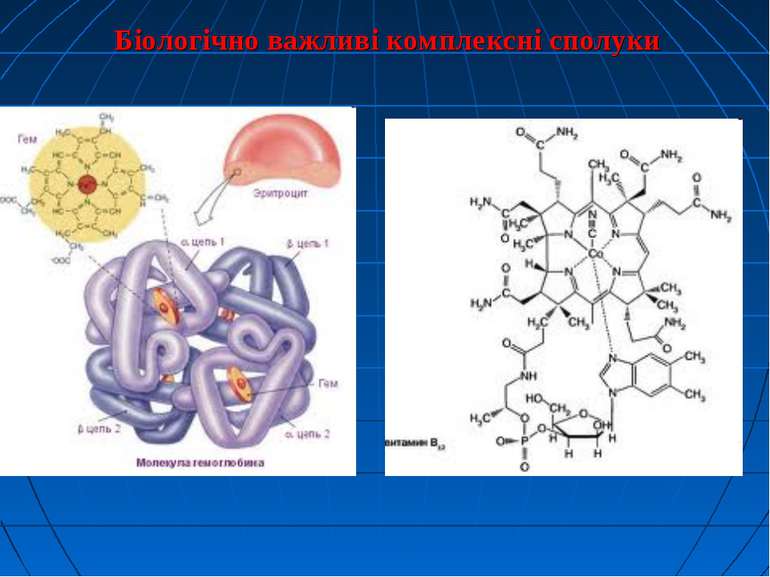
1. Поняття про комплексні сполуки. Теорія Вернера. Комплексні сполуки або координаційні сполуки – складні сполуки, в яких можна виділити центральний атом (комплексоутворювач) і безпосередньо зв’язані з ним молекули або йони - так звані ліганди або аденти. Центральний атом та ліганди утворюють внутрішню сферу (комплекс), молекули або йони, які оточують комплекс - зовнішню сферу. Центральним атомом можуть бути як метали, так і неметали.
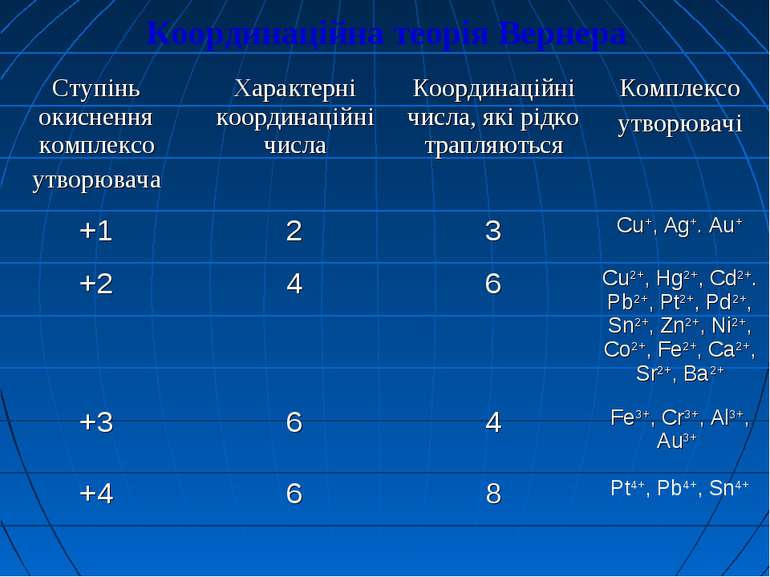
Основні положення координаційної теорії Вернера Найбільш вдало властивості і будову комплексних сполук пояснює координаційна теорія, запропонована в 1893 році шведським хіміком Альфредом Вернером. Комплексоутворювачем вважають центральний атом чи іон, до якого приєднуються нейтральні молекули або аніони. Найчастіше комплексо-утворювачами є катіони d-металів: Сu2+, Со2+, Fe3+, Сr 3+ і багато інших.
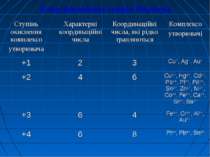
Лігандами (приєднаними частинками) називають молекули або іони, які координуються навколо комплексоутворювача. Координаційне число визначається числом місць у просторі, які може надавати комплексоутворювач для приєднання лігандів. Воно залежить як від природи комплексоутворювача, так і від харак теру лігандів.
Внутрішню координаційну сферу комплексної сполуки складають комплексоутворювач разом з лігандами, які приєдна лися відповідно до координаційного числа комплексоутворювача. Заряд внутрішньої координаційної сфери визначається сумою зарядів комплексоутворювача й усіх лігандів:
Протиіони — це іони зовнішньої сфери (катіони або аніони), які компенсують заряд внутрішньої координаційної сфери, щоб речовина загалом була електронейтральною. Якщо замінити зовнішні іони, властивості речовини змінюються мало, якщо ж змінити один з компонентів у внутрішній координаційній сфері комплек су, то утвориться нова сполука із зовсім іншими властивостями. Дентатність ліганду визначається числом атомів, які одночасно можуть утворювати зв'язки з комплексоутворювачем. Наприклад, молекула NН3 займає лише одне координаційне місце, і тому цей ліганд є монодентатним.
Комплексоутворювачі: Іони металів:Ag+, Cu2+, Cu+, Co3+, Al3+, Ni2+, Pb2+, Pt4+, Cr3+, Au3+, Fe2+, Fe3+ ... Атоми неметалів з позитивним ступенем окиснення: S+4, S+6, P+3 Ліганди: монодентантні (утворюють один хімічний зв’язок з центральним атомом) * одноатомні іони: S2-, F-, Cl-, I-, Br-; * складні іони: OH-, SO32-, CN-, NO2-, S2O32-, SO42-, NO3-; * нейтральні молекули: H2O, NH3, NH2OH, CH3NH2, C6H6, C5H5N. б) бідентантні (утворюють два хімічних зв’язки з центральним атомом) * складні іони: C2O42-, СO32-, SO42-(цей іон проявляє одночасно властивості моно- та бідентантного іону) * нейтральні молекули: NH2-NH2, NH2-CH2-CH2-NH2
[Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний атом) NH3 – ліганд (адденд) [Cu (NH3)4]2+ - комплексний іон (внутрішня координаційна сфера) SO42- - аніон (зовнішня координаційна сфера)
Називають електронегативні ліганди з закінченням на „о”: Cl-– хлоро, CN- – ціано, NО3- – нітро і т.д. 2. Називають катіон зовнішньої сфери позначаючи їх грецькими числівниками: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта 3. Якщо в сполуці присутні ліганди – нейтральні молекули, позначають і їх (NH3 – амін, H2O – акво). 4. Центральному атому дають латинську назву елемента з закінченням „ат” (якщо елемент має змінну ступінь окислення, її вказують в дужках римськими цифрами перед назвою елемента). К4[Fe(CN)6] – калій гексаціаноферат(ІІ) K3[Fe(CN)6] – калій гексаціаноферат (ІІІ) Na2[Zn(OH)4] – натрій тетрааквоцинкат 2. Номенклатура комплексних сполук Сполуки, що містять комплексний аніон
1. Називають аніон, що утворює зовнішню координаційну сферу (сульфат, нітрат). 2. Дають назву комплексному катіону: * називають електронегативні ліганди із закінченням на „о” * називають молекулярні ліганди із закінченням на „о” (якщо вони є) 3. Вказують кількість лігандів грецькими числівниками. 4. Називають центральний атом відповідно до української назви елемента в родовому відмінку [Ag(NH3)2]Cl – діамінсрібла (І) хлорид [Cr(H2O)6]Cl – гексааквохрому (ІІІ) хлорид Сполуки, що містять комплексний катіон
3. Класифікація та ізомерія комплексних сполук Існують класифікації комплексних сполук: По координаційному числу; По ступеню окиснення; По типу донорних атомів лігандів; По типу або природі координаційного зв’язку; По електронній конфігурації атома або іону металу.
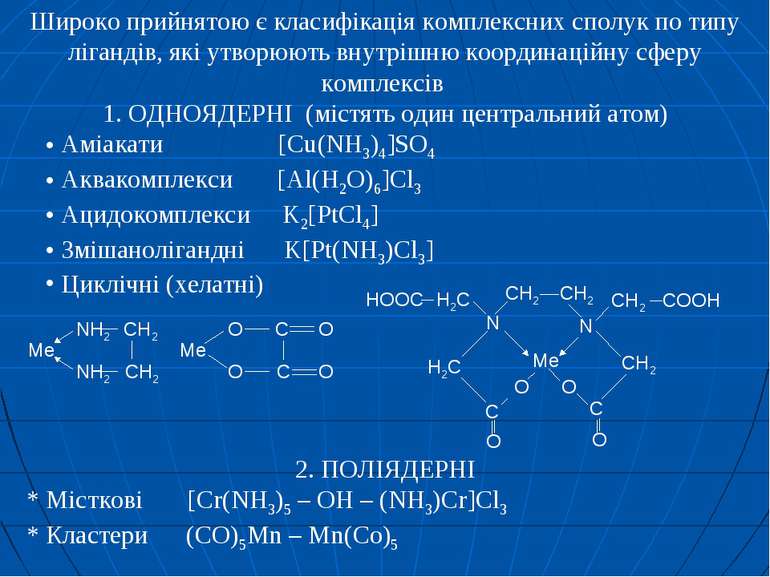
Широко прийнятою є класифікація комплексних сполук по типу лігандів, які утворюють внутрішню координаційну сферу комплексів 1. ОДНОЯДЕРНІ (містять один центральний атом) Аміакати [Cu(NH3)4]SO4 Аквакомплекси [Al(H2O)6]Cl3 Ацидокомплекси K2[PtCl4] Змішанолігандні K[Pt(NH3)Cl3] Циклічні (хелатні) 2. ПОЛІЯДЕРНІ * Місткові [Cr(NH3)5 – OH – (NH3)Cr]Cl3 * Кластери (CO)5Mn – Mn(Co)5
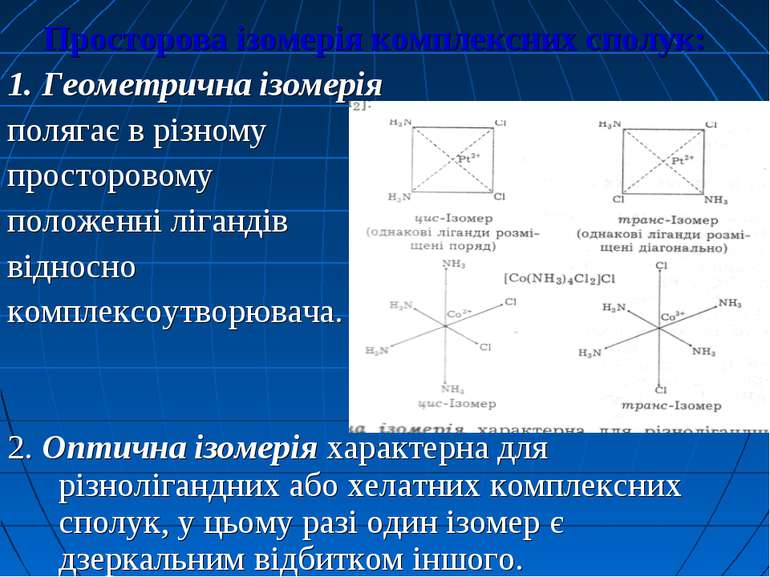
Ізомерія комплексних сполук Ізомерія – це явище існування сполук з однаковим хімічним складом, але з різною будовою і властивостями. Для координаційних сполук відомі такі види ізомерії: А. Просторова ізомерія: * Геометрична (цис- і транс-ізомерія); * Оптична Б. Структурна ізомерія: * Сольватна (гідратна) * Іонізаційна * Координаційна * Ізомерія зв’язку
Структурна ізомерія комплексних сполук: 1. Іонізаційна ізомерія полягає в різному розміщенні іонів у внутрішній і зовнішній сферах. 2. Гідратна ізомерія полягає в різному розміщенні молекул води у внутрішній і зовнішній координаційних сферах. Найкраще проявляється у солей хрому. 3. Ізомерія зв'язку. Деякі ліганди, наприклад іони СN‾ , NCS‾, NO²‾, мають по два донорні атоми і можуть координуватися різними способами, тобто є амбідентатними лігандами. 4. Координаційна ізомерія за якої комплексоутворювачі немовби обмінюються лігандами:
Просторова ізомерія комплексних сполук: 1. Геометрична ізомерія полягає в різному просторовому положенні лігандів відносно комплексоутворювача. 2. Оптична ізомерія характерна для різнолігандних або хелатних комплексних сполук, у цьому разі один ізомер є дзеркальним відбитком іншого.
4. Хімічний зв’язок у комплексних сполуках. Поведінка комплексних сполук у розчинах. У наш час для пояснення утворення, будови та властивостей комплексних сполук використовують три теорії: * метод валентних зв'язків, * теорію кристалічного поля, * метод молекулярних орбіталей.
Основні положення теорії кристалічного поля можна сформулювати так: 1. Комплексні сполуки стійко існують через електростатичну взаємодію центрального іона з лігандами. 2. Центральний іон розглядають з врахуванням його електронної будови і тих змін, які спричиняють ліганди своїм електростатичним полем. Ліганди розглядають тільки як носії певного заряду, а їх власну елетронну структуру не враховують. 3. Взаємодія між центральним атомом і лігандами кількісно описують законами і математичним апаратом квантової механіки. Недоліки. Не враховує участі електронів лігандів в утворенні хімічних зв’язків з центральним іоном і тому застосовується, головним чином, для комплексних сполук з переважно іонним характером зв’язку між центральним атомом і лігандами.
Метод валентних зв’язків Хімічні зв’язки, які виникають в процесі комплексоутворення, мають донорно-акцепторне походження, тобто утворюються за рахунок неподільної електронної пари одного із взаємодіючих атомів і вільної орбіталі другого атома. Отже, МВЗ пояснює певні значення КЧ і геометричні форми комплексних іонів або молекул. Але взаємодія між центральним атомом і лігандами в комплексних сполуках не зводться лише до донорно-акцепторної. Існують ліганди, які здатні приймати електрони металу на вакантні орбіталі, наприклад на вільні d – орбіталі. Такі ліганди називаються П – акцепторами, а зв’язок їх з центральним атомом П – дативним.
Метод молекулярних орбіталей В області координаційних з'єднань узагальнення, отримані на основі методу МО, названі теорією поля лігандів. Головна особливість її полягає в тому, що зважаючи зазвичай високої симетрії координаційного вузла МО молекули або іона координаційної сполуки класифікуються за поданнями симетрії і принципову схему їх утворення з орбіталей лігандів можна найчастіше побудувати, не проводячи конкретних розрахунків.
Поведінка комплексних сполук у розчинах Розрізняють первинну та вторинну дисоціацію сполук. У розчині кожна молекула комплексної сполуки розпадається на комплексний іон та іони зовнішньої сфери. Оскільки іони зв'язані з катіонами та аніонами зовнішньої сфери за допомогою іонного зв’язку, первинна дисоціація комплексних сполук перебігає за типом сильних електролітів. Процес дисоціації необоротній. Тому йони зовнішьої сфери повністю взаємодіють з реактивами, які утворюють з ними важкорозчинні сполуки:
Комплексні іони, у свою чергу , підлягають вторинній дисоціації, внаслідок якої відщеплюють ліганди. Така дисоціація протікає за типом слабких електролітів. Цей етап дисоціації є ступінчастим і оборотнім: Сумарний процес виражають за рівнянням реакції:
5. Використання комплексних сполук у медицині. - Сполуки Ауруму з прадавніх часів використовували для лікування прокази. Нині комплекси цього металу застосовують для лікування ревматоїдних артритів, наприклад хризолан Na3[Au(S2O3)2]. Комплексні сполуки Цинку широко використовують у дерматології як протимікробні засоби. Карбоніли Феруму, зокрема ферроцерон (натрієва сіль карбоксибензоїл-ферроцену) належить до нових медичних препаратів для лікування ферумдефіцитних (залізодефіцитних) анемій.
Дайте будь-ласка відповіді на дані запитання: 1. Що таке комплексні сполуки? 2. У чому полягаєсуть суть координаційної теорії Верненра? 3. Застосування комплексних сполук у медицині. Ваші відповіді присилайте на даний e-mail: Natashenka-Burmas@rambler.ru
Схожі презентації
Категорії









![[Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний ато... [Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний ато...](https://svitppt.com.ua/images/9/8132/770/img9.jpg)






















![[Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний ато... [Cu (NH3)4] SO4 комплексна сполука Cu2+ - комплексоутворювач (центральний ато...](https://svitppt.com.ua/images/9/8132/210/img9.jpg)