Презентація на тему:
Кислоти. Фізичні і хімічні властивості кислот. Ряд активності металів. Заходи безпеки під час роботи з кислотами
Завантажити презентацію
Кислоти. Фізичні і хімічні властивості кислот. Ряд активності металів. Заходи безпеки під час роботи з кислотами
Завантажити презентаціюПрезентація по слайдам:
Урок на тему: “Кислоти. Фізичні і хімічні властивості кислот. Ряд активності металів. Заходи безпеки під час роботи з кислотами” Михайлюк Галина Анатоліївна учитель біології, хімії, спеціаліст вищої категорії, Вчитель – методист ЗОШ І-ІІІ ступенів смт Раухівка Березівського району Одеської області
Очікуванні результати: - закріпити знання про хімічні властивості кислот; - закріпити вміння використовувати ряд напруг металів, складаючи хімічні реакції, що відбуваються за участі металів; - знати правила техніки безпеки під час роботи з кислотами - розвивати навички складання хімічних реакції;
«Візьміть із собою в багаж» 1.Класифікуйте речовини: HCl, СO2, H2O, N2O5, NaOH, NH3, Cl2, СO, N2O, H2SO4, KOH, NH3, CaO, Mg(OH)2, NaOH, Na2CO3, P2O5, NO, NH3, Al(OH)3 Ca(OH)2, H2CO3, P2O5, NO,KOH, HNO3 Знання
Карта мандрівки 1.Порт «ПРИРОДНИЙ» 2.Порт «ІСТОРИЧНИЙ» 3.Порт «ПРАВИЛА ТБ» 4.Порт «ІНДИКАТОРНИЙ» 5.Порт«ФІЗИЧНИЙ» 6.Порт « ХІМІЧНИЙ» 8Порт «ВідГАДАЙ» 7, Порт “ІНФОРМАЦІЙНИЙ”
В природі існує велика кількість різних кислот. Де ви зустрічалися з кислотами? Виберіть продукти до складу яких входять кислоти.
Пора відправитися в гості.Але, щоб попасти в дім, необхідно згадати адресу хазяїв. Згадаємо? 1.Що спільного у всіх кислот: H2SO4, HCL, H2CO3, HNO3, H3PO4, H2S ? 2.Чим відрізняються кислоти? H2CO3 і HCL, H2SO4 і H2S, H3PO4 і НF? 3. За якою ознакою ще можливий поділ кислот на групи?
Визначте валентність кислотних залишків слідуючих кислот: Кислота Кислотний залишок HCL- хлороводнева ? - хлорид H2SO4- сірчана ? – сульфат H3PO4- ортофосфатна ? – ортофосфат H3BO3- борна ? – борат H2CO3- карбонатна ? – карбонат H2SiO3- силікатна ? – силікат H2S- сульфідна ? – сульфід HF- фтороводнева ? – фторид HNO3- нітратна ? – нітрат
Ми потрапили в кімнату, де багато гостей. Необхідно знайти хазяїв і впізнати їх ( виписати формули кислот). MgCL2, H2SO4, Ca(OH)2, CuSO4, H2O, HCL, Fe2O3, NaOH, HF, ZnCL2, H2CO3, MgO, O2, H3PO4, KOH, H2, H2SiO4. Кислоти – великі витівники і вирішили пограти з вами в гру «третій зайвий»: А) BaO, HNO3, HCL; B) Na2SO4,H2S,H2SO4; Б) H2CO3, HF, H2O; Г) H3PO4, H2, H2SiO3.
1.Чому найпершою кислотою, яку відкрила людина була оцтова кислота? 2. Чому сірчану кислоту називають «матір’ю» всіх кислот? 3.Суміш яких кислот називають «царська водка»? HCL 4.Яка кислота входить до складу шлункового соку?
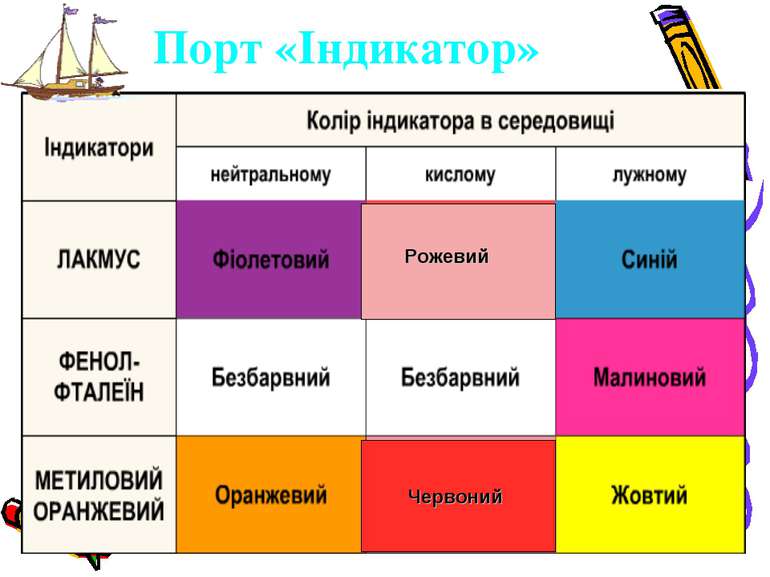
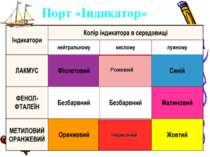
Порт “ФІЗИЧНИЙ” Фізичні властивості кислот. За стандартних умов багато кислот — рідини (H2S04, HN03), але є й тверді кислоти — ортофосфатна Н3Р04, метафосфатна НРОз, силікатна (драглиста маса) H2Si03. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN03), вони мають задушливий запах. Майже всі кислоти безбарвні.
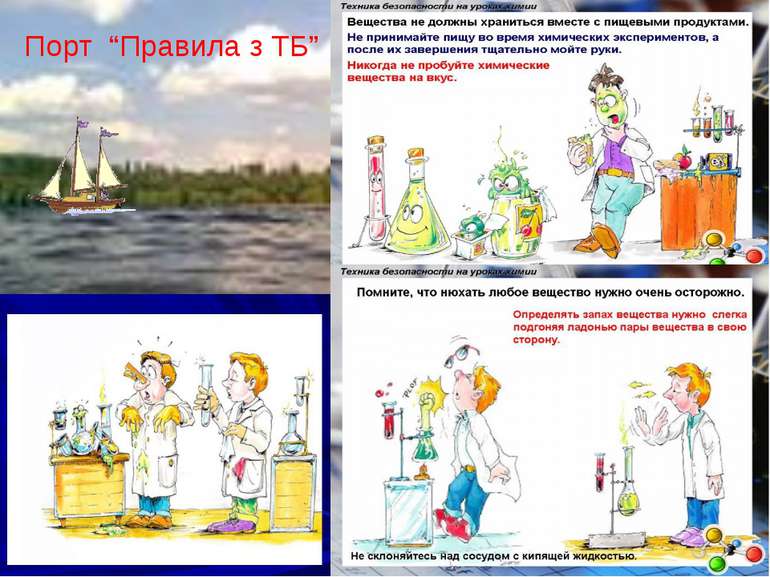
1. Під час роботи з кислотами слід бути обережним. Особливо слід берегти очі. У разі потрапляння кислоти на руки необхідно негайно змити її великою кількістю води. 2. Уважно читайте етикетку на банці з речовиною, яку берете для досліду. 3. Відкривши банку, не кладіть пробку на лабораторний стіл, а поставте її в лабораторний ящик. 4. Наливаючи рідини, посудину з реактивом беріть так, щоб етикетка була направлена в бік долоні, знімайте краплю з краю шийки, інакше рідина стікатиме по склу та псуватиме етикетку, може пошкодити шкіру рук. 5. Посудину, з якої взяли реактив, відразу ж закрийте та поставте на місце. 6.У разі потрапляння кислоти на руки або лице, шкіру необхідно промити водою або 3% розчином соди.
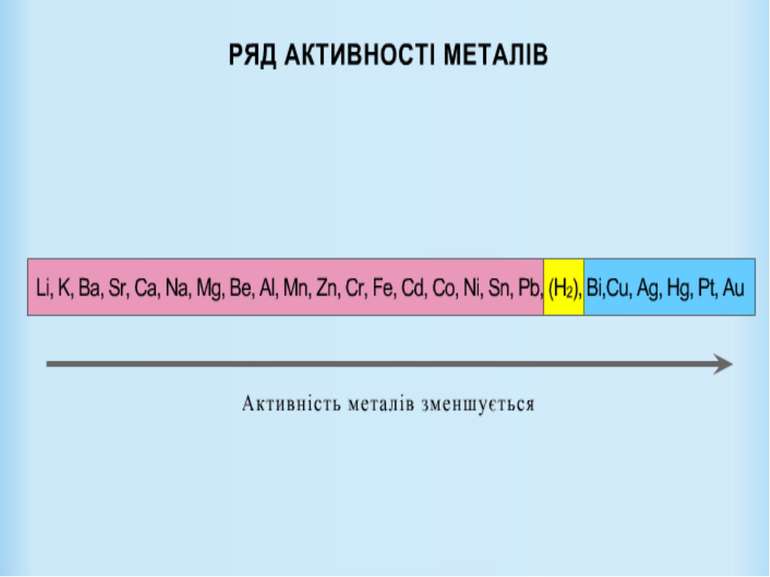
Взаємодія з металами: H2SO4 + Zn = ZnSO4 + H2 HCL + Cu = H2S + Mg = MgS + H2 H2SO4 + Na = Na 2SO4 + H2 (цинку сульфат ) (магнію сульфід ) (міді (II) сульфат ) Порт “ХІМІЧНИЙ”
Час в гостях летить швидко, і потрібно прощатися з хазяєвами. Але неочікуванно за вікном пішов дощ і «кислоти» нас не можуть відпустити, так як із дощовою водою вони несуть небезпеку. В чому небезпека кислотних дощів?
CO2 + H2O = H2CO3 H2SO4 SO2 + H2O = SO3 + H2O = H2SO3 3N02 +H2O = 2 HNO3 + NO Допишіть рівняння реакцій утворення кислотних дощів: Оксиди сульфуру, нітрогену і карбону попадають на землю в вигляді так званих «сухих опадів», підкислюючи грунт і воду. А також разом з дощем, снігом і градом («вологі опади»).
Накінець дощ скінчився і ми можемо спокійно повертатися додому. Сьогодні ви багато дізналася нового і цікавого про кислоти. Надіюсь ці знання вам згодяться в вашому житті! Запишіть домашнє завдання & 12, опрацювати, вправа 2 (письмово). 2.Повідомлення по темі «Використання кислот»
Схожі презентації
Категорії