Презентація на тему:
Карбонові кислоти. Вищі карбонові кислоти. Ліпіди
Завантажити презентацію
Карбонові кислоти. Вищі карбонові кислоти. Ліпіди
Завантажити презентаціюПрезентація по слайдам:
Тема: Карбонові кислоти 1. Номенклатура та ізомерія карбонових кислот. 2. Способи одержання карбонових кислот (створення карбоксильної групи). 3. Фізичні властивості, будова карбоксильної групи. 4. Хімічні властивості.
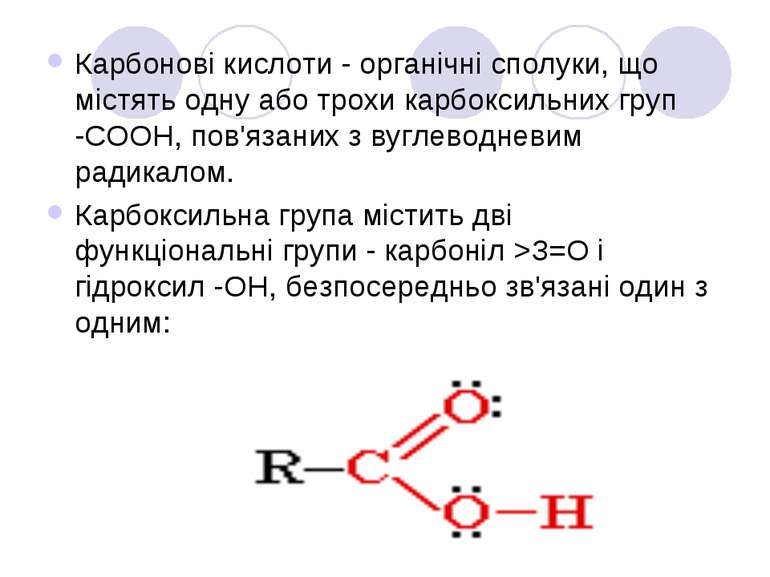
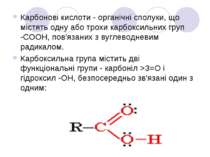
Карбонові кислоти - органічні сполуки, що містять одну або трохи карбоксильних груп -СООН, пов'язаних з вуглеводневим радикалом. Карбоксильна група містить дві функціональні групи - карбоніл >З=О і гідроксил -OH, безпосередньо зв'язані один з одним:
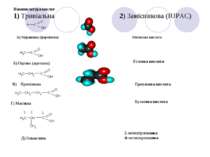
Номенклатура карбонових кислот Систематичні назви кислот даються за назвою відповідного вуглеводню з додаванням суфікса –ова й слова кислота. Часто використаються також тривіальні назви.
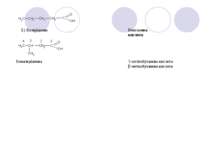
Номенклатура кислот 1) Тривіальна 2) Замісникова (IUPAC) А) Мурашина (форміатна) Метанова кислота В) Пропіонова Б) Оцтова (ацетатна) Етанова кислота Пропанова кислота Г) Масляна Бутанова кислота Д) Ізомасляна 2-метилпропанова -метилпропанова
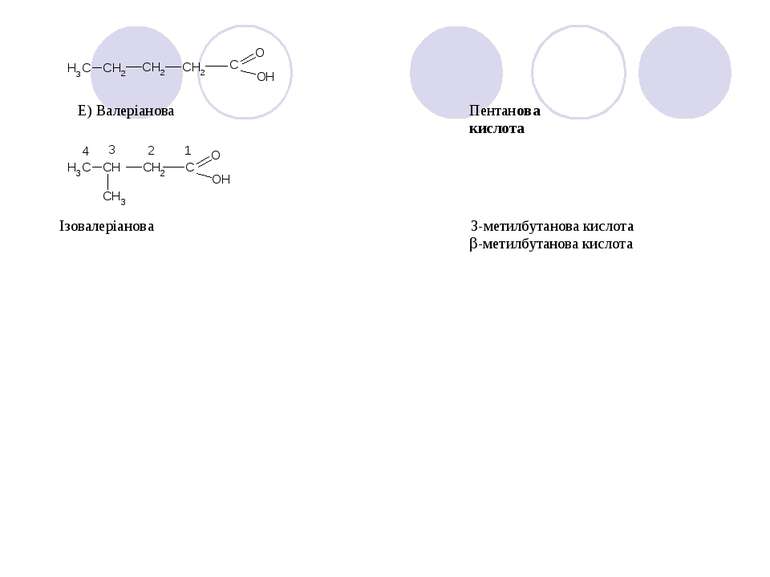
Е) Валеріанова Пентанова кислота Ізовалеріанова 3-метилбутанова кислота -метилбутанова кислота
Класифікація карбонових кислот Карбонові кислоти класифікують по двох структурних ознаках. По числу карбоксильних груп кислоти поділяються на: одноосновні (монокарбонові) Наприклад: багатоосновні (дикарбонові, трикарбонові й т.д.). По характері вуглеводневого радикалу розрізняють кислоти: насичені (наприклад, CH3CH2CH2COOH); ненасичені (CH2=CHCH2COOH); і ароматичні (RC6H4COOH).
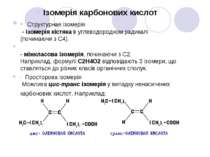
Ізомерія карбонових кислот · Cтруктурная ізомерія - ізомерія кістяка в углеводородном радикалі (починаючи з C4). - міжкласова ізомерія, починаючи з C2. Наприклад, формулі C2H4O2 відповідають 3 ізомери, що ставляться до різних класів органічних сполук. · Просторова ізомерія Можлива цис-транс ізомерія у випадку ненасичених карбонових кислот. Наприклад:
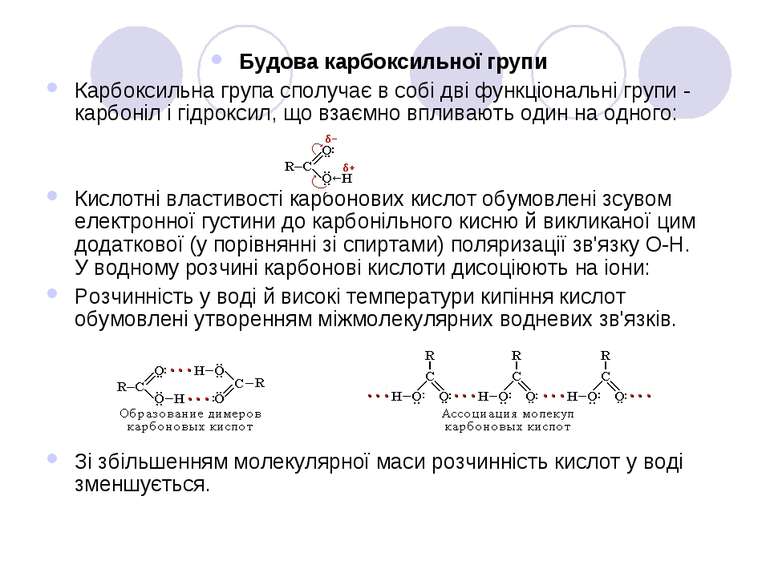
Будова карбоксильної групи Карбоксильна група сполучає в собі дві функціональні групи - карбоніл і гідроксил, що взаємно впливають один на одного: Кислотні властивості карбонових кислот обумовлені зсувом електронної густини до карбонільного кисню й викликаної цим додаткової (у порівнянні зі спиртами) поляризації зв'язку О-Н. У водному розчині карбонові кислоти дисоціюють на іони: Розчинність у воді й високі температури кипіння кислот обумовлені утворенням міжмолекулярних водневих зв'язків. Зі збільшенням молекулярної маси розчинність кислот у воді зменшується.
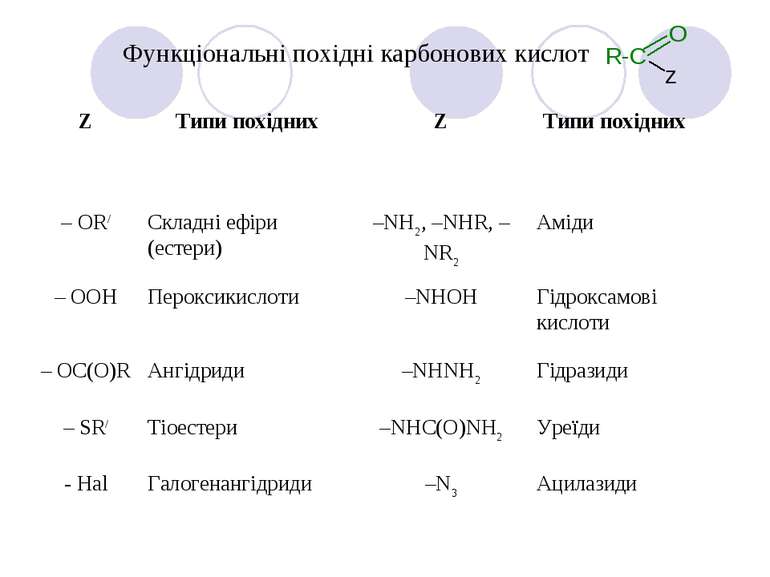
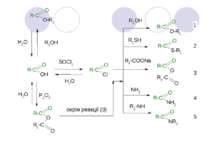
Функціональні похідні карбонових кислот Карбонові кислоти проявляють високу реакційну здатність. Вони вступають у реакції з різними речовинами й утворять різноманітні сполуки, серед яких велике значення мають функціональні похідні, тобто сполуки, отримані в результаті реакцій по карбоксильній групі.
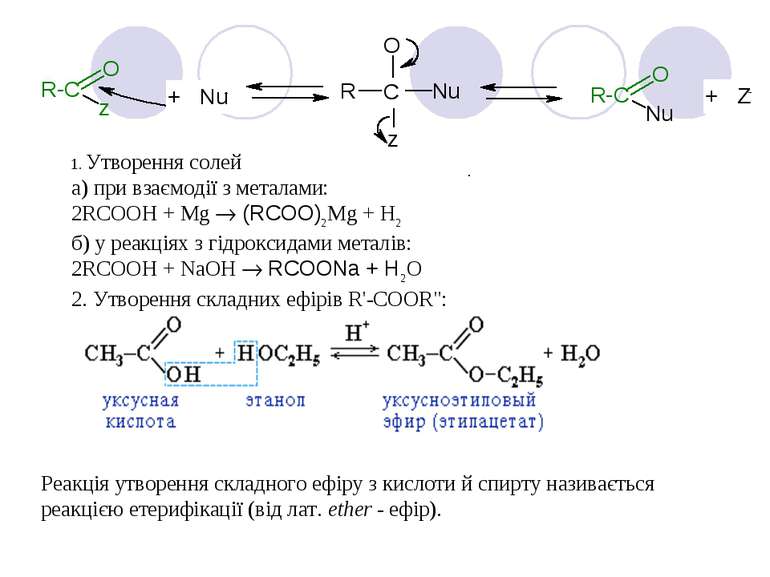
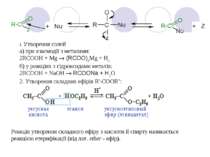
1. Утворення солей а) при взаємодії з металами: 2RCOOH + Mg ® (RCOO)2Mg + H2 б) у реакціях з гідроксидами металів: 2RCOOH + NaOH ® RCOONa + H2O 2. Утворення складних ефірів R'-COOR": Реакція утворення складного ефіру з кислоти й спирту називається реакцією етерифікації (від лат. ether - ефір).
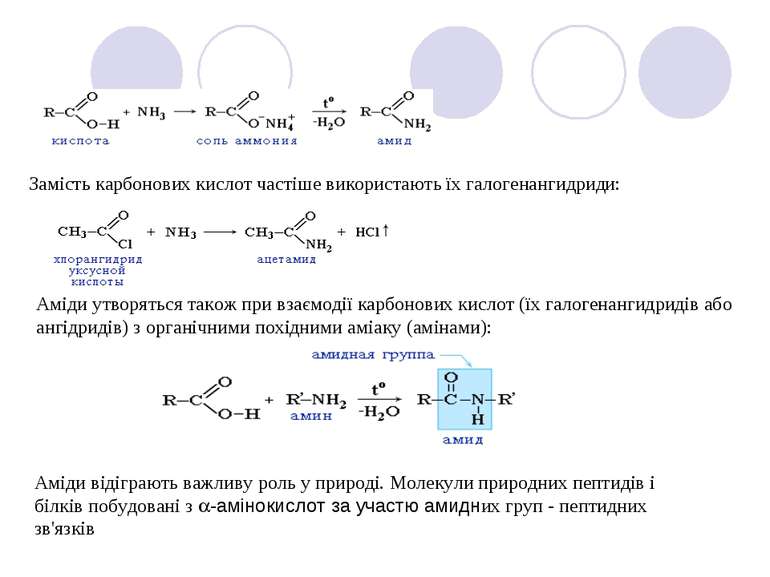
Замість карбонових кислот частіше використають їх галогенангидриди: Аміди утворяться також при взаємодії карбонових кислот (їх галогенангидридів або ангідридів) з органічними похідними аміаку (амінами): Аміди відіграють важливу роль у природі. Молекули природних пептидів і білків побудовані з a-амінокислот за участю амидних груп - пептидних зв'язків
Дана реакція оборотна. Зворотний процес - розщеплення складного ефіру при дії води з утворенням карбонової кислоти й спирту - називають гідролізом складного ефіру. Гідроліз у присутності лугу протікає необоротньо (тому що утворений негативно заряджений карбоксилат-аніон RCOO– не вступає в реакцію з нуклеофильним реагентом - спиртом). Ця реакція називається омиленням складного ефіру. Ефіри нижчих карбонових кислот і нижчих одноатомних спиртів мають приємний запах квітів, ягід і фруктів. Ефіри вищих одноосновних кислот і вищих одноатомних спиртів - основа природних восків. Наприклад, бджолиний віск містить складний ефір пальмітинової кислоти й мірицилового спирту (мірицилпальмітат) CH3(CH2)14–CO–OCH2(CH2)29CH3. Складні ефіри Складні ефіри - сполуки із загальною формулою R–COOR', де R й R' - вуглеводневі радикали. Складні ефіри можуть бути отримані при взаємодії карбонових кислот зі спиртами (реакція етерифікації). Каталізаторами є мінеральні кислоти.
Жири Жири - складні ефіри гліцерину й вищих одноатомних карбонових кислот. Загальна назва таких сполук - тригліцериди або триацилгліцерини, де ацил - залишок карбонової кислоти -C(O)R. До складу природних тригліцеридів входять залишки насичених кислот (пальмітинової C15H31COOH, стеаринової C17H35COOH) і ненасичених (олеїнової C17H33COOH, лінолевої C17H29COOH). Жири містяться у всіх рослинах і тваринах. Тваринні жири (баранячий, свинячий, яловичий і т.п.), як правило, є твердими речовинами з невисокою температурою плавлення (виключення - риб'ячий жир). Жири складаються головним чином із тригліцеридів насичених кислот. Рослинні жири - масла (соняшникове, соєве, бавовняне й ін.) - рідини (виключення - кокосове масло). До складу тригліцеридів масел входять залишки ненасичених кислот.
Продукт гідрогенізації масел - твердий жир (штучне сало, саломас). Маргарин - харчовий жир, складається із суміші гідрогенізованних масел (соняшникового, кукурудзяного, бавовняного й ін.), тваринних жирів, молока й смакових добавок (солі, цукру, вітамінів й ін.). Жирам як складним ефірам властива оборотна реакція гідролізу, що кеаталізується мінеральними кислотами. При участі лугів гідроліз жирів відбувається необоротньо. Продуктами в цьому випадку є мила - солі вищих карбонових кислот і лужних металів. Натрієві солі - тверді мила, калієві - рідкі. Реакція лужного гідролізу жирів, і взагалі всіх складних ефірів, називається також омиленням.
Установка для отримання води очищеної з кондуктометричним датчиком для контролю якості води очищеної
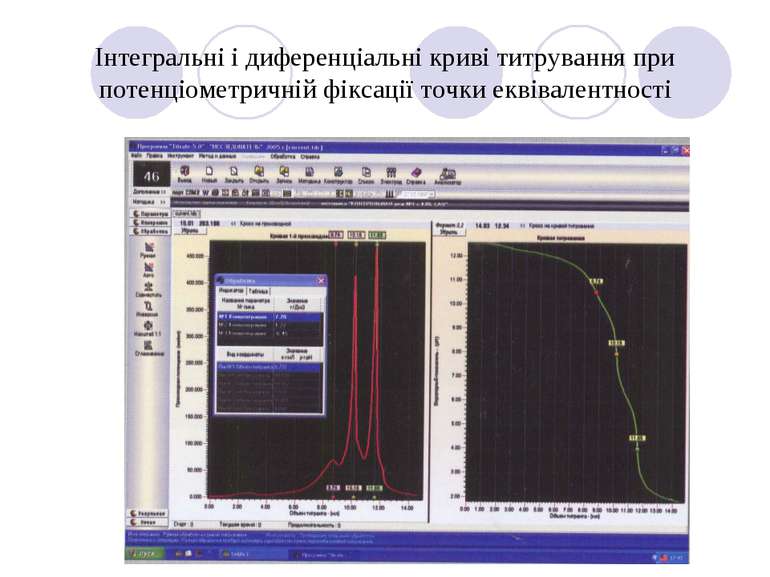
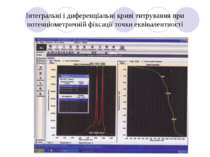
Інтегральні і диференціальні криві титрування при потенціометричній фіксації точки еквівалентності
Схожі презентації
Категорії