Презентація на тему:
застосування електроліху
Завантажити презентацію
застосування електроліху
Завантажити презентаціюПрезентація по слайдам:
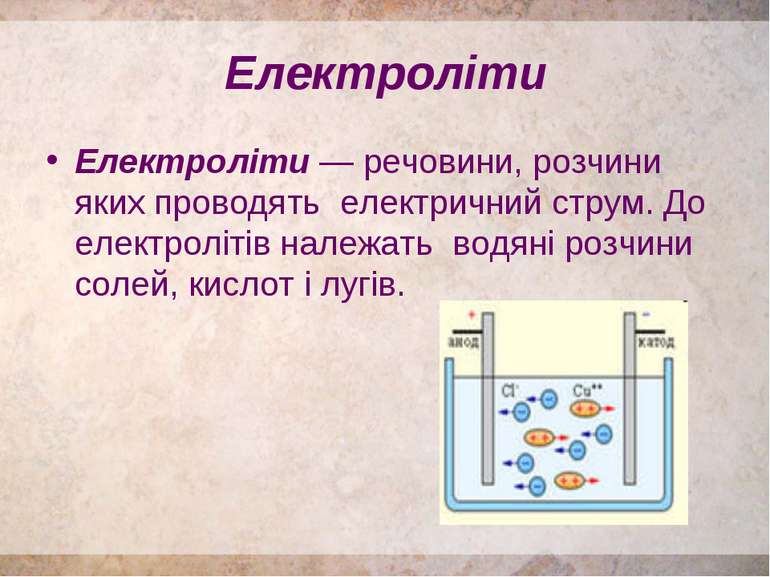
Електроліти Електроліти — речовини, розчини яких проводять електричний струм. До електролітів належать водяні розчини солей, кислот і лугів.
Електролітична дисоціація Електролітична дисоціація — розпад молекул електроліту на позитивні й негативні йони в розчині.
Електроліз При підвищенні температури питомий опір електроліту зменшується, а питома провідність збільшується. Проходження електричного струму через електроліт супроводжується явищем електролізу – виділення на електродах речовин, що входять до складу електроліту. Англійський фізик М. Фарадей в 1833 р установив закони електролізу.
Закон Фарадея (Перший закон електролізу) маса m речовини, що виділилась на електроді, пропорційна заряду q, що пройшов через електроліт Другий закон електролізу: електрохімічний еквівалент речовини пропорційний їх хімічному еквіваленту: де М – молярна маса, F – стала Фарадея, F = 96500 Кл/моль. Закони електролізу Майкл Фарадей (1791-1867)
Застосування електролізу Явище електролізу має широке застосування в електрометалургії (добування чистих металів); у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.
Схожі презентації
Категорії