Презентація на тему:
будова атома
Завантажити презентацію
будова атома
Завантажити презентаціюПрезентація по слайдам:
Модель атома за Томсоном Першимсвою модельзапропонувавДж. Томсон. ЗадумкоюТомсона, атомявлявсобою позитивнозарядженукулюрадіусомR = 10-8см,всерединіякоїмістятьсяелектрони. Масаатомарівномірнорозподіленаповсьомуйогооб’єму. МодельТомсонаотрималаназву«кексу зродзинками», де рольродзиноквиконувалиелектрони.
Модель атома за Резерфордом α-частинкивилітализджереларадіоактивноговипромінюванняК,розміщеногоусвинцевомуконтейнері, та проходиликрізьзолотуфольгу Ф.НавколофольгимігобертатисяекранЭ,якийспалахувавумісцяхпопадання α-частинок. Спалахиспостерігалися задопомогоюмікроскопа. Виявилось,щодеякіядрагелію, пройшовшикрізьфольгу, відхилялисяназначнікути, анезначнакількість навітьвідбиваєтьсяназад. Основнажкількістьядер проходилакрізьфольгу так, нібиїїтам і небуло.
НаосновіотриманихданихРезерфордсформулювавтаківисновки: - Вцентріатомарозташованепозитивнозарядженеатомнеядро,діаметрякого~ 10-15м. Вядрізосередженапрактично всямасаатома. - Навколоядра надоситьвеликійвідстанівідньогообертаютьсянегативнозарядженіелектрони(атомв основномупустотілий). - Позитивнийзаряд ядра по модулюдорівнюєдобуткузарядуелектронанапорядковийномерхімічногоелементавтаблиціМенделєєва. - Уціломуатом єелектричнонейтральною системою.
ПротиріччятеоріїРезерфорда: Ядроатомазарядженепозитивно, аелектрони– негативно.Цеозначає,щоміжнимиіснуєсилакулонівськогоперетягування.Тож, для того,щобелектронине впали на ядро, вониповиннірухатисянавколоньогоздоцентровимприскоренням. ЗаелектродинамікоюМаксвелла,електричнийзаряд,щоприскоренорухається, повиненнеперервновипромінюватиелектромагнітніхвилі.Ау нормальномустаніатоминевипромінюють. 2.Повсякденнийдосвідговорить простабільністьатомів. Але черезвипромінюванняелектромагнітниххвильенергіяелектронівповиннабулаб весь часзменшуватися, і результатом такогопроцесубулобїхпадінняна ядро.Розрахункипоказують,щопроцес«падіння»тривавбивсього10-8с. Насправдінічогоподібногоневідбувається. Атомистійкіі у нормальному (незбудженому)станіможутьіснуватибезмежнодовго, абсолютно невипромінюючиелектромагнітніхвилі.
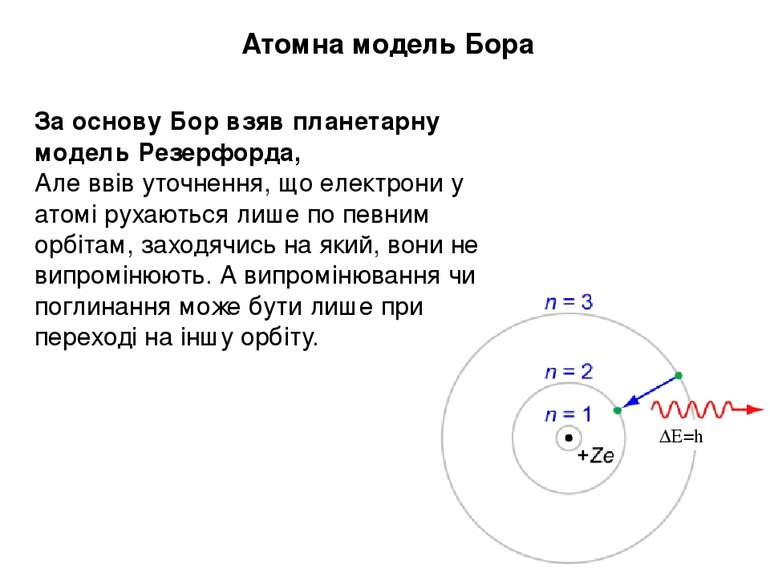
Атомна модель Бора За основу Бор взяв планетарну модель Резерфорда, Але ввів уточнення, що електрони у атомі рухаються лише по певним орбітам, заходячись на який, вони не випромінюють. А випромінювання чи поглинання може бути лише при переході на іншу орбіту. ∆Е=hν
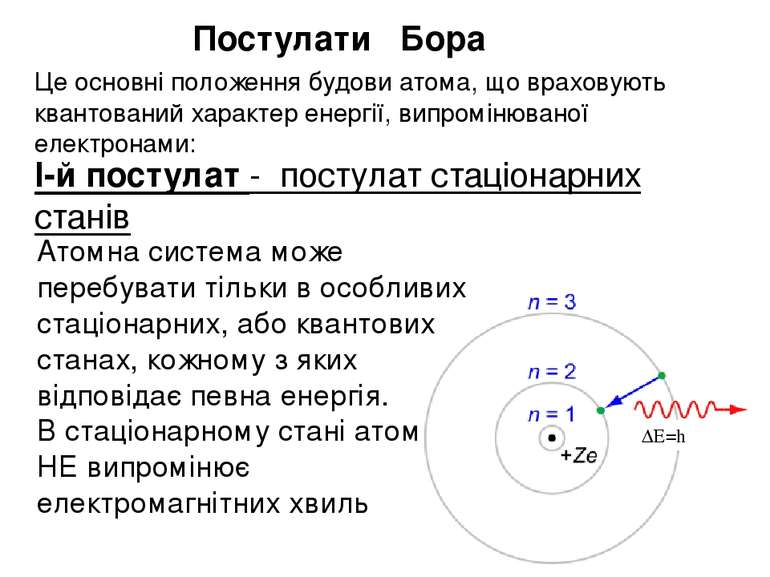
Постулати Бора Це основні положення будови атома, що враховують квантований характер енергії, випромінюваної електронами: Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія. В стаціонарному стані атом НЕ випромінює електромагнітних хвиль І-й постулат - постулат стаціонарних станів ∆Е=hν
У стаціонарному стані атома, електрон повинен мати дискретні (квантовані) значення моменту імпульсу. Постулати Бора ІІ-й постулат - правило квантування орбіт ∆Е=hν
Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, Енергію яких визначають за формулою: Постулати Бора ІІІ-й постулат - правило орбіт Поглинаючи світло, атом переходить із стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією. Усі стаціонарні стани, крім одного, є умовно стаціонарними. Нескінченно довго кожен атом може знаходитись лише в стаціонарному стані з мінімальним запасом енергії. Цей стан атома називається основним, всі інші — збудженими. ∆Е=hν
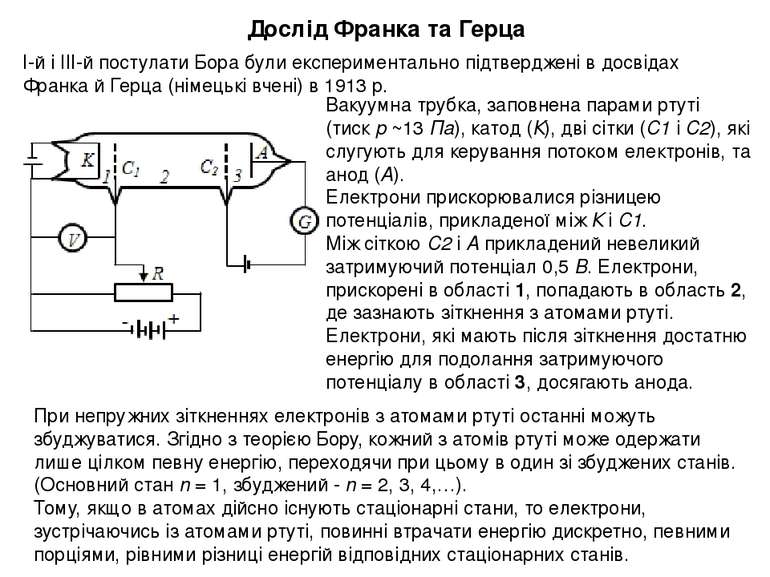
Дослід Франка та Герца І-й і ІІІ-й постулати Бора були експериментально підтверджені в досвідах Франка й Герца (німецькі вчені) в 1913 р. Вакуумна трубка, заповнена парами ртуті (тиск р ~13 Па), катод (К), дві сітки (С1 і С2), які слугують для керування потоком електронів, та анод (А). Електрони прискорювалися різницею потенціалів, прикладеної між К і С1. Між сіткою С2 і А прикладений невеликий затримуючий потенціал 0,5 В. Електрони, прискорені в області 1, попадають в область 2, де зазнають зіткнення з атомами ртуті. Електрони, які мають після зіткнення достатню енергію для подолання затримуючого потенціалу в області 3, досягають анода. При непружних зіткненнях електронів з атомами ртуті останні можуть збуджуватися. Згідно з теорією Бору, кожний з атомів ртуті може одержати лише цілком певну енергію, переходячи при цьому в один зі збуджених станів. (Основний стан n = 1, збуджений - n = 2, 3, 4,…). Тому, якщо в атомах дійсно існують стаціонарні стани, то електрони, зустрічаючись із атомами ртуті, повинні втрачати енергію дискретно, певними порціями, рівними різниці енергій відповідних стаціонарних станів.
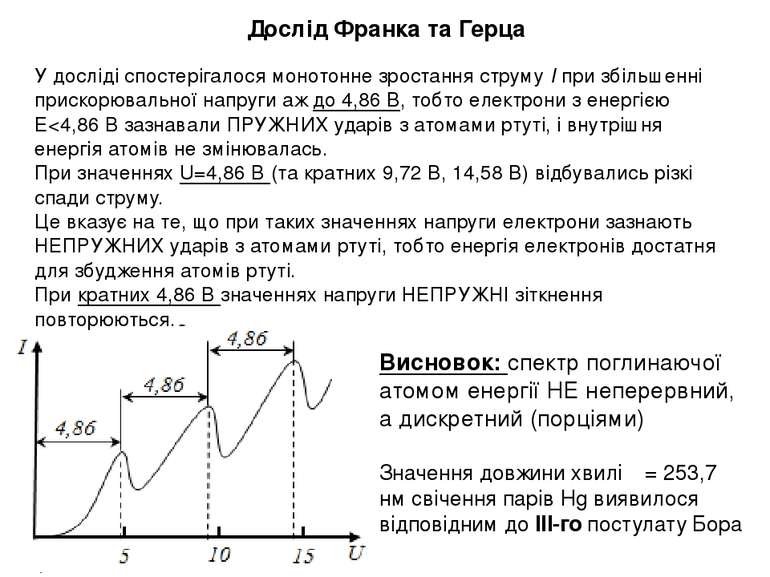
Дослід Франка та Герца У досліді спостерігалося монотонне зростання струму І при збільшенні прискорювальної напруги аж до 4,86 В, тобто електрони з енергією Е
Хвилі де Бройля На основі теорії Бора не можна дослідити атоми з числом електронів більше ніж один. В результаті поступово було визнано, що теорія Бора: позбавлена внутрішньої єдності, штучно поєднує класичну механіку з квантовими умовами, що призводить до неоднозначності самого квантування; дає неточні висновки за межами розрахунку атома гідрогену; не розв’язує проблеми про інтенсивність спектральних ліній і поляризацію випромінювання.
Хвилі де Бройля Усі ці недоліки усунуто в квантовій механіці, яка ґрунтується на докорінній зміні наших уявлень про природу матеріальних частинок. Першим кроком до створення нової квантової теорії стала гіпотеза про існування глибокої аналогії між властивостями світла і властивостями матеріальних частинок, висловлена 1924 р. французьким фізиком Л. де Бройлем. Подібно до того як в одних умовах виявляються корпускулярні властивості світла (як потоку частинок-фотонів), а в інших — хвильові, то й частинки речовини в певних умовах (у мікроявищах) можуть також виявляти хвильові властивості.
Хвилі де Бройля Описуючи закони руху найдрібніших частинок речовини, слід користуватися рівняннями, подібними до рівнянь хвильової оптики. Незабаром правильність цієї думки було підтверджено: рух електронів, протонів, атомів тощо керується законами, які є наслідком хвильових процесів. Так виникла хвильова (квантова) механіка, що описує явища в мікросвіті. Механіка І. Ньютона (порівняно з більш загальною хвильовою механікою) є граничним випадком, придатним лише для аналізу руху макроскопічних тіл зі швидкостями υ « с. Л. де Бройль обґрунтував припущення, що рух кожної частинки супроводжується хвильовим процесом, довжина хвилі якого λ пов’язана з масою m і швидкістю частинки υ простим співвідношенням (формула де Бройля):
Хвилі де Бройля Формулу де Бройля можна застосувати до будь-якої частинки незалежно від ступеня її складності. Проте хвильові властивості частинок виявляються не завжди. Це пов’язано з тим, що довжина хвилі де Бройля λ обернено пропорційна масі частинки. Для макротіл, тобто тіл великої маси, довжина хвилі дуже мала, і хвильовими властивостями таких тіл можна нехтувати. Проте кількісна зміна маси мікротіла призводить до появи якісно нових хвильових властивостей, які не притаманні макротілам. Наведені особливості свідчать про те, що закони, яким підлягають макротіла, не можна автоматично переносити на мікросвіт. Із співвідношення де Бройля випливає, що довжина хвилі для певного сорту частинок (m = const) залежить від їхньої швидкості. При однакових швидкостях довжина хвилі залежить від маси частинки. У знаменнику формули де Бройля стоїть імпульс частинки, його можна записати так:
Хвилі де Бройля де Бройлю вдалося деякою мірою обґрунтувати постулат Бора про стаціонарні орбіти. Для цього він припустив, що стаціонарними є такі стани електронів у атомі, коли на довжині їхньої орбіти вкладається ціле число дебройлівських довжин хвиль. Отже, умова стаціонарних орбіт, за де Бройлем, визначатиметься співвідношенням: звідки - ІІ-й постулат Бора
Схожі презентації
Категорії