Презентація на тему:
Будова ядра атома. Ізотопи
Завантажити презентацію
Будова ядра атома. Ізотопи
Завантажити презентаціюПрезентація по слайдам:
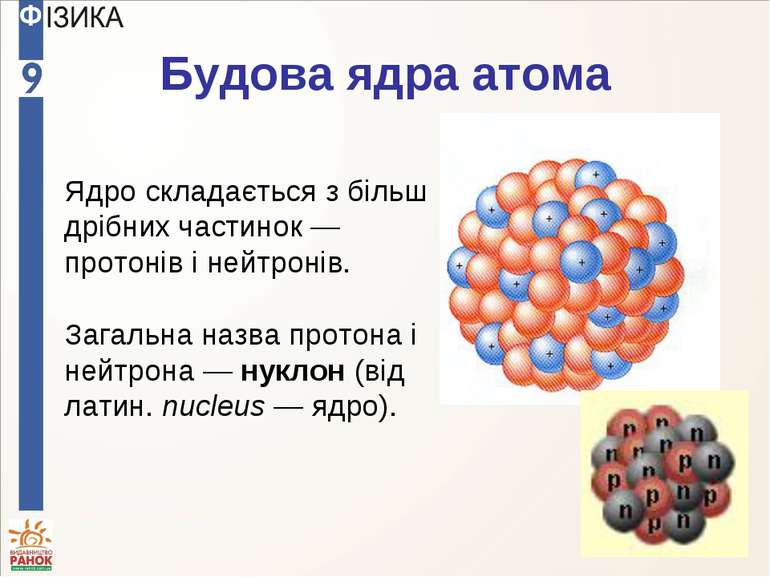
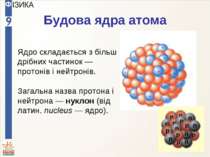
Будова ядра атома Ядро складається з більш дрібних частинок — протонів і нейтронів. Загальна назва протона і нейтрона — нуклон (від латин. nucleus — ядро).
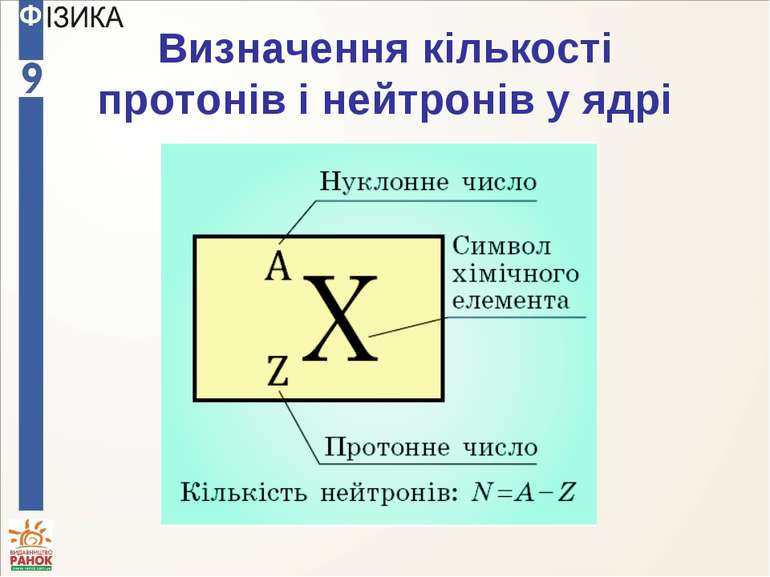
Масове число A, яке визначає атомну масу елемента, дорівнює сумі чисел нейтронів N і протонів Z у ядрі: Заряд ядра = n P порядковий номер елемента в періодичній системі Менделєєва = = Z
Приклади протони нейтрони масове число 2 4 2 протони нейтрони масове число 92 238 238 - 92=146
Завдання 1. Замість букв Z і A проставте відповідні числа: 2. Визначте: скільки нуклонів у ядрі атома Літію; скільки протонів і скільки нейтронів у ядрі атома Нітрогену; скільки електронів на оболонці.
Як можуть настільки близько співіснувати в ядрі протони — частинки, заряджені однойменним зарядом? Їх утримують ядерні сили > в 100 разів
ГЕЙЗЕНБЕРГ ВЕРНЕР (1901—1976), німецький фізик, створив теорію будови атомного ядра (1932г.) ІВАНЕНКО ДМИТРО (1904 - 1994), російський та український фізик-теоретик, першим запропонував протонно-нейтронну модель ядра
Ізотопи Хімічні властивості ізотопів одного й того самого елемента є однаковими, а ядерні — різними. протій дейтерій тритій ізотоп Гідрогену, відкритий у 1963 р.
Схожі презентації
Категорії