Презентація на тему:
Атом. Будова атома
Завантажити презентацію
Атом. Будова атома
Завантажити презентаціюПрезентація по слайдам:
Найменша електронейтральна частинка хімічного елемента,яка несе усі властивості елемента. Атом
Розмір атомів Атом має дуже малі розміри 1 нм = 10-9м Наприклад, радиус атома заліза 0,13 нм.
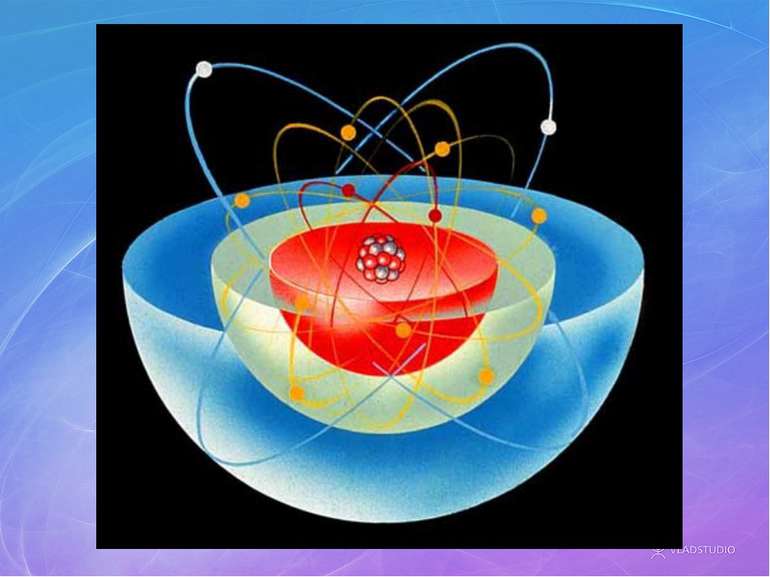
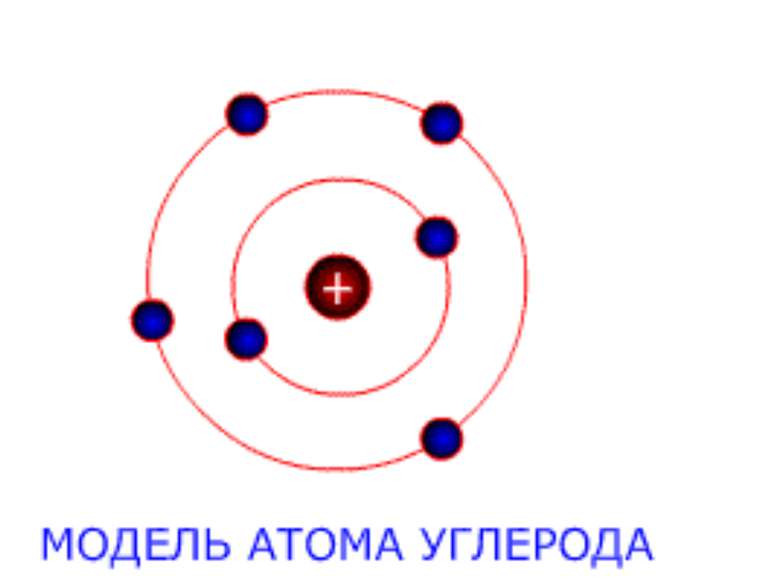
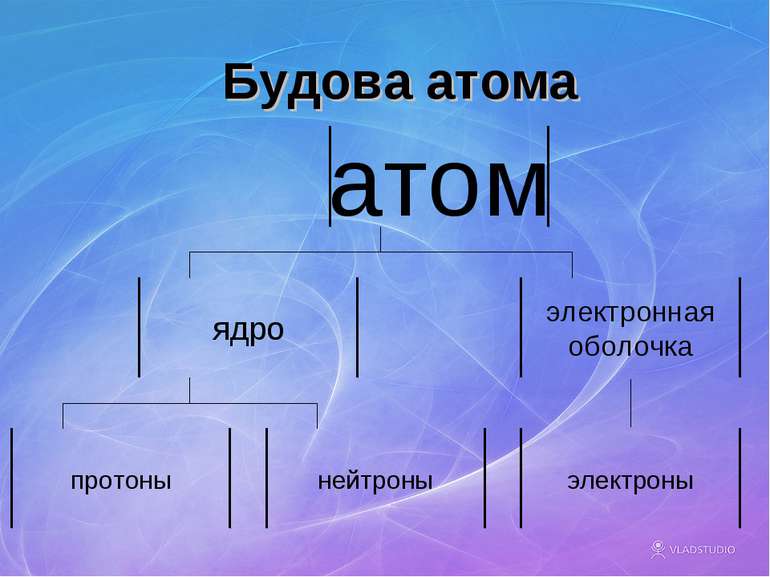
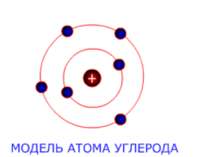
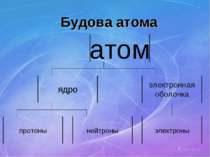
Будова атомів Атом складається з позитивно зарядженого ядра, довкола якого обертаються негативні электрони. Будову атома можна представити у вигляді, так званої, планетарної моделі, яку запропонував Эрнест Резерфорд. Вона представляє собою міні-сонячну систему, де у центрі знаходиться ядро (Сонце), довкола якого обертаються електрони (планеты сонячної системи).
Протони і нейтрони Основна маса атома знаходиться в ядрі, яке складається з частинок двох видів: протонів нейтронів. Протони мають заряд, равный заряду електрона, але протилежний за знаком (+), і масу, рівну 1а.е.м. Протони позначаються знаком р+. Нейтрони не мають заряда, тобто вони електронейтральні, і мають масу приблизно рівну масі протона, т.е. 1. Позначают n0.
Електроны До складув атома, окрім позитивно зарядженого ядра, входять негативно заряджені частинки – електроны. Електричний заряд електрона чисельно дорівнює заряду протона (позитивному). В нейтральному атомі число електронов равно числу протонів у його ядрі. Маса електрона равна приблизно 1/2000 а. е. м., т. е. електрон приблизно в 2000 раз легше протона чи нейтрона.
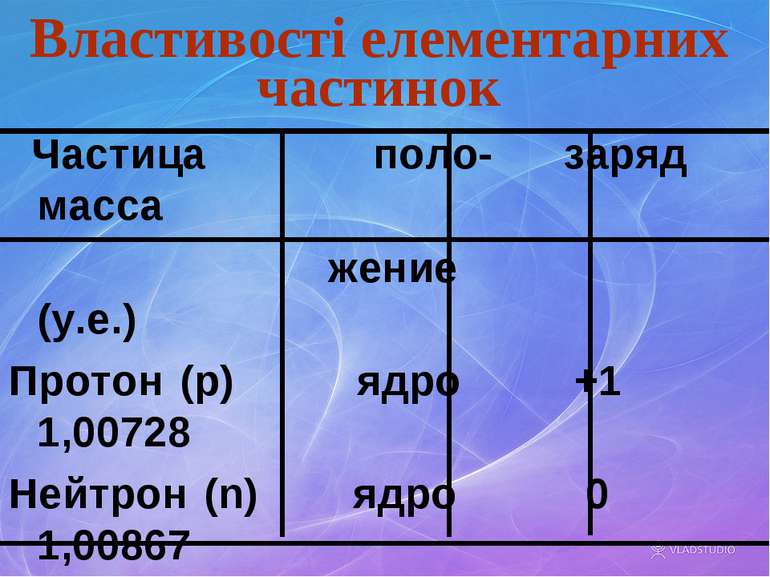
Властивості елементарних частинок Частица поло- заряд масса жение (у.е.) Протон (p) ядро +1 1,00728 Нейтрон (n) ядро 0 1,00867 Позитрон (е) ядро +1 0,00055 Электрон(е) обо- -1 0,00055 лочка
Масове число Сума числа протонів і нейтронів називається масовим числом. Так як атом електронейтральний, то число протонів і электронів в атомі однакове. Масою електронів можна знехтувати, то можна вважати, що вся маса атома зосереждена в ядрі.
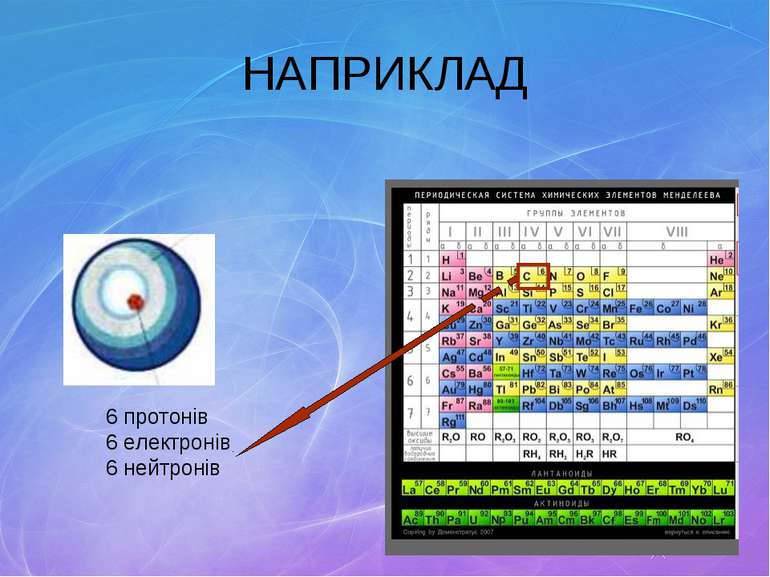
Состав атома Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются в порядке возрастания зарядов их атомных ядер. Поскольку каждый атом электронейтрален, то число протонов в ядре атома равно числу электронов в этом же атоме. Порядковый номер элемента в таблице Менделеева указывает число электронов в атоме и равное ему число протонов в ядре. Принадлежность атома тому или иному химическому элементу определяется зарядом его ядра. Поэтому число протонов, составляющих заряд ядра, у атомов одного и того же химического элемента строго определенное. В то же время содержание нейтронов в ядрах одного и того же элемента может быть переменным. Следовательно, массы атомов одного элемента могут быть различными. Приведенные в таблице Д. И. Менделеева атомные массы элементов – это средние атомные массы природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому они могут отличаться от целых чисел.
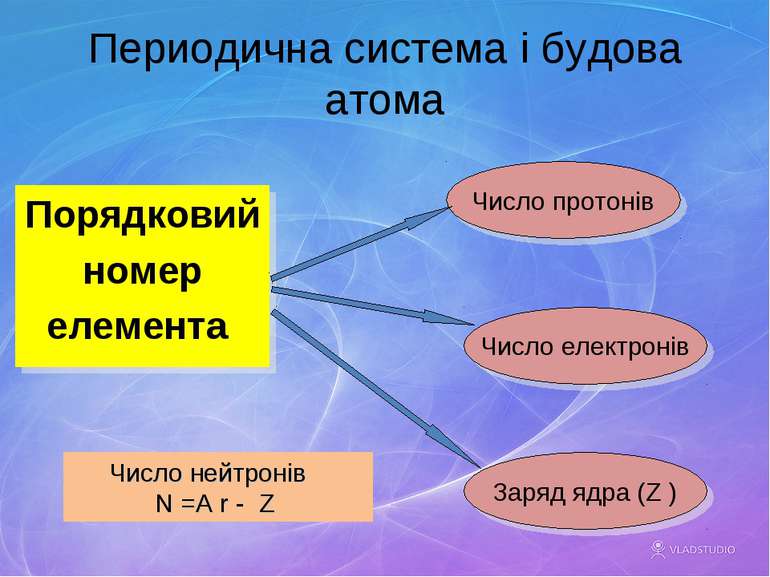
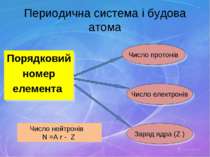
Периодична система і будова атома Порядковий номер елемента Число протонів Число електронів Заряд ядра (Z ) Число нейтронів N =A r - Z
Ядро Величина Позначення Кількістні співвідношення Масове число A A = Z + N Число протонів Z Z = åp Число нейтронів N N = ån
Ізотопи ІЗОТОПИ – це атоми одного хімічного елемента , які мають однакове число протонів і електронів, але різне нейтронів і різні масові числа. 17Сl и 17Cl 35 37
Алгоритм 1.Оберіть елемент в ПСХЕ і запишіть його знак 2.Запишіть атомний номер елемента Z и його масове число А 3.Запишіть значення Z зліва внизу і значення А зліва зверху у знака елемента 4.Визначте склад атома: число протонів число електронів число нейтронів 5.Запишіть склад атома 6.Зробіть висновки Бор В Z=5 А=11 В N (р)=5 N (е)=5 N (n)=11-5=6 В (5р, 6n )5е Ядро атома бора складається з п’яти протонів і шести нейтронів, а електронна оболонка - з п’яти електронів
Схожі презентації
Категорії